百济神州 BTK 一季度全球销售突破 14 亿元,海外收入大涨超一倍
时间:2023-05-08 10:27:55 热度:37.1℃ 作者:网络
5 月 4 日,百济神州发布 2023 年第一季度美股业绩报告以及 A 股业绩快报。财报显示,百济神州全球收入持续攀升,一季度实现总营收 30.66 亿元,同比增长 57.4%。其中,产品销售收入达到 28.08 亿元,同比增长 69%。
百济神州联合创始人、董事长兼首席执行官欧雷强(John V. Oyler)先生表示:「我们的团队持续推进创新产品管线的开发,力争为癌症患者带来新的疗法,与此同时,我们的两大核心产品百悦泽:registered:和百泽安:registered:在第一季度的全球销售额取得了显著增长。」
百济神州首席财务官王爱军(Julia Wang)女士表示:「我们第一季度取得的业绩彰显了百济神州在卓越的运营和财务规范方面所取得的进展,从而更好地践行为全球更多患者带来可及、可负担的药物的使命。随着产品收入的增长速度继续显著地超过运营费用的增速,百济神州已经为实现未来的进一步增长做好充分准备。」
BTK 全球放量显著
海外收入同比增长超一倍
2023 年第一季度,百济神州核心产品 BTK 抑制剂百悦泽:registered:(泽布替尼)的全球销售额达到 14.47 亿元,上年同期为 6.63 亿元,同比增长超过一倍。
随着在多个已获批适应症中的快速放量,泽布替尼在美销售额达 9.5 亿元,相比上年同期 4.31 亿元,增长超过一倍。目前,泽布替尼在美国市场的收入已占其全球销售额近七成,来自海外主流市场的收入贡献显著。在国内,泽布替尼亦增长稳健,销售额达 3.29 亿元,上年同期为 2.13 亿元。IQIVIA 数据显示,截至 2022 年底,泽布替尼已成为国内 BTK 领域市场份额第一的产品。
得益于在全球性 3 期头对头研究中,对比第一代 BTK 伊布替尼取得显著的优效性结果,泽布替尼如今已经确立了全球「同类最优」的优势地位。迈入 2023 年,泽布替尼在核心适应症上连续攻城略地,继年初先后在欧洲、美国获得慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的批准后,第一季度,泽布替尼再次在澳大利亚获批这一关键适应症,这无疑将进一步打开全球市场的增长空间。当前,泽布替尼在美国国家癌症综合网络(NCCN)指南中,已是 CLL/SLL 领域中推荐级别最高的治疗方案。
泽布替尼全球项目开发进度甘特图
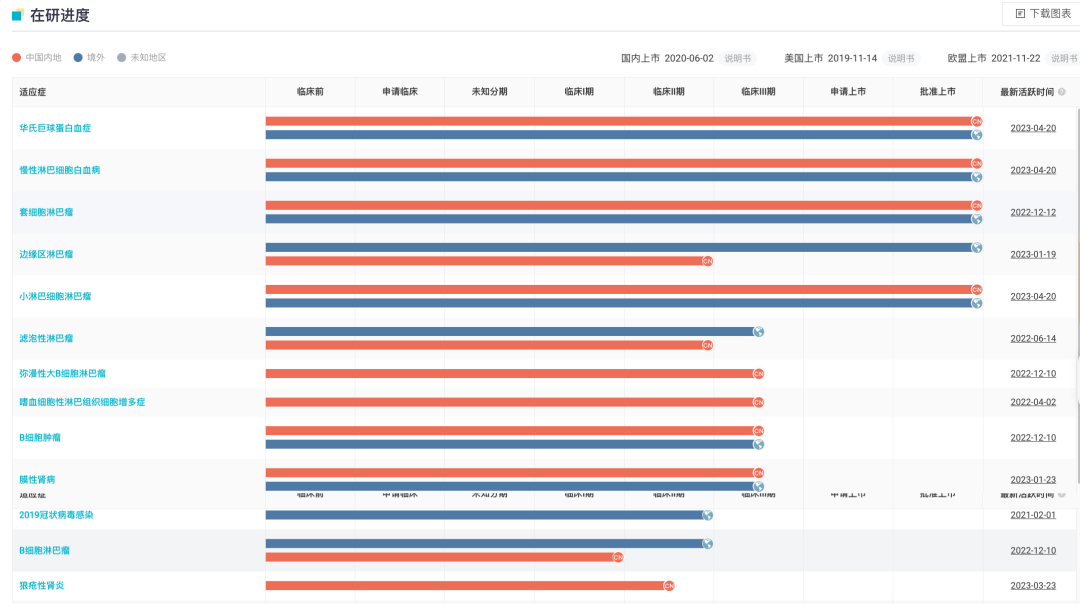
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
与此同时,BTK 全球市场竞争格局正在加速变化。日前,伊布替尼由于未能达到预期的临床获益,此前两项批准的适应症已被撤回。由此,泽布替尼成为边缘区淋巴瘤(MZL)二线治疗中全球唯一获批上市的 BTK 抑制剂。
目前,泽布替尼已累计在全球超过 65 个国家及地区获批,在欧美等主流发达国家实现广泛覆盖的同时,也已经在多个新兴市场上市。财报显示,泽布替尼今年还有望在超过 30 个市场取得新增的药政批准。随着泽布替尼不断巩固优势地位,其在全球有望迎来高速放量与市场拓展,这也成为业界对百济神州 2023 年的核心关注点之一。
作为百济神州首款在国际市场获批的创新药,泽布替尼上市三年多时间以来屡获突破,不仅在全球医药市场实现广泛覆盖,更取得了显著的销售收入。为了构建血液肿瘤领域的全球商业化能力,自 2019 年起,百济神州在海外逐步打造了一支超过 200 人的商业化团队,人员均在当地招募,覆盖、美国、欧洲、澳大利亚等多个市场。泽布替尼在国际市场接连取得的成功,一方面印证了公司自主研发产品的差异化竞争力,同时也证明了其自主化布局全球商业化能力的正确性与强大执行力。
PD-1 国内收入增速稳健
海外布局有望年内实现多点开花
百济神州另一款拳头产品 PD-1 百泽安:registered:(替雷利珠单抗)第一季度亦表现不俗,在国内市场实现 7.86 亿元销售额,美股财报显示,同比增幅达 31%。在内卷化的 PD-1 市场竞争中,替雷利珠单抗凭借产品自身差异化的竞争力和广泛的适应症布局,在商业化放量、适应症获批数量上均领先同类产品。数据显示,截至 2022 年底,百泽安:registered:已在国内 PD-1 领域取得第一的市场份额。
目前,替雷利珠单抗在国内获批 10 项适应症,其中 9 项已获批适应症已被纳入国家医保目录,是国内获批适应症最广泛、纳入医保适应症数量最多的 PD-1 产品。
在全球化布局方面,替雷利珠单抗亦走在行业前列,国际市场版图布局清晰。财报显示,替雷利珠单抗已在全球 8 个国家或地区递交新药上市申请,包括美国、欧盟、英国、瑞士、澳大利亚、新西兰、韩国、巴西等,申报适应症包括食管鳞癌(ESCC)、非小细胞肺癌(NSCLC)等多个重要领域。
财报显示,替雷利珠单抗有望今年内实现「多点开花」,全力进军国际市场。在美国,FDA 正在审评的替雷利珠单抗用于二线 ESCC 的新药上市申请,预计将于今年第二季度进行现场核查,并在年内做出审评决议;在澳大利亚,其用于一线和二线治疗 NSCLC 以及二线治疗 ESCC 的新药上市申请有望在今年下半年取得相关监管决定;在欧洲,用于一线和二线治疗 NSCLC,以及用于二线治疗 ESCC 的新药上市申请,预计也将在今年内取得相关监管决定。
替雷利珠单抗全球临床试验分布
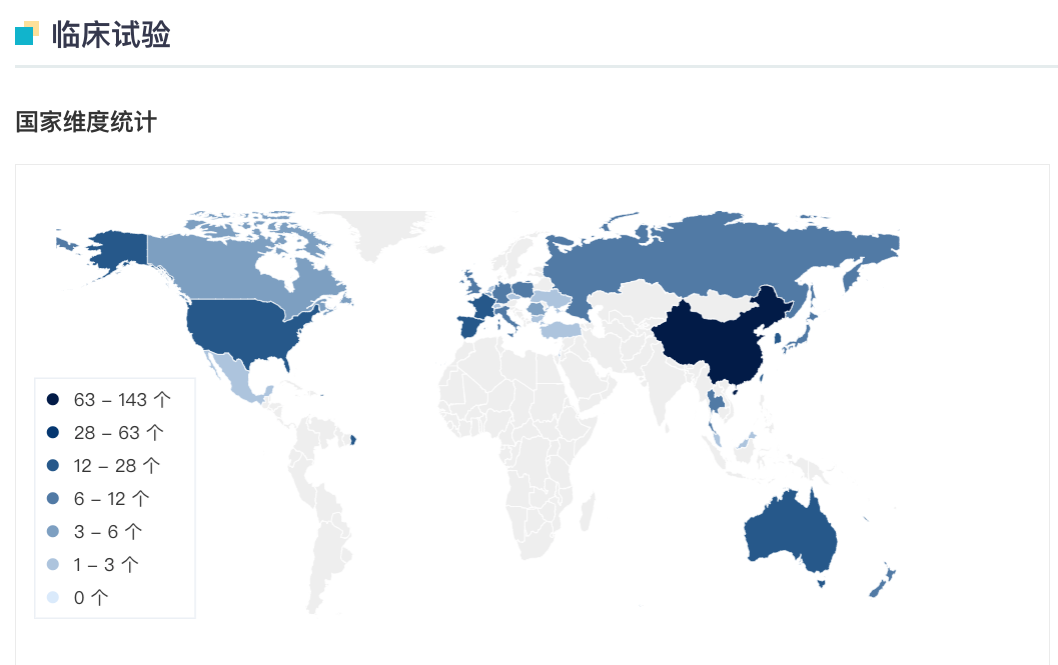
来自:Insight 数据库网页版
替雷利珠单抗在国内市场的亮眼表现,彰显了百济神州在中国强大的商业化能力、准入能力与推进效率。目前,百济神州在中国已构建了一支超过 3,300 人的大规模、立足于科学的商业化团队,覆盖医院数量超过 1,000 家。凭借商业化规模、效率与质量的齐头并进,百济神州正在持续创造增长动能,进一步巩固其在中国肿瘤市场的领导地位。
自主临床研发稳步推进
全球化战略布局纵深发展
目前,百济神州约有 50 款产品或临床候选物处于临床开发或商业化阶段,这一丰富、多元化的研发管线已经广泛覆盖了全球超过 80% 的癌症类型(按发病率计)。财报显示,公司多款自主研发的临床药物具备差异化竞争力,目前正在持续推进中,包括已经在临床 3 期阶段的抗 TIGIT 抗体欧司珀利单抗、处于临床 2 期阶段的 BCL-2 抑制剂、以及处在临床早期阶段的抗 OX40 抗体、潜在「同类首创」HPK1 抑制剂和 CEA × 4-1BB 双特异性抗体等。
其中,差异化的 BCL-2 抑制剂 BGB-11417 有望成为百济又一款「同类最优」药物。目前,百济正在持续推动 BGB-11417 用于治疗 R/R 套细胞淋巴瘤(MCL)和 R/R CLL/SLL 的潜在注册可用关键性 2 期研究的临床开发。今年下半年,百济神州将启动 BGB-11417 联合泽布替尼用于一线 CLL 的全球关键性试验。
BGB-11417 全球开发进度甘特图
来自:Insight 数据库网页版
临床前研究方面,百济神州已建立了广泛的药物模式和技术平台,覆盖小分子、大分子、双抗/多抗、mRNA、ADC、细胞治疗等多种前沿的药物形式。百济神州现拥有超 60 项临床前项目,且大部分具有同类首创潜力。自 2024 年起,公司预计每年将推动 10 款以上新的分子药物进入临床阶段,开启新一阶段的研发浪潮。
在生产层面,百济神州已在全球范围内构建了独立的自主生产能力,并且正在不断扩大这一优势。财报显示,在广州,百济神州启动了抗体偶联药物(ADC)生产设施及全新生物药生产大楼的建设,预计将于 2024 年完工;在苏州,百济神州启动了新的研发中心的建设,以提高临床和商业化生产能力,预计将于 2025 年完工。在美国新泽西州,全新生产基地和临床研发中心已完成钢梁吊装封顶。
经过十三年的发展,目前百济神州已成为一家真正意义上的全球性生物科技企业,在全球五大洲、约 40 个办事处拥有超过 9,400 名员工。2023 年以来,百济神州进一步拓展其全球化的深度和广度。今年 4 月,百济神州宣布正式启用巴西圣保罗办事处,加快其在拉丁美洲市场的业务拓展。
此外,百济也于一季度发布了全新的 ESG 报告,从全球健康、赋能员工、可持续创新、支持社区,以及负责任运营五大重点领域推进发展目标,进而满足患者、员工、社区等多元利益相关方的需求。第一季度百济神州取得的稳健表现,为其全年发展奠定良好的开局,未来多项里程碑进展将更加值得期待。


