SOHO 2022:Loncastuximab Tesirine在复发/难治性DLBCL患者中表现出有前景的抗肿瘤活性
时间:2022-10-13 15:53:59 热度:37.1℃ 作者:网络
复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者通常在接受标准治疗后效果不佳。Loncastuximab tesirine(Loncastuximab tesirine-lpyl;Lonca)是一种新型的抗体药物偶联物(ADC),由吡咯并苯并二氮杂卓(PBD)二聚体细胞毒素与抗CD19单克隆抗体偶联而成,适用于既往接受≥2线系统治疗后的R/R DLBCL患者。有临床前证据表明,在靶向CD19 ADC治疗中加入利妥昔单抗可能会延长肿瘤控制时间。基于此,研究者开展了LOTIS-5试验,旨在评价Lonca+R(Lonca-R)与R+吉西他滨+奥沙利铂(R-GemOx)的标准免疫治疗在R/R DLBCL患者中的疗效。根据正在进行的III期LOTIS-5试验(NCT04384484)第1部分的数据,Loncastuximab Tesirine-lpyl(Zynlonta)联合利妥昔单抗(Rituxan)在复发性/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者中表现出令人鼓舞的抗肿瘤活性和可接受的安全性特征,该试验数据在第10届美国血液肿瘤学会(SOHO)年会上公布。
该研究是一项III期、随机、开放标签、两部分、双臂、多中心研究。第1部分为非随机安全性导入期,共纳入20例患者,以确定Lonca-R的安全性。第2部分中,约330例患者将以1:1的比例随机分配接受Lonca-R或R-GemOx治疗。关键纳入标准为:(1)年龄≥18岁;(2)诊断为DLBCL(包括从惰性淋巴瘤转化而来的DLBCL)或伴有MYC和BCL2和/或BCL6重排的高级别B细胞淋巴瘤的患者;(3)既往接受过≥1线系统治疗;(4)不符合造血干细胞移植条件;(5)根据Lugano 2014标准可评估的疾病。
主要终点为无进展生存期(PFS)。次要终点为总生存期(OS)、总缓解率(ORR)、安全性、缓解持续时间(DOR)、药代动力学以及患者报告结果的变化。
在数据截止日期2022年02月28日时,中位随访持续时间为5.83个月(1.9-10.3)。
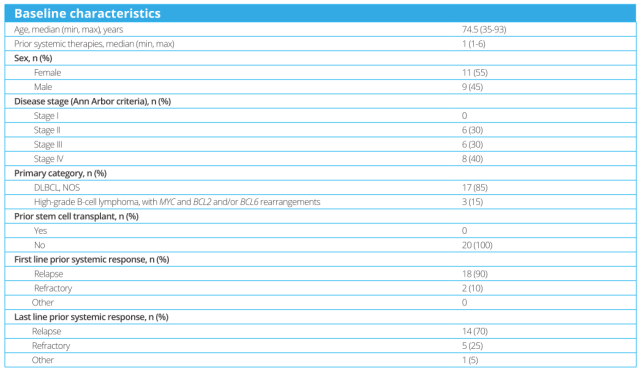
安全性导入期的20例患者的中位年龄为74.5岁(范围35-93岁),既往接受的治疗中位线数为1(范围1-6)。患者的基线特征如表1所示。
表1
截止到2022年2月28日,中位给药次数为5次(范围:1-8),中位随访时间为5.83个月(范围:1.9-10.3)。
19例(95%)患者发生≥1种治疗期间出现的不良事件(TEAE),10例(50%)患者出现≥3级TEAE。最常见的所有等级TEAE为皮疹(5[25%])、疲劳(4[20%])和γ-谷氨酰转移酶升高(4[20%])。最常见的≥3级TEAE为γ-谷氨酰转移酶升高(3[15%])、丙氨酸氨基转移酶升高(2[10%])和中性粒细胞减少症(2[10%])。患者的ORR为15/20(75%)。共有8/20(40%)和7/20(35%)的患者分别达到完全缓解和部分缓解。疗效和安全性如表2所示。
表2
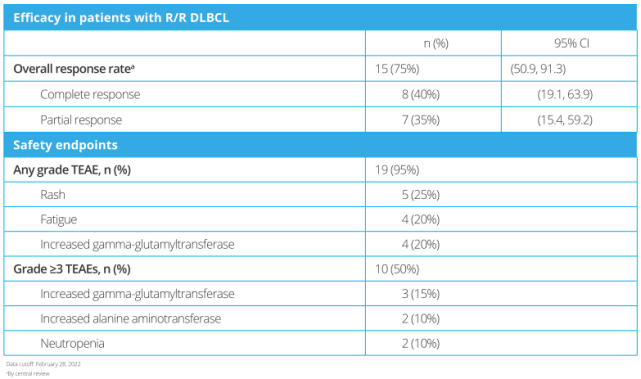
联合治疗的客观缓解率(ORR)为75%(n=15;95%CI:50.9%-91.3%)。此外,40%(n=8;95%CI,19.1%-63.9%)的患者达到完全缓解,35%(n=7;95%CI,15.4%-59.2%)的患者达到部分缓解。
在获得第1部分令人鼓舞的数据后,LOTIS-5研究现已扩展至研究的第2部分。研究的第2部分将包括2022年1月开始的1:1随机化,招募正在进行中。
“Loncastuximab联合利妥昔单抗未显示新的安全性信号,在非随机化安全性导入期内,在复发性/难治性DLBCL患者中显示出令人鼓舞的抗肿瘤活性,”主要研究者、美国内华达州拉斯维加斯综合癌症中心的Edwin C. Kingsley博士在数据展示中表示。
在标准治疗后进展的复发性或难治性DLBCL患者往往预后不佳。
Loncastuximab tesirine是由靶向CD19的人源化单克隆抗体与细胞毒素-吡咯并苯并二氮杂(PBD)二聚体偶联而成的抗体-药物偶联物(ADC),一旦与表达CD19的细胞结合,它就能够被细胞内化,并释放细胞毒素。
临床前数据显示,在抗CD19 ADC治疗的基础上加用利妥昔单抗可能延长肿瘤控制时间。该依据作为LOTIS-5研究的基础。
LOTIS-5是一项随机、2部分、双臂、多中心研究。试验的第1部分在非随机、安全性导入期入组了20例患者,接受Loncastuximab Tesirine+利妥昔单抗治疗,以确定治疗方案的安全性。在研究的第2部分,约330例患者将被随机分配接受试验方案或标准化学免疫治疗,包括利妥昔单抗加吉西他滨和奥沙利铂。
符合入组条件的患者年龄≥18岁且病理学诊断为复发性/难治性DLBCL,包括从惰性淋巴瘤或伴MYC和BCL2和/或BCL6重排的高级别B细胞淋巴瘤转化而来的DLBCL。患者须在至少一线既往全身治疗期间发生进展,不适合接受干细胞移植,并且有可测量的疾病。此外,如果既往接受过CD19靶向治疗,患者的ECOG体能状态必须为0-2,器官功能充分,并证实CD19阳性。
如果患者既往接受过Loncastuximab Tesirine或利妥昔单抗、吉西他滨和奥沙利铂治疗,或者分别在开始试验前30天或60天内接受过自体或同种异体干细胞移植治疗,则不符合入组条件。活动性中枢神经系统受累者或有慢性HBV感染的证据者不符合参加研究资格。此外,开始研究药物治疗前14天内接受过大手术放疗或化疗,均不符合入组条件。
安全性导入期中评价的患者接受0.15mg/kg的Loncastuximab Tesirine和375mg/m^2的利妥昔单抗,每3周一次,共2个周期,随后接受0.075mg/kg和375mg/m^2的Loncastuximab Tesirine,最多额外6个周期。
研究的主要终点是通过独立中心审查确定的无进展生存期。III期试验的次要终点包括总生存期、ORR、安全性、缓解持续时间、药代动力学参数和患者报告结局的变化。
试验中接受治疗的患者的中位年龄为74.5岁(35-93),既往全身治疗的中位次数为1(1-6)。大多数患者为女性(55%;n=11);45%为男性(n=9)。入组患者的疾病分期为II期(30%;n=6)、III期(30%;n=6)或IV期(40%;n=8)。大多数(85%;n=17)患者出现DLBCL(未另行说明),15%(n=3)患者出现高级别B细胞淋巴瘤伴MYC和BCL2和/或BCL6重排。
评价的所有患者既往均未接受过干细胞移植,大多数患者在一线治疗期间复发(90%;n=18)。
中位给药次数为5次(1-8)。
在安全性方面,95%(n=19)的患者发生至少1例治疗中出现的不良反应(TEAE),50%(n=10)的患者发生≥3级TEAE。
研究记录的最常见TEAE为皮疹(25%;n=5)、疲乏(20%;n=4)和γ-谷氨酰转移酶升高(20%;n=4)。≥3级TEAE包括γ-谷氨酰转移酶升高(15%;n=3)、丙氨酸氨基转移酶升高(10%;n=2)和中性粒细胞减少症(10%;n=2)。
参考来源
Kingsley E,et al. Initial Safety Run-In Results of the Phase 3 LOTIS-5 Trial: Novel Combination of Loncastuximab Tesirine With Rituximab (Lonca-R) Versus Immunochemotherapy in Patients With R/R DLBCL. 2022 SOHO. ABCL-320.


