原发性干燥综合征当前的治疗进展
时间:2022-01-17 13:16:40 热度:37.1℃ 作者:网络
干燥综合征(Sjögren’s syndrome,SjS)是一种以自身免疫性外分泌病为特征的常见风湿病。单独发生的SjS称为原发性干燥综合征(primary Sjögren’s syndrome,pSS),继发于另一种风湿病,则定义为继发性SjS。pSS主要发生于女性,其在一般人群中的估计患病率约为10/10000。pSS的病理标志是唾液腺和泪腺组织中存在浸润淋巴细胞。自身免疫损伤引起的腺体功能障碍可导致眼、口干燥,是pSS的主要临床特征。pSS还可累及多器官系统,并导致腺外表现,导致不同的临床表现。而且,pSS患者发生淋巴瘤的风险高于健康对照组。
pSS的治疗方案主要包括局部用药和全身治疗。然而对于包括常规缓解病情抗风湿药物(DMARD)在内的全身性药物,大多数安慰剂对照试验发现,与安慰剂相比,疾病活动度和疲乏评分相对于基线的变化无差异。迫切需要开发有效的pSS全身治疗方法。包括生物DMARD和靶向合成DMARD在内的靶向治疗在类风湿关节炎(RA)等其他风湿性疾病中取得了巨大的成功。在过去的二十年中,越来越多的临床试验评价了有关pSS的靶向治疗。
pSS的发病机制、诊断和治疗
pSS的发病机制复杂,且涉及多种因素,包括遗传因素、腺体内在缺陷、环境诱因及其他因素。先天性免疫和获得性免疫在pSS发病机制中均具有关键作用。一般遗传倾向、环境触发因素和腺体内在缺陷之间的相互作用可导致自身反应性免疫细胞的激活和外分泌腺上皮的自身免疫攻击(图1)。那些损伤的腺上皮细胞产生趋化因子和促炎性细胞因子,可通过增加向腺组织的免疫浸润而放大自身免疫反应。这些病理过程可引起外分泌腺进行性损害,外分泌腺功能受损者中可出现干燥症状。
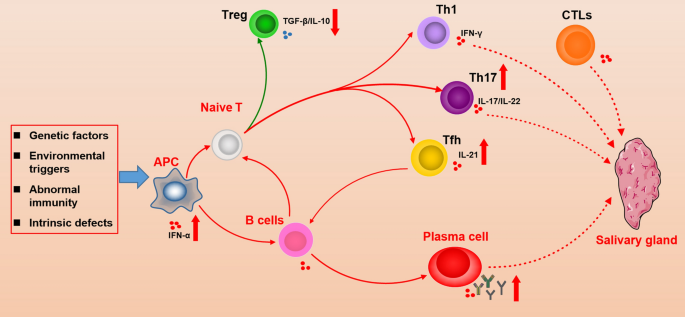
图1. pSS发生中涉及的病理过程概述
B细胞过度活化是pSS的致病标志,它促进大量自身抗体的产生。一些自身抗体可与自身抗原结合,生成免疫复合物,后者可沉积于多器官系统,引发相应组织的损伤。
B细胞在pSS发生过程中可分泌促炎性细胞因子,并将抗原递呈给T细胞。部分pSS病例的腺体组织出现三级淋巴结构(TLS)或异位生发中心(GC)样结构,可促进自身免疫,破坏腺体组织。部分pSS患者在自身免疫B细胞多克隆活化后可进一步发生淋巴瘤。因此,B细胞是参与pSS发病的关键免疫细胞,长期以来一直被视为干预的关键靶点。
除B细胞外,辅助性T细胞17(TH17)、滤泡性T辅助性T细胞(TFH)和细胞毒性T淋巴细胞(CTL)等T细胞也是pSS的重要参与者。那些T细胞可以促进B细胞的活化,直接引起外分泌腺的损伤。而且,先天性免疫的异常也参与了pSS发病。最后,腺上皮的内在缺陷也可通过多种机制促进pSS发生,包括提供慢性活化信号。这些腺体内在缺陷已被视为pSS的潜在治疗靶标。尽管如此,pSS的发病机制尚未完全明确,还需要更多的研究来揭示合适的治疗靶点。
pSS靶向治疗的当前进展
当前部分靶向治疗已经成为pSS的潜在治疗药物,包括B细胞耗竭剂、B细胞活化抑制剂和靶向共信号分子或促炎性细胞因子的药物(图1)。然而,目前pSS靶向治疗的证据仍然很少,美国食品药品监督管理局(FDA)或欧洲药品管理局(EMA)尚未批准任何生物制剂治疗pSS。
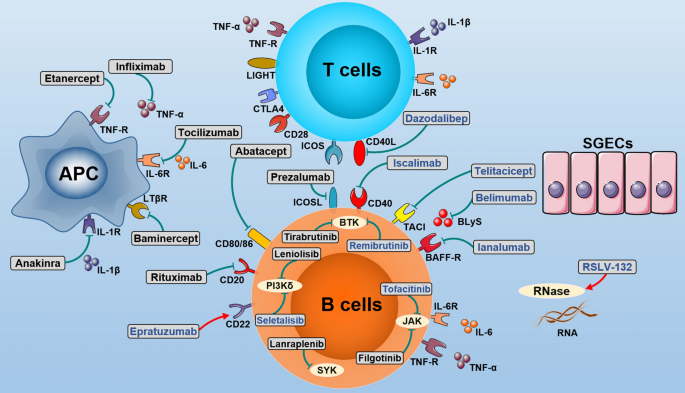
图2. pSS治疗的潜在生物制剂
B细胞靶向治疗pSS
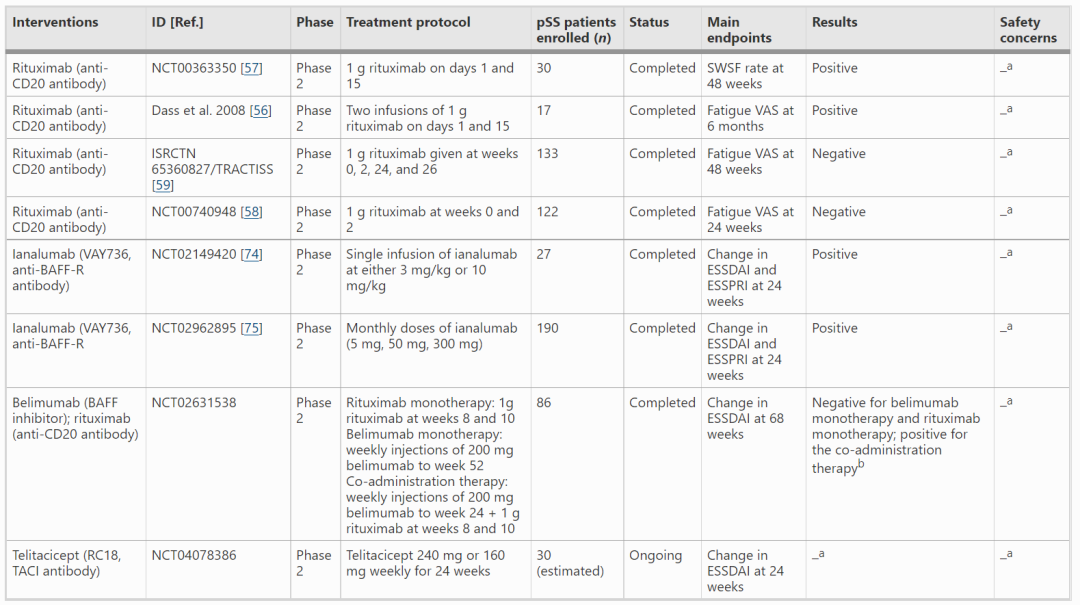
B细胞过度活化是pSS发病机制的致病标志,长期以来一直被视为pSS的治疗靶点。B细胞靶向治疗pSS主要包括B细胞耗竭剂(靶向B细胞特异性表面抗原)和B细胞活化抑制剂。通过靶向B细胞活化配体或其受体抑制B细胞活化是治疗系统性红斑狼疮(SLE)的一种较为成熟的策略。B细胞活化配体如B细胞活化因子(BAFF,也称为TNFSF13B或BLyS)和增殖诱导配体(APRIL,也称为TNFSF13)是关键治疗靶点。受体如BAFF受体(BAFF-R,又称BR3或TNFRSF13C)、跨膜激活剂和CAML相互作用因子(TACI,又称TNFRSF13B)、B细胞成熟抗原(BCMA)等也是干预的重要靶点。
表1.B细胞靶向疗法治疗pSS
靶向共刺激信号治疗pSS
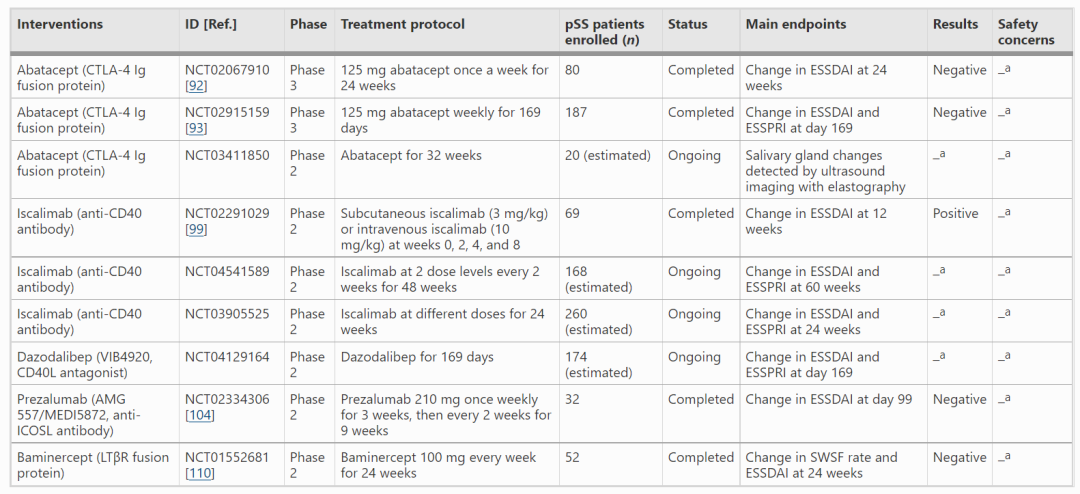
共信号分子在调节自身免疫应答中具有关键作用,是风湿性疾病的重要治疗靶点。其中,阿巴西普是一种CTLA-4 Ig融合蛋白,可与CD80/CD86结合,抑制CD28-CD80/86的共刺激相互作用,减少CD28介导的T细胞共刺激。
临床前研究表明,CD40-CD40L共刺激通路是pSS的关键因素,靶向该通路可以抑制pSS相关病理生理。Iscalimab(CFZ533)是一种阻断性但非耗竭性抗CD40单克隆抗体,可阻断CD40-CD40L通路。而ICOS-ICOSL是参与T细胞活化的关键共刺激信号通路,Prezalumab是一种抗ICOSL单克隆抗体,在治疗SLE方面具有潜在疗效。
表2.靶向同刺激因子临床试验汇总
促炎细胞因子抗体
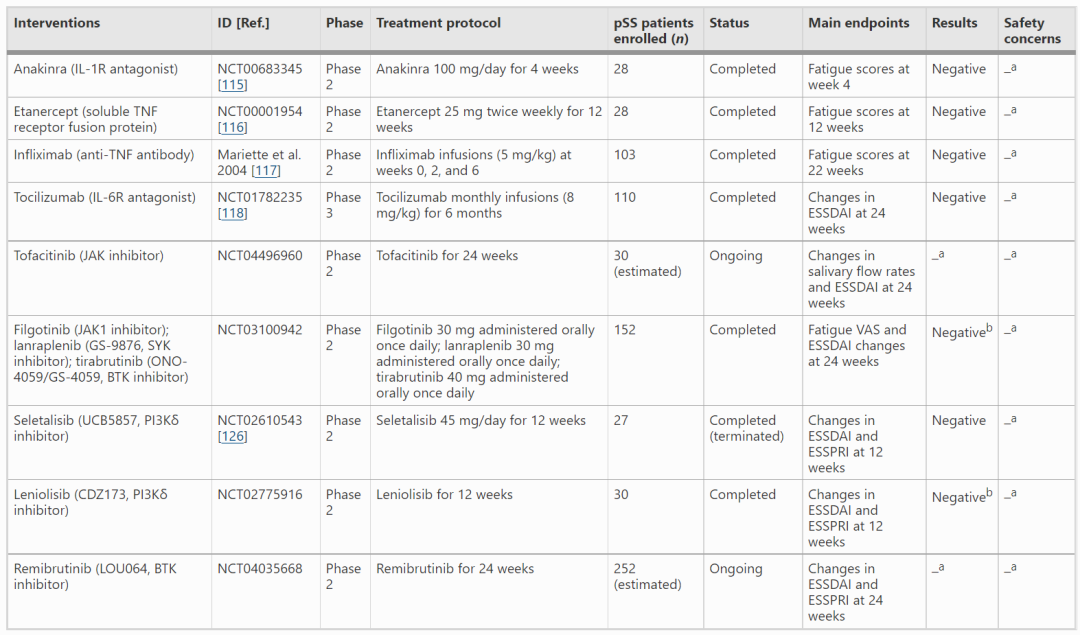
由于促炎性细胞因子如白细胞介素-6(IL-6)在B细胞活化中发挥关键作用,并参与pSS发病机制,因此针对这些细胞因子的生物制剂可能对治疗pSS具有潜在获益。然而,这些靶向促炎性细胞因子的生物制剂均不能有效治疗pSS。一项在28例pSS患者中进行的安慰剂对照试验显示,与安慰剂相比,IL-1受体(IL-1R)拮抗剂阿那白滞素抑制白细胞介素-1(IL-1)对疲劳评分较基线的变化无明显影响。近期在110例pSS患者中开展的安慰剂对照试验(NCT01782235)报告,与安慰剂相比,托珠单抗阻断白细胞介素-6受体(IL-6R)不会改善pSS患者的系统受累和症状。这些结果表明,靶向TNFα、IL-6或IL-1β的生物制剂治疗pSS无明显疗效。
过度激活的干扰素-α(IFNα)通路是pSS的关键特征。FNα可促进B细胞的活化,直接对腺体组织造成损伤,是pSS有前景的治疗靶点。
表3评估SjS中促炎性细胞因子抗体或关键信号通路小分子抑制剂临床试验汇总
靶向信号通路的小分子抑制剂
小分子抑制剂如Janus激酶(JAK)抑制剂在风湿性疾病的管理中具有新作用。JAK/STAT信号转导的过度激活参与了pSS的发病机制,表明JAK是一种可行的干预靶点。几项临床前研究表明JAK抑制剂治疗pSS的潜力,然而,一项临床试验(NCT03100942)未能证明JAK1抑制剂filgotinib治疗pSS的疗效。
磷脂酰肌醇3-激酶δ异构体(PI3Kδ)是B细胞增殖和活化的关键调节因子,其抑制剂可有效治疗淋巴瘤。在pSS患者的唾液腺中发现PI3Kδ通路过度激活,导致pSS发病。两项临床试验(NCT02610543、NCT02775916)评价了PI3Kδ抑制剂(包括seletalisib和leniolisib)治疗pSS的疗效,但均未发现有益作用。然而,一项临床试验(NCT02610543)显示,在接受seletalisib治疗的pSS患者中,ESSDAI和ESSPRI有改善趋势。
SYK是一种关键的信号传导分子,在调节BCR和Fc受体信号传导通路中具有关键作用。SYK抑制剂在治疗风湿性疾病中的作用越来越受到关注。一项未发表的安慰剂对照ii期试验(NCT03100942)评价了兰瑞匹布(GS-9876,SYK抑制剂)在pSS中的疗效,但未能确定有益作用。
用于pSS治疗的其他生物制剂
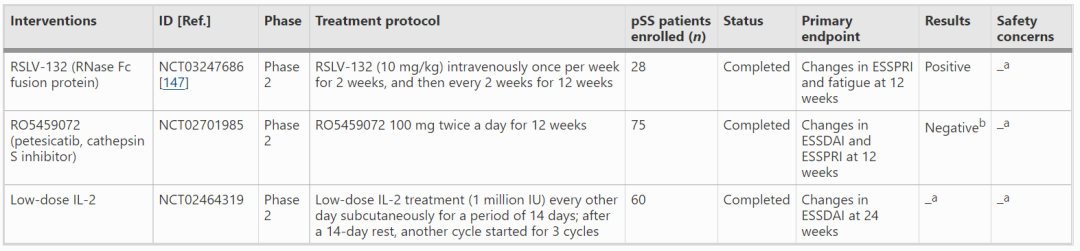
还有几种其他类型的靶向治疗正在评估中,用于pSS治疗。RSLV-132(一种RNase Fc融合蛋白)核酸酶治疗可增加RNA消化活性,减少包括RNA自身抗原在内的循环RNA。一项在28例pSS患者中进行的安慰剂对照ii期试验(NCT03247686)发现,接受RSLV-132核酸酶治疗的患者的ESSPRI评分和疲乏出现具有临床意义的改善。组织蛋白酶S活化与pSS发病机制有关。然而,在一项评估RO5459072(petesicatib,组织蛋白酶S抑制剂)对pSS疗效的未发表的安慰剂对照ii期试验(NCT02701985)中,发现petesicatib和安慰剂治疗组之间ESSDAI评分和ESSPRI评分较基线的变化无明显差异。
小编总结:目前靶向治疗pSS疗效的证据仍然很少,FDA或EMA尚未批准任何生物制剂治疗pSS。这些有前景的生物制剂治疗pSS的疗效和长期安全性特征需要在更大型的安慰剂对照试验中证实。为了揭示更合适的干预靶点,需要进一步的机制研究来揭示pSS中的关键致病因子。而且,早期诊断和以腺体功能为中心的结局指标可能有助于改善pSS系统治疗的现状,有必要对这些方面进行更多的研究。
参考文献:
Wang, B., Chen, S., Li, Y. et al. Targeted Therapy for Primary Sjögren’s Syndrome: Where are We Now?. BioDrugs (2021). https://doi.org/10.1007/s40259-021-00505-7

