Nature:全新致癌机制,相分离驱动异常染色质成环,促进癌症发展
时间:2021-06-28 19:01:45 热度:37.1℃ 作者:网络
癌症的发展与靶向蛋白质内在无序区域(IDR)的基因异常密切相关。各种蛋白质(包括转录因子、染色质调节剂和RNA结合蛋白)中的IDR通过液-液相分离(LLPS)形成凝聚物,影响从细胞器形成和刺激耐受到基因转录的无数生物过程。
所谓的液-液相分离(LLPS)是指融合两个不相关基因突变的过程。该过程发生在细胞核内,并能够形成具有各种物理特性的域,这些域可以促进癌症,例如急性白血病的发生发展。在急性白血病中,核孔蛋白(NUP98或NUP214)的反复染色体易位产生了一种异常融合体,它总是保留核孔蛋白 IDR——苯丙氨酸和甘氨酸残基(FG)的串联分散重复序列。然而,IDR如何导致基因错误调控和肿瘤发生尚不清楚。
2021年6月23日,北卡罗莱纳大学教堂山分校 Gang Greg Wang 团队等 Nature 发表了题为:Phase separation drives aberrant chromatin looping and cancer development 的研究论文。
该研究证明了相分离是癌症形成的驱动因素,癌症通过相分离获得突变以建立致癌转录因子凝聚物,这同时增强了它们的基因组靶向性并在肿瘤转化过程中诱导异常三维染色质结构的形成。该研究是最早将相分离与癌症形成联系起来的研究之一。因为在其他恶性肿瘤中观察到了类似的基因融合,文章中阐明的机制也可以解释其他类型的癌症。
NUP98–HOXA9包含两个蛋白质基序和一个结合序列。为了研究NUP98-IDR在白血病发生中的作用,研究团队主要使用敲除了结合序列的NUP98-HOXA9(N-IDRWT/A9)。
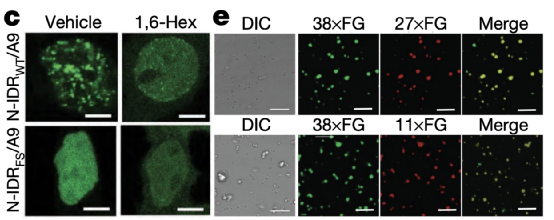
他们发现,N-IDRWT/A9对1,6-己二醇(一种用于破坏相-相分离凝聚体的化学物质)处理敏感。纯化的NUP98-IDR(N-IDR)蛋白在体外形成液体凝聚物。
为了进一步评估FG重复序列对凝聚物形成的浓度依赖性和多价性的重要性,研究团队制备了含有不同数量FG重复序列的重组N-IDR蛋白质。他们发现N-IDR包含38个或36个FG以浓度依赖性的方式重复形成的液滴,那些包含27个或11个FG的却不能进行相分离。表明NUP98–HOXA9中的IDR以价依赖和浓度依赖的方式建立LLPS。
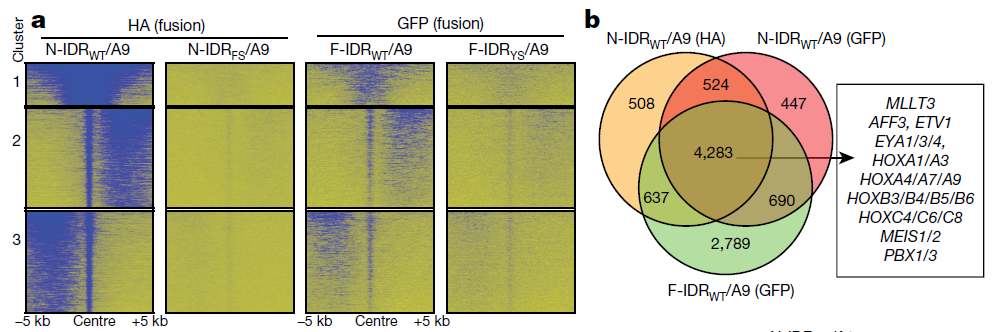
NUP98–HOXA9通过同源结构域与DNA结合,导致白血病发生过程中的基因失调。接下来,研究团队通过染色质免疫沉淀和高通量测序来评估IDR介导的相分离对NUP98–HOXA9染色质靶向性的影响。
结果显示, N-IDRWT/A9具有显着增强的基因组占有率,而与无监督聚类定义的峰值亚类无关。此外,宽而密集的超增强子样峰是N-IDRWT/A9所独有的,并且在发育期和白血病相关基因富集。
为了进一步评估IDR诱导的LLPS在嵌合体染色质靶向中的作用,他们利用了遗传学和药理学的方法,证明了IDR介导的LLPS在增强嵌合转录因子靶向性方面的因果作用,特别是在超增强子样峰处看到的那些。表明IDR增强融合体的基因组结合并且增强靶基因激活。
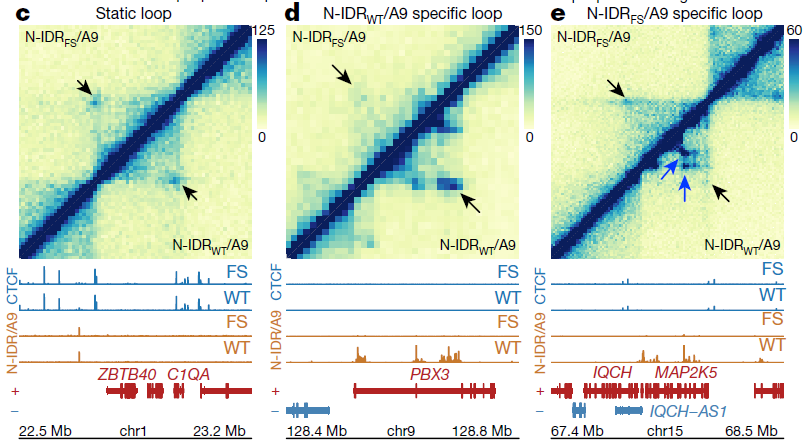
为了测试NUP98–HOXA9通过LLPS形成染色质循环的能力,研究团队生成了表达N-IDRWT/A9或N-IDRFS/A9细胞的Hi-C图谱,揭示了DNA循环和复制之间的高度相关性。
为了确定N-IDRWT/A9对Hi-C接触频率的影响,他们聚集了N-IDRWT/A9-和N-IDRFS/A9表达细胞中500个最强烈的N-IDRWT/A9占据位点之间的相互作用计数。结果显示,N-IDRWT/A9循环以基本上与CTCF无关的方式形成,与相分离驱动机制一致。另外,N-IDRWT/A9特异性循环重新连接增强子和靶基因之间的连接,支持了融合转录因子的IDR通过相分离在超增强子样靶点和癌基因之间诱导DNA循环的观点。
综上所述,该研究发现NUP98–HOXA9中含有的LLPS活性IDR对白血病的发生和致癌基因表达程序的激活至关重要。这些效应由IDR的能力介导:1)增强转录因子与基因组靶点的结合;2)促进增强子和癌基因启动子之间的长距离循环。
该研究提供了一个致癌突变的原理性证据,该突变在肿瘤转化过程中促进LLPS驱动的转录因子结合和3D染色质重组。由于含IDR的LLPS活性分子与广泛的癌症有关,该研究阐明的机制也可以解释其他类型的癌症。
原始出处:
Ahn, J.H., Davis, E.S., Daugird, T.A. et al. Phase separation drives aberrant chromatin looping and cancer development. Nature (2021). https://doi.org/10.1038/s41586-021-03662-5.


