Ann Oncol:帕博利珠单抗(pembrolizumab)联合培美曲塞+铂类治疗转移性非鳞状非小细胞肺癌患者的疗效和安全性:KEYNOTE-189
时间:2021-06-15 14:02:22 热度:37.1℃ 作者:网络
KEYNOTE-189 (NCT02578680)是一项在16个国家126个癌症中心进行的双盲,随机,安慰剂对照III期临床研究。评估帕博利珠单抗(pembrolizumab)联合培美曲塞+铂类对比安慰剂联合培美曲塞+铂类一线治疗转移性非鳞状非小细胞肺癌患者的疗效和安全性。纳入患者符合18岁或以上,经组织学或细胞学确诊的转移性非鳞状非小细胞肺癌,没有EGFR或ALK突变,可测量病灶,ECOG评分为0或1。患者被随机分配(2:1)接受静脉注射帕博利珠单抗(200mg)或安慰剂,每3周一次,为期2年(35个周期); 所有患者接受化疗,方案为静脉注射培美曲塞(500 mg/m²)联合卡铂(5 mg/mL / min)或顺铂(75 mg/m²),每3周一次,共4个周期,随后每3周进行培美曲塞维持治疗。前期分析证实帕博利珠单抗(pembrolizumab)可改善患者的PFS和OS。近期,Annals of Oncology杂志上发表了更新结果,包括安慰剂组患者进展后交叉到帕博利珠单抗治疗,以及完成35周期帕博利珠单抗治疗的患者的疗效。

经过中位随访时间31个月,帕博利珠单抗组较安慰剂组明显改善患者的OS [22个月 vs 10.6个月,HR=0.56; 95% CI, 0.46-0.69]。24个月的OS率分别为45.7%和27.3%。不管PD-L1的表达水平,帕博利珠单抗都能让患者的OS获益。亚组分析发现所有的亚组均可从帕博利珠单抗中取得OS获益。
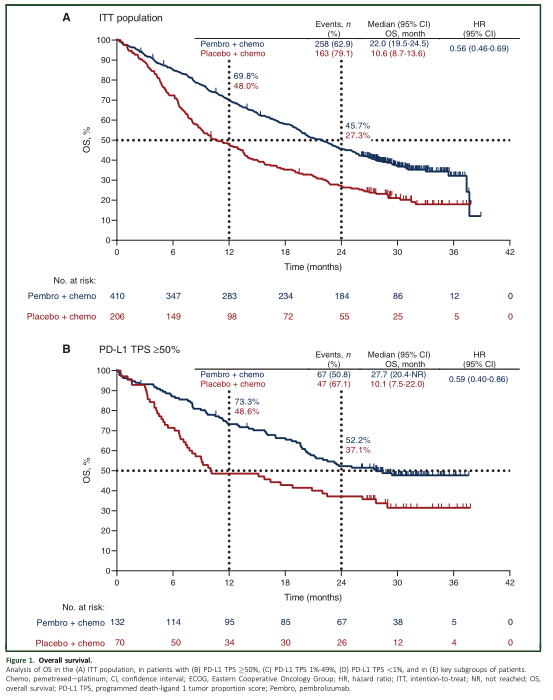
OS
同样,帕博利珠单抗组较安慰剂组明显改善患者的PFS(9.0个月 vs 4.9个月,HR=0.49; 95% CI, 0.41-0.59)。24个月的PFS率分别为22.0%和3.4%。不管PD-L1的表达水平,帕博利珠单抗都能让患者的PFS获益。亚组分析发现所有的亚组均可从帕博利珠单抗中取得PFS获益。
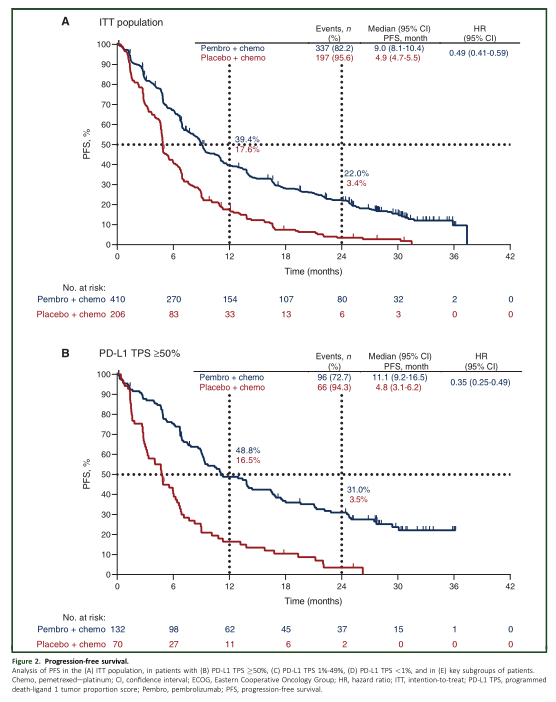
PFS
两组的客观缓解率(ORR) 分别为48.3%和19.9%,不管PD-L1水平,帕博利珠单抗组的ORR均能获益。两组的中位持续缓解时间(DOR)分别为12.5个月和7.1个月,24个月仍有应答患者比例分别为28.4%和9.9%。
PFS2定义为二线治疗开始至进展或任何原因死亡的时间。两组的PFS2分别为17.0 (15.1-19.1) 和9.0(7.4-10.4)个月(HR, 0.50; 95% CI, 0.41-0.61);24个月的PFS2率分别为38.2%和16.2%。
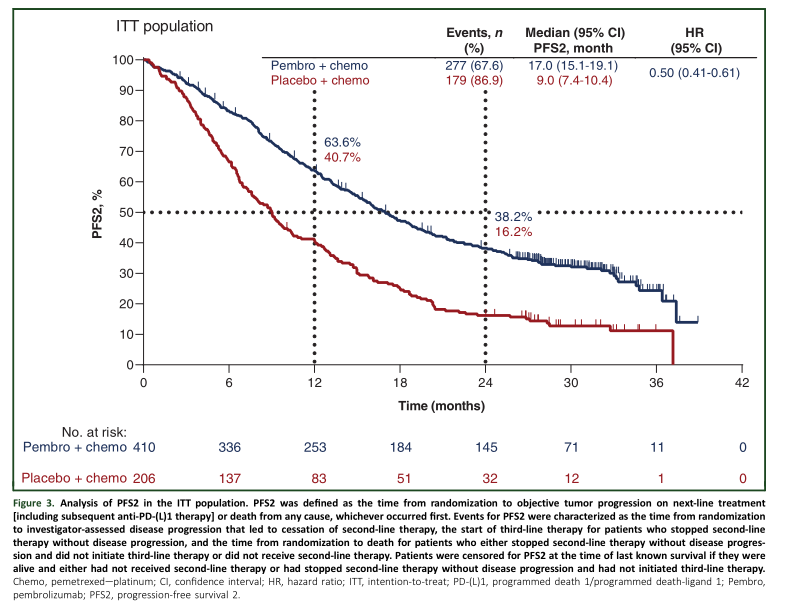
PFS2
安慰剂组中的84例患者(40.8%)进展后交叉到帕博利珠单抗治疗。从接受帕博利珠单抗治疗开始,中位OS为6.9 (4.8-10.5)个月,24个月OS率为20.7%。中位PFS为2.8个月(2.5-2.9);24个月的PFS率为12.1%。ORR为17.9%,中位DOR为21.9个月(3.9 to 25.9); 12个月仍有应答率为60.0%。
两组治疗相关不良事件发生率分别为92.8%和90.6%。3-5级不良事件发生率分别为72.1%和66.8%。没有新的不良事件发生。
56例患者完成35周期(2 years) 帕博利珠单抗治疗,其中的ORR为85.7%,中位DOR为34.5个月。数据截止时,53例(94.6%)患者仍然存活 (PD-L1 TPS >50%, n = 30; PD-L1 TPS 1%-49%, n = 15; PD-L1 <1%, n= 6; 和PD-L1不可评估,n =2),3例患者(5.4%)死亡。3-4级不良事件发生率为60.7%); 常见为中性粒细胞减少(17.9%), 贫血 (12.5%), 和乏力 (7.1%)。免疫相关不良事件发生率为37.5%; 6 例患者(10.7%) 出现3-4级免疫相关不良事件。没有致死性免疫相关不良事件发生。
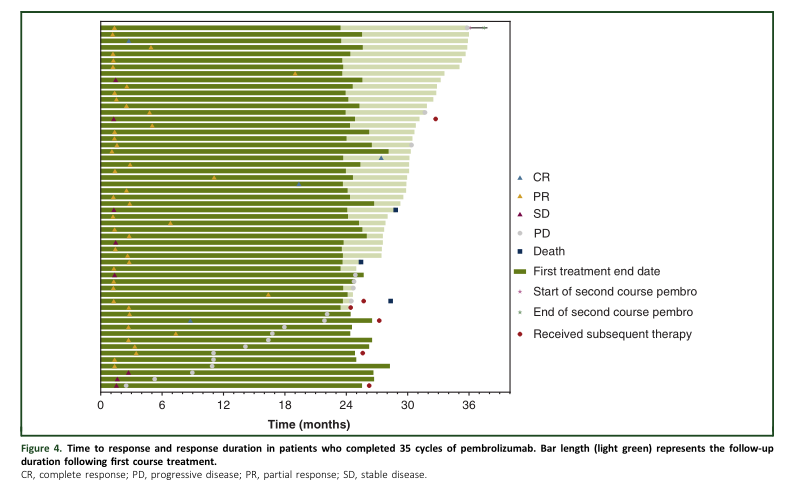
完成35周期患者的生存获益
综上,帕博利珠单抗(pembrolizumab)联合培美曲塞+铂类一线治疗可改善转移性非鳞状非小细胞肺癌的预后,并且毒性可控可耐受。
原始出处:
D Rodríguez-Abreu, S F Powell, M J Hochmair, et al. Pemetrexed plus platinum with or without pembrolizumab in patients with previously untreated metastatic nonsquamous NSCLC: protocol-specified final analysis from KEYNOTE-189. Ann Oncol. 2021 Jul;32(7):881-895. doi: 10.1016/j.annonc.2021.04.008.


