研发:中国GMP、GSP认证管理办法废止,沃森生物新冠腺病毒疫苗获批临床
时间:2021-05-31 08:02:07 热度:37.1℃ 作者:网络
中国GMP、GSP认证管理办法废止。5月28日,国家药监局发布《药品检查管理办法(试行)》的通知,该办法自发布之日起施行。与此同时,原国家食品药品监督管理局2003年4月24日发布的《药品经营质量管理规范认证管理办法》和2011年8月2日发布的《药品生产质量管理规范认证管理办法》同时废止。根据新版药品检查管理办法,药品生产许可、药品经营许可由认证改为申请。
国内药讯
1.沃森生物新冠腺病毒疫苗获批临床。沃森生物联合清华大学、天津医科大学共同合作申请的重组新冠疫苗(黑猩猩腺病毒载体)获批临床。目前全球已有5个基于腺病毒载体技术路线的新冠疫苗获批紧急使用许可或附条件上市许可,国内康希诺的腺病毒疫苗已获批。除腺病毒疫苗外,沃森还有一款新冠 mRNA 疫苗在研,该疫苗目前正在墨西哥启动III期试验。
2.齐鲁抗癌多肽国内报IND。齐鲁制药多肽新药注射用CEND-1的临床试验申请获CDE受理。CEND-1(iRGD)是Cend Therapeutics公司开发的一款潜在“first-in-class”抗癌疗法,拟被开发用于胰腺癌、三阴性乳腺癌等的治疗。公布在ESMO2020大会上的一项Ⅰ期临床数据显示,CEND-1与吉西他滨和白蛋白紫杉醇的三联疗法,在治疗转移性胰腺癌患者时达到59%的总缓解率,以及83%的疾病控制率。齐鲁制药拥有该候选药在大中华区的独家权益。
3.基石治疗NSCLC单抗Ⅲ期注册临床积极。基石药业PD-L1单抗舒格利单抗治疗III期非小细胞肺癌(NSCLC)的注册性Ⅲ期临床GEMSTONE-301达主要终点。该试验评估舒格利单抗作为巩固治疗在同步或序贯放化疗后未发生疾病进展的、局部晚期/不可切除的III期非小细胞肺癌患者中的疗效。经iDMC评估,舒格利单抗显著改善PFS,具统计学意义;临床中未发现新的安全性信号;无论同步还是序贯放化疗后的患者均显示出临床获益。预计近期即将向NMPA提交新药上市申请(NDA)。
4.林普利司片再获FDA孤儿药资格。FDA授予璎黎药业PI3Kδ抑制剂林普利司片(YY-20394)一项新的孤儿药资格,用于T细胞淋巴瘤患者的治疗。此前,该新药已在美国获得用于治疗滤泡性淋巴瘤和慢性淋巴细胞白血病/小细胞淋巴瘤(CLL/SLL)的两项孤儿药资格。在中国,林普利司的上市申请于近日刚被纳入拟优先审评,用于治疗既往接受过二线或二线以上系统治疗的复发或难治滤泡性淋巴瘤患者。
5.泰诺麦博RSV单抗报IND。珠海泰诺麦博公司TNM001注射液的临床试验申请获CDE受理。TNM001为一款全人源呼吸道合胞病毒(RSV)单抗药物,主要用于治疗由RSV引起的幼龄儿童细支气管炎与肺炎等呼吸道感染。据悉,泰诺麦博已于2021年4月完成A轮融资,主要用于TNM001、破伤风毒素单抗TNM002与神经生长因子单抗TNM009的临床研究。
6.扬子江引入两款创新生物药。扬子江药业与迈威生物达成合作许可协议,将获得迈威生物拟用于白细胞减少症及白细胞低下症的注射用重组(酵母分泌型)人血清白蛋白-人粒细胞集落刺激因子融合蛋白8MW0511在合作区域内的独家生产及商业化权益,以及PD-1单抗注射液9MW1111在合作区域内的独家开发、生产及商业化权益。针对9MW1111,扬子江还将获得与任意其他一种或多种药物联合用药的独家开发权益,迈威生物将保留开发双抗、多抗等其他形式药物的所有权益。
国际药讯
1.安进KRAS抑制剂获FDA加速批准。FDA加速批准安进开发的Lumakras(sotorasib)上市,用于治疗经治KRAS G12C突变的非小细胞肺癌(NSCLC)患者。值得一提的是,Lumakras也是首款获批上市的KRAS靶向抗癌疗法,KRAS突变是最常见的致癌基因突变之一,也是著名的“不可成药”靶点。在中国,安进和百济神州共同申报的sotorasib也已获CDE拟纳入突破性治疗品种。
2.Zeposia治疗溃疡性结肠炎获FDA批准。FDA批准百时美施贵宝(BMS)公司抗炎药Zeposia(ozanimod)新适应症,用于治疗成人中重度活动性溃疡性结肠炎(UC)。这也是获批用于这类患者的首个口服S1P调节剂。在一项关键性Ⅲ期True North试验中,与安慰剂相比,Zeposia在诱导治疗期第10周(18.4%比6.0%;p<0.0001)和维持治疗期第52周时(37.0%比18.5%;p<0.0001)显著提高患者的缓解率;而且也达到包括临床应答、内镜改善、等多项关键性次要终点。
3.teplizumab治疗糖尿病获FDA咨询委员会支持。Provention Bio创新CD3单抗teplizumab获FDA内分泌和代谢药物咨询委员会推荐批准,用于高危人群预防或延缓发生临床1型糖尿病。在支持该药NDA的临床试验中,2周疗程teplizumab治疗可将1型糖尿病的发病时间平均推迟2年。这种延迟可能帮助患者避免糖尿病酮症酸中毒。FDA预计将在7月2日前就该新药做出最终审查决定。
4.创新CD25靶向ADC新药早期临床积极。ADC Therapeutics新型CD25靶向抗体偶联药物(ADC)camidanlumab tesirine(Cami)治疗复发/难治性霍奇金和非霍奇金淋巴瘤患者的Ⅰ期临床积极结果发表在The Lancet Haematology上。Cami总患者群的ORR为58%,有29%(n=130)的患者达到完全缓解(CR);其中在接受45 μg/kg(推荐的Ⅱ期试验起始剂量)的霍奇金淋巴瘤患者中,ORR为86%,有18/37的患者达到CR;在非霍奇金淋巴瘤患者中,ORR为38%,有5/53的患者达到CR。此外,Cami具有可接受的安全性。
5.新冠无症状患者亦具病毒传播力。发表于学术期刊《科学》的一篇最新研究指出,与病情严重到需要住院的患者相比,那些尚未出现症状、无症状、症状轻微的新冠患者可具有同水平的病毒传播能力。这个研究让我们对新冠病毒的传播力有了新的认知,且表明这些症状不明显、看似健康的个体可能是触发社区疫情爆发的关键。研究指出社交隔离和口罩等手段对于防疫仍是关键措施。
6.lifileucel的BLA再遭FDA延迟。Iovance公司披露其收到FDA要求提供肿瘤浸润淋巴细胞(TIL)疗法lifileucel药效分析额外数据,以确保每一批TIL产品符合标准。据悉,这已不是Iovance的BLA申请首次遭遇挫折,lifileucel项目原计划在2020年底提交上市申请,然而去年10月召开的会议上,Iovance未能就lifileucel治疗转移性黑色素瘤所需的效力分析与FDA达成一致,受此影响,lifileucel的上市申请计划从2020年底推迟至2021年。
医药热点
1.中国发布新冠疫苗接种不良反应监测情况。2020年12月15日至2021年4月30日,中国报告接种新冠疫苗2.65亿剂次,报告预防接种不良反应31434例,报告发生率为11.86/10万剂次。在不良反应中,一般反应占不良反应总数的82.96%,报告发生率为9.84/10万剂次。异常反应占不良反应总数的17.04%,报告发生率为2.02/10万剂次;其中报告前三位的反应分别为过敏性皮疹、血管性水肿、急性严重过敏反应;在异常反应中,严重病例188例,报告发生率为0.07/10万剂次。
2.德国拟允许年满12岁的未成年人接种新冠疫苗。德国总理默克尔27日与各州州长协商后宣布,德国联邦政府与各州达成决议,将从6月7日起允许年满12岁的未成年人预约接种新冠疫苗。目前欧洲药品管理局尚未批准新冠疫苗用于未成年人,但德国政府当天表示,预计该机构即将正式批准辉瑞-Biontech疫苗用于该年龄段的未成年人。
3.应急救护培训加速进校园。中国红十字会总会、教育部日前印发通知,要求各地教育部门和红十字会要加强组织领导和工作协同,联合开展“救在身边·校园守护”行动。提出到2030年中小学教职员工接受救护员公益培训的师生比例原则上不少于1∶50;推进校医、体育教师、班主任等重点教职员工培训取证;推动学校配备急救箱、自动体外除颤仪、应急救护一体机等急救设备。
审评动向
1. CDE新药受理情况(05月28日)
申请临床:
上海恒瑞的注射用HR18034、四川思路康瑞/江苏康宁杰瑞的恩沃利单抗注射液、上海凌济的RG001片(2个规格)、苏州微超生物的冻干ACYW135群脑膜炎球菌结合疫苗、诺华的ABL001片(2个规格)、杭州中美华东的IMGN853。
申请生产:
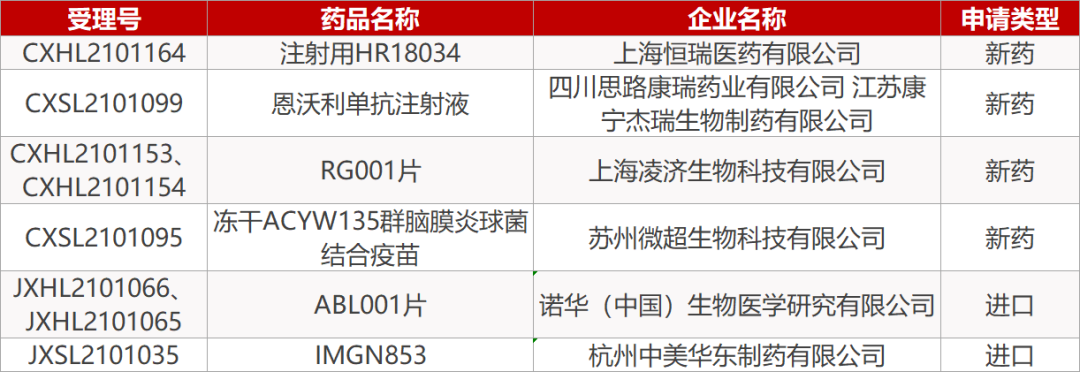
2. FDA新药获批情况(北美05月28日)