Hepatology:首都医科大学尤红等团队开发肝纤维化新型的分类方法,可为精确的肝纤维化分级和临床治疗提供帮助
时间:2023-04-30 12:21:39 热度:37.1℃ 作者:网络
细胞外基质(ECM)的过度沉积和交联增加了肝脏的密度和硬度,促进了纤维的发生,并增加了对纤维溶解的抵抗力。肝纤维化的一个新兴治疗机会是靶向ECM的组成或阻断与周围细胞的致病性通讯。然而,引发肝纤维化的细胞外改变的类型和程度取决于潜在的病因。该研究的目的是揭示与肝纤维化临床相关的不依赖于病因的基质基因。
2023年4月27日,首都医科大学尤红和伊利诺伊大学Natalia Nieto合作在Hepatology在线发表了题为“Matrisome gene-based subclassification of patients with liver fibrosis identifies clinical and molecular heterogeneities”的研究论文,该研究使用来自不同病因的肝纤维化病例的转录组谱来鉴定和验证肝纤维化特异性基质基因(LFMG)及其临床和生物学相关性。通过大量和单细胞RNA测序(scRNA-seq)进一步探索肝纤维化进展和消退小鼠模型中LFMG的失调模式和细胞景观。
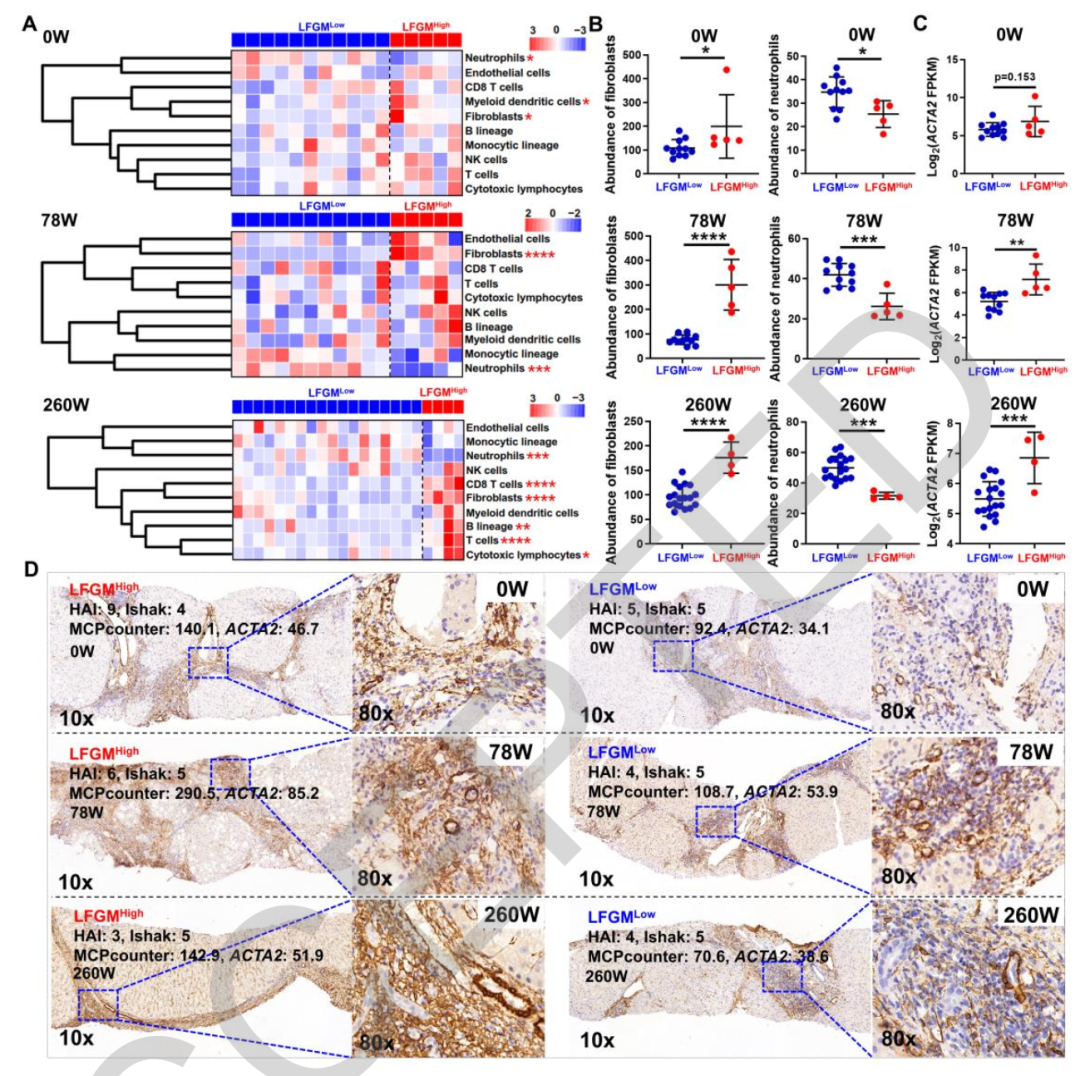
该研究确定了35个独立于病因的LFMG,代表了定义肝纤维化的LFMG特征。LFMG信号的表达取决于组织学严重程度,在退行性肝脏中降低。肝纤维化患者即使病理评分相同,也可细分为LFMG Low和LFMG High,他们在临床、细胞和分子特征可区分。scRNA-seq显示,微纤维相关蛋白4 + (MFAP4 +)激活的肝星状细胞(aHSCs)在LFMG High患者中增加,并且是LFMG特征表达和失调的主要原因。总之,该研究为肝纤维化患者提供了一种分类方法:MFAP4 + ahsc衍生的LFMG特征对具有不同临床和生物学特征的肝纤维化患者进行分类。该研究发现揭示了肝脏活检中隐藏的信息,这些信息是传统组织学评估无法检测到的。

肝纤维化是一种持续的伤口愈合反应,其能引起细胞外基质(ECM)的过度沉积,并导致肝硬化和肝细胞癌(HCC)。肝纤维化的常见原因包括代谢紊乱、慢性病毒感染、酗酒和自身免疫性疾病。最近的研究支持肝纤维化,甚至终末期肝硬化,在抑制或消除基础疾病后是可逆的。然而,消除致病因素并不总是足以改善纤维化。例如,约47%成功抑制乙型肝炎病毒(HBV)的患者没有出现明显的纤维化逆转,只有约45%的非酒精性脂肪性肝炎(NASH)患者在改变生活方式和减轻体重后出现明显的纤维化溶解。此外,在去除病因因素后,自发纤维化逆转往往太慢,无法预防危及生命的并发症,如失代偿性肝硬化或HCC。因此,迫切需要有效的治疗药物,专门针对肝纤维化,独立于致病因素。
尽管有药理学方法可以重新激活肝星状细胞(aHSCs)和其他促纤维化效应细胞,但迄今为止临床突破有限。另外,目前的研究方向是增强ECM降解或延缓沉积以逆转或延缓纤维化。ECM的现有定义包括纤维蛋白(胶原蛋白、糖蛋白、蛋白聚糖)、ECM附属蛋白、ECM调节因子和潜伏在ECM中的分泌因子。这些蛋白质统称为“母体”。在肝纤维化过程中,ECM重塑发生在基质组分、共价分子内和分子间交联中,并通过改变ECM的机械和化学微环境。某些ECM蛋白(如弹性蛋白)的聚集和稳定增强了纤维化肝脏的密度和硬度,从而抵抗纤维化并改变肝脏稳态。此外,僵硬的ECM信号通过机械力通过ECM受体,主要是整合素,招募和激活促纤维化效应细胞。直接干预ECM或阻断ECM及其周围细胞之间的通信,为肝纤维化创造了治疗机会。
肝基质在急性和慢性损伤的反应中动态变化,甚至在组织学ECM积累之前。各种刺激,如病毒侵入(主要是HBV和丙型肝炎病毒[HCV])和酒精滥用,导致患者的移行性ECM重塑,这不会明显改变肝脏结构,但会导致损伤、炎症和纤维化。因此,鉴定不受病因影响的基质蛋白,建立纤维化ECM基因/蛋白特征,并开发纤维化特异性靶点至关重要。虽然去细胞化提高了检测基质蛋白的效率,但它仍然在基质中留下了痕量的细胞质和可溶性蛋白,限制了纤维化ECM景观的完整视图。此外,用单克隆抗体直接靶向ECM蛋白没有显示出益处,可能是因为坚硬的基质充当了限制药物传递的伪屏障。相反,以基质基因为目标的干预创造了一个机会,最终将肝纤维化中的ECM重塑到其生理状态。
BJFSH队列中LFMG Low和LFMG High患者治疗前后的肝功能比较(图源自Hepatology )
众所周知,肿瘤的分子畸变极大地限制了HCC的治疗和预后。然而,肝内分子失调是否会挑战非恶性肝纤维化仍然未知。该研究团队最近的研究发现了与HBV相关的HCC相关的基质基因,这些基因可以区分不同临床预后、代谢活性、细胞周期激活、免疫浸润和肿瘤纯度的患者。在这里,该研究试图确定在肝纤维化过程中特异性失调的基质基因,无论病因如何,对具有不同临床相关性和生物学特征的患者进行亚分类。该研究系统地综合分析了本中心肝纤维化患者抗病毒治疗前后的转录组学数据和公开数据集。通过大量RNA测序(RNA-seq)和单细胞RNA测序(scRNA-seq)进一步验证了纤维化或退行性肝脏中基质基因的失调模式、细胞景观和生物学功能。
该研究通过对BJFSH队列和公开可用的转录组谱的综合分析,确定了一个强大的肝纤维化特异性基质基因(LFMG)特征,无论病因如何,它都是纤维化特异性的。这种特征可以在遗传和分子水平上精确地评估肝纤维化的细微变化,这对于评估现有分期系统评估不足的退行性纤维化尤其重要。LFMG特征可以将肝纤维化患者分为不同的亚组。基于MFAP4 + aHSC LFMG信号,治疗前或治疗后肝纤维化,甚至具有相同组织学纤维化分期的患者可细分为LFMGLow和LFMGHigh。LFMGLow和LFMGHigh患者具有不同的病理特征、肝脏僵硬度以及肝内分子和细胞异质性。
尽管LFMGHigh患者的临床、细胞和分子特征预示着较差的预后,但LFMG特征亚分类与肝纤维化消退或肝脏相关不良事件的直接关系仍然未知,这是目前该研究的局限性,需要更多的患者入组和更长时间的随访。此外,尽管LFMG特征亚分类在预测肝纤维化病因治疗后的临床预后方面具有潜力,但由于LFMG特征与肝硬度密切相关,其预测价值仍需要在进一步的研究中直接与组织学和无创肝硬度进行深入比较。重要的是,该研究发现MFAP4+ aHSCs是LFMG特征的主要细胞来源,也是LFMGLow和LFMGHigh患者差异的主要细胞来源。MFAP4本身以及MFAP4+ aHSCs在肝纤维化中的作用值得进一步研究
总之,该研究的发现揭示了肝脏活检中隐藏的信息,这些信息是传统组织学评估无法检测到的。这为精确的肝纤维化分级和肝纤维化的分子基础提供了额外的见解,以确定临床模式和开发治疗机会。
原文链接:
https://journals.lww.com/hep/Abstract/9900/Matrisome_gene_based_subclassification_of_patients.407.aspx


