Cancer Cell:揭开CD11b激动剂发挥抗肿瘤免疫反应的机制
时间:2023-05-30 13:39:21 热度:37.1℃ 作者:网络
胰腺癌(Pancreatic Cancer),是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤,其中胰腺导管腺癌(PDAC)占全部胰腺癌的95%以上。
近年来,胰腺癌发病率和死亡率明显上升,胰腺癌早期的确诊率不高,发现时往往已是晚期,此时癌细胞已经扩散,一些化疗药物虽然有效,但通常会产生耐药性,癌症免疫疗法也难以发挥作用。胰腺癌的5年生存率不足7%,是预后最差的恶性肿瘤,因此也被称为“癌中之王”。
大量肿瘤相关巨噬细胞(TAM)的存在与许多癌症类型的不良临床结果相关。尽管如此,TAM具有相当大的可塑性,在治疗过程中可以发挥促肿瘤和抗肿瘤这两种截然相反的作用。在一些实体肿瘤中,例如胰腺导管腺癌(PDAC),致密的结缔组织增生和纤维化间质可以驱动TAM的免疫抑制和损伤修复程序。因此,将TAM重编程为抗肿瘤表型是这类癌症的一个有吸引力的治疗策略。
2023年5月25日,圣路易斯华盛顿大学的研究人员在 Cell 子刊 Cancer Cell 上发表了题为:Context-dependent activation of STING-interferon signaling by CD11b agonists enhances anti-tumor immunity 的研究论文。
该研究揭示了CD11b激动剂治疗胰腺癌的机制——CD11b激动剂通过激活STNG-干扰素信号,增强抗肿瘤免疫,还能与放疗或化疗联合,产生更强的抗肿瘤免疫反应。

抗癌性巨噬细胞的特点是高表达肿瘤坏死因子α(TNF-α)、IL-12a、诱导型一氧化氮合酶或MHC分子,以及趋化因子(例如CXCL9、CXCL10),而致癌性巨噬细胞则高表达IL-10、IL-1诱饵受体、IL-1Rα、精氨酸酶-1,以及CD163、CD204或CD206。
在人类胰腺导管腺癌(PDAC)中,肿瘤相关巨噬细胞(TAM)在许多患者的肿瘤组织中含量丰富。在临床前动物模型中,阻断关键趋化因子受体(例如CCR2或CXCR1/2)或通过抑制集落刺激因子-1受体(CSF1R)来减少TAM,可以减缓PDAC的进展并改善其对多种药物的反应。然而,迄今为止,这些方法尚未在实体瘤中取得显著的临床疗效。
这可能是因为这些髓细胞消融策略受到非靶向髓细胞亚群的显著代偿作用,最终可能限制其在人类中的治疗效果。因此,研究人员将重点放在了通过重编程TAM以支持抗肿瘤免疫治疗。
之前的研究显示,CD11b是一个肿瘤免疫治疗的新靶点。在PDAC和其他癌症小鼠模型中,CD11b的小分子激动剂可适度减少肿瘤浸润性免疫抑制骨髓细胞(例如TAM、单核细胞和粒细胞)的数量,并与T细胞介导的肿瘤控制增加相对应。这些实验数据将CD11b激动剂推进到了实体瘤的早期临床试验中。
在这项最新研究中,研究团队探索了CD11b激动剂诱导抗肿瘤免疫的细胞和分子机制,并确定了联合治疗的方向。
该研究发现,CD11b激动剂通过同时抑制NF-κB信号和激活干扰素基因表达来改变肿瘤相关巨噬细胞(TAM)表型。NF-κB信号的抑制直接涉及p65蛋白的降解,相比之下,CD11b激动作用通过FAK介导的线粒体功能障碍诱导STING/STAT1通路介导的干扰素基因表达,其诱导程度取决于肿瘤微环境,并通过细胞毒性治疗放大。
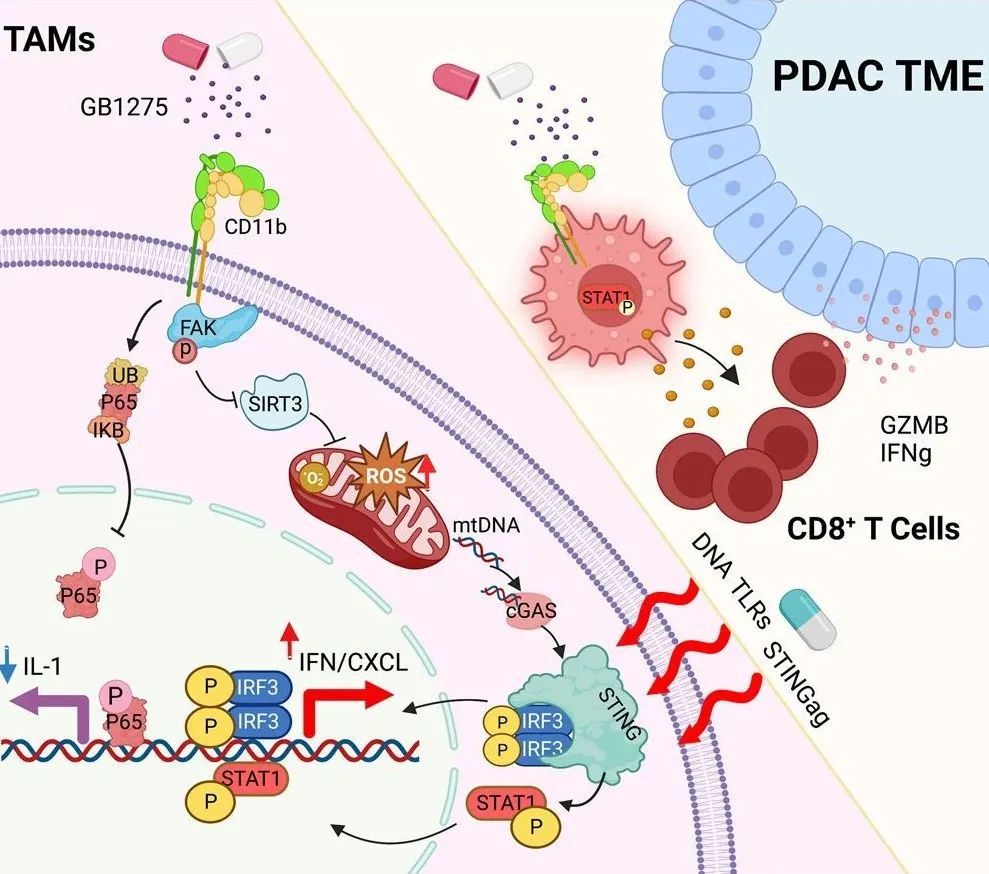
使用1期临床研究的人体组织,研究团队证明了GB1275(口服小分子CD11b激动剂)治疗可以激活人类肿瘤TAM中的STING和STAT1信号。此外,化疗或放疗联合GB1275,可以放大STING/IFN信号,产生更强的免疫治疗效果。
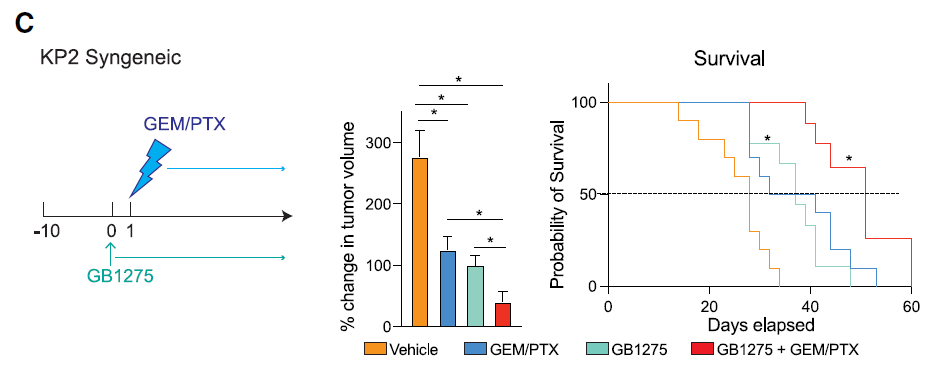
这些发现提示了CD11b激动剂在胰腺癌治疗中的潜在作用机制,并确定了更有可能受益的癌症患者群体。
论文链接:
https://doi.org/10.1016/j.ccell.2023.04.018


