新里程碑?生存期翻高近9倍!JAMA子刊:免疫+靶向“组合拳”,为甲状腺癌患者带来显著获益
时间:2024-11-06 21:00:37 热度:37.1℃ 作者:网络
甲状腺未分化癌(ATC),也称“甲状腺间变癌”,是甲状腺癌中少见但恶性程度非常高、预后非常差的病理类型,多数患者发现即为IV期。根据《甲状腺未分化癌诊疗专家共识2023》,甲状腺未分化癌患者中位总生存(OS)期仅5个月,1年OS率为20%,是构成甲状腺癌死亡风险威胁的重要占比人群。
近日,来自MD安德森癌症中心的研究人员在JAMA Oncology发表重要研究,证实抗PD-L1免疫疗法与突变驱动的靶向治疗相结合的策略,可有效延长甲状腺未分化癌患者中位OS,其中BRAF V600E突变患者接受维莫非尼(靶向BRAFV600E突变的抑制剂)/cobimetinib(小分子MEK激酶抑制剂)联合阿替利珠单抗(PD-L1抑制剂)的治疗策略,中位OS可达43个月,相比于既往5个月中位OS,该组合疗法中位OS翻了近9倍!此外,整体中位OS达到了19个月,文章表示,这是迄今为止作者团队所知已报告的甲状腺未分化癌治疗所达到的最长中位OS,超过了既往具有里程碑意义的中位OS。
研究第一作者兼通讯作者,来自MD安德森癌症中心的Maria Cabanillas教授表示:“我们的研究证实了免疫疗法+靶向治疗为甲状腺未分化癌患者带来了获益,目前我们中心已将这种联合疗法作为BRAF突变的甲状腺未分化癌患者的标准治疗策略”。

截图来源:JAMA Oncology
这是一项单中心、平行队列、根据肿瘤突变状态分配靶向治疗的2期临床试验。研究纳入了甲状腺未分化癌患者43例,基线时患者美国东部肿瘤协作组(ECOG)体能状态评分≤2分,器官功能良好,根据患者具体基因突变情况选择相应的治疗措施,其中:
-
队列1(19例):BRAF V600E突变患者,接受维莫非尼/cobimetinib联合阿替利珠单抗治疗;
-
队列2(21例):RAS突变(NRAS突变、KRAS突变或HRAS突变)或NF1/2突变患者,接受cobimetinib联合阿替利珠单抗治疗;
-
队列3(3例):无任何突变的患者接受贝伐珠单抗联合阿替利珠单抗治疗;若存在VEGF抑制剂禁忌证,则采用以紫杉醇化疗为基础联合阿替利珠单抗治疗。
文章指出,采用联合治疗策略是考虑到相比于靶向治疗,免疫治疗起效时间更长,而对于甲状腺未分化癌这类局部快速进展的肿瘤,需要起效更迅速的治疗策略。考虑到旁路信号通路的激活是癌症靶向治疗耐药性的常见机制,研究人员选择了联合完全不同作用机制的免疫疗法。此外,既往也有研究显示,靶向治疗可能会改变肿瘤免疫环境,可能与免疫治疗起到协同作用。
队列1有1例患者退出研究,因此最终可评价患者为42例,数据截止时,29例(69%)患者死亡,13例(31%)例患者存活。研究结果显示,中位随访时间18.97个月时,队列1~3的甲状腺未分化癌患者中位OS(主要研究终点)为18.23个月,中位无进展生存期(PFS)为7.98个月,其中队列1的中位OS和PFS显著优于队列2和队列3:
-
队列1:中位随访42.14个月时,中位OS为43.24个月[95%CI:16~尚未达到(NE)],中位PFS为13.93个月(95%CI:6.60~64.13);
-
队列2:中位随访8.74个月时,中位OS为8.74个月(95%CI:5.13~36.96),中位PFS为4.8个月(95%CI:1.84~14.69);
-
队列3:中位随访6.21个月时,中位OS为6.21个月(95%CI:4.1~NE),中位PFS为1.3个月(95%CI:1.3~NE);
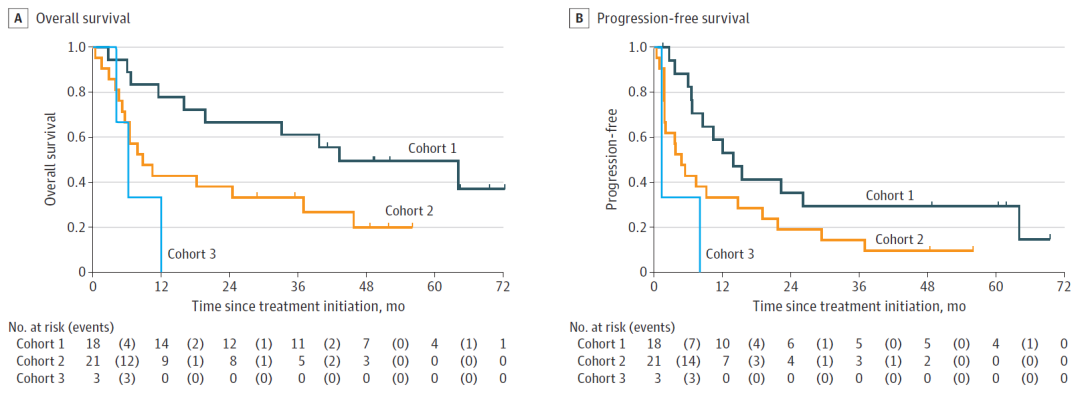
▲队列1(深绿色)、队列2(橙色)和队列3(蓝色)的OS(图A)与PFS(图B)对比(图片来源:参考文献[1])
此外,队列1和队列2客观缓解率(ORR)分别为50%和14%。3个队列共有15例(36%)患者接受了超过12个月的治疗,且20例(48%)患者治疗第二年仍存活。
值得关注的是,队列1中有8例患者在治疗期间发生疾病进展或因此而死亡,其中仅有2例患者存在新的基因突变,分别为NRAS Q61K突变和TERT启动子区域的−124C突变。文章表示,BRAF抑制剂治疗甲状腺未分化癌的耐药机制是临床研究热点方向之一,此前曾有研究报道过这种特别的RAS突变可能与甲状腺乳头状癌和甲状腺未分化癌的耐药机制有关,这些肿瘤可能将这种RAS突变作为抑制MAPK旁路的替代途径。
安全性方面,队列1中有1例患者死亡原因为结肠穿孔,被认为可能与试验相关,队列2发生了1例2级结肠穿孔,其他值得临床注意的不良事件包括结肠炎、视神经乳头水肿等,整体安全可控。
文章特别指出,该研究治疗操作考虑了临床实践中甲状腺未分化癌患者的实际情况,因为研究允许需口服靶向药但无法吞咽的患者入组,队列1和队列2均允许使用cobimetinib混悬液或压碎后兑入食物中,以管饲的方式服药,较为宽松的筛选条件也是该研究能够在4年的时间内有52例患者入组的原因,而既往大多数甲状腺未分化癌相关试验都很难完成初始的患者入组。这对未来甲状腺未分化癌相关研究提供了不同角度的借鉴意义,即设计更为合理的试验流程,以更符合临床实践条件并及时完成研究,是诸如甲状腺未分化癌这类罕见癌症研究成功完成的关键所在。
总之,这项非随机对照研究发现,由突变驱动靶向治疗联合PD-L1抑制剂免疫治疗是延长甲状腺未分化癌患者OS的一种具有前景的策略。未来需要在非BRAF突变的甲状腺未分化癌患者中继续探索更适合的靶向药物治疗方案。
参考资料
[1] Cabanillas ME, Dadu R, Ferrarotto R, et al. Anti–Programmed Death Ligand 1 Plus Targeted Therapy in Anaplastic Thyroid Carcinoma: A Nonrandomized Clinical Trial. JAMA Oncol. Published online October 24, 2024. doi:10.1001/jamaoncol.2024.4729
[2] 陈隽, 王卓颖, 陈立波 . 甲状腺未分化癌诊疗专家共识2023[J]. 中华转移性肿瘤杂志, 2023, 6(3): 197-206. DOI: 10.3760/cma.j.cn101548-20230712-00116
[3]University of Texas M. D. Anderson Cancer Center.Combining targeted therapy and immunotherapy improves overall survival in patients with anaplastic thyroid cancer.24-Oct-2024.https://www.eurekalert.org/news-releases/1062469


