放疗中的远隔效应:过去、现在与未来
时间:2024-10-21 14:00:23 热度:37.1℃ 作者:网络
远隔效应(abscopal effect, AE)指的是肿瘤放疗时,未接受放射治疗的远处肿瘤出现缩小或消失的现象。
AE因其能够延展放疗作用至远端转移病灶,成为近年来肿瘤治疗领域的研究热点。随着免疫治疗的迅速发展,放疗与免疫治疗联合使用增加了AE的发生率。然而,AE的临床表现依然罕见且难以预测。
本文将深入探讨AE的历史、机制及未来前景,并揭示其潜在的临床应用价值。
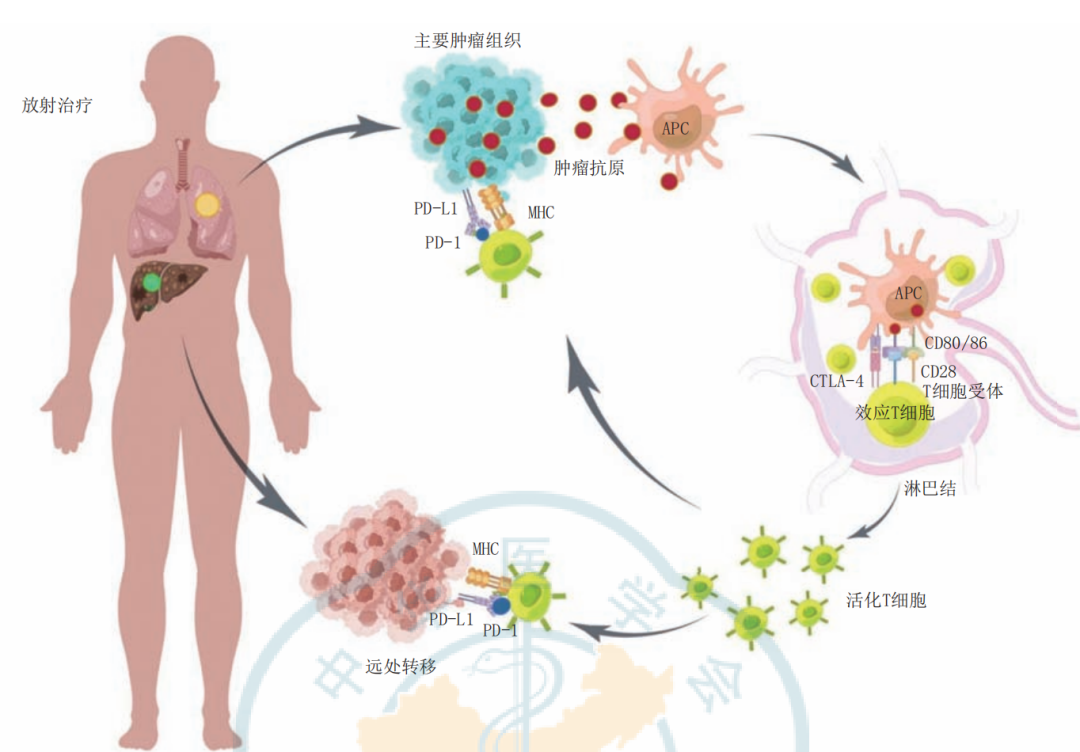
注:PD-L1为细胞程序性死亡配体1;PD-1为程序性死亡受体1;MHC为主要组织相容性复合体;APC为抗原呈递细胞;CTLA-4为细胞毒性T淋巴细胞相关蛋白4;CD为白细胞分化抗原;
图1 远隔效应的发生机制
远隔效应的历史发展:从发现到现代突破
远隔效应的概念自提出以来,经历了从早期的理论假设到现代放疗与免疫治疗结合的多学科探索。
早期探索与发现
1、Heineke的早期研究(1905年)
远隔效应的最早起源可以追溯到1905年,Heineke等人首次提出辐射可能通过血液系统将信号从受照射部位传递到未受照射的区域。这暗示了某种体内机制可能使得放射治疗不仅局限于局部作用,而能够影响到远端组织或器官。
2、旁观者效应的提出(1930年代)
1938年,Segal等人通过动物实验进一步证明了辐射可能导致远处组织的反应。例如,在对荷瘤小鼠进行辐射治疗后,他们发现淋巴器官出现了萎缩,最早这一现象被称为“旁观者效应”。该现象为未来AE的发现奠定了基础,提示了辐射的全身性影响。
3、远隔效应的正式提出(1953年)
真正意义上的“远隔效应”一词由英国科学家Mole于1953年提出。他观察到,当局部肿瘤接受放疗时,远处未接受辐射的肿瘤也出现了缩小或消退的现象。Mole的发现开创性地提出了放疗可能具备全身治疗的潜力,使得远隔效应成为放疗研究中的一个独特现象。
临床报道与理论发展(1950-1970年代)
1、Nobler的首次病例报道(1960年代)
1963年,Nobler首次在临床上报道了远隔效应的病例。一名恶性淋巴瘤患者在腹部接受放疗后,远处的双侧胸腔积液竟也随之消退。这是首次在人体上观察到AE的发生,为后续的临床研究提供了参考依据。
2、实体瘤中的远隔效应(1970年代)
在1973年,Ehlers和Fridman报道了首例实体瘤的AE病例,患者的纵隔肿瘤在乳头状腺癌治疗期间未接受放疗的区域出现显著消退。这标志着AE不仅仅局限于血液系统疾病,也可能在实体瘤治疗中发挥作用。
3、免疫系统与AE的早期关联(1970年代)
1975年,Milas等人通过实验验证了局部照射与免疫系统的协同作用能够增强AE的发生。他们发现,当放疗与短小棒状杆菌和颗粒棒状杆菌等免疫刺激剂联合使用时,可以显著提高实验动物体内肿瘤的远隔反应。这一发现为后续放疗联合免疫治疗的研究提供了初步依据。
临床报道与理论发展(2000年代)
1、放免联合治疗的提出(2005年)
2005年,Demaria等人首次系统性提出了放疗与免疫治疗结合可以诱导远隔效应的理论。他们指出,放疗能够通过免疫原性细胞死亡(ICD)释放抗原,从而激活全身的免疫反应,这为AE的发生提供了基础。
2、免疫检查点抑制剂与AE的突破(2010年代)
2012年,Postow等人报道了首例使用放疗联合免疫检查点抑制剂(ICI)治疗黑色素瘤的远隔效应病例。患者在接受伊匹木单抗维持治疗期间,椎旁转移的肿瘤接受了姑息放疗,最终诱发了全身免疫反应,其他病灶也随之缩小。这一突破性案例推动了放免联合治疗的临床应用研究。
3、放疗联合免疫治疗的临床试验(2010年代)
2015年,一项收集了2003至2012年41例转移性实体瘤患者的研究表明,局部放疗联合粒细胞‐巨噬细胞集落刺激因子在27%的患者中产生了远隔效应。这一结果进一步证明了免疫治疗与放疗的协同作用。
现代研究与应用(2020年代)
1、大规模临床试验的推进
近年来,越来越多的临床试验证实了放疗联合免疫治疗在提高AE发生率方面的潜力。研究发现,免疫检查点抑制剂如PD-1、PD-L1抑制剂联合大分割放疗能够显著提高AE的发生率,尤其是在黑色素瘤和非小细胞肺癌中。
2、新型放疗技术的应用
随着放疗技术的进步,立体定向放疗(SBRT)、质子治疗和碳离子治疗等新型技术被逐步应用于AE的诱发中。高剂量、精准的放疗能够有效激活远隔肿瘤中的免疫反应。此外,智能材料和纳米技术的发展为AE的发生提供了新的治疗策略。
远隔效应的主要机制
远隔效应是指当肿瘤接受局部放疗时,远端未接受辐照的肿瘤也会发生缩小或消失的现象。AE现象表明,局部放疗不仅对照射区域的肿瘤有效,还能够通过某些机制引发全身性的抗肿瘤反应。AE的发生涉及复杂的免疫系统激活、肿瘤微环境的改变以及多种分子和细胞信号的相互作用。
1、免疫原性细胞死亡
放疗通过诱导肿瘤细胞发生免疫原性细胞死亡(ICD),这是AE的核心机制之一。ICD是指肿瘤细胞在放疗等损伤下,通过一种特殊的方式死亡,释放出一系列损伤相关分子模式(DAMPs)。这些DAMPs具有强大的免疫刺激功能,能够激活先天和适应性免疫反应。
2、肿瘤微环境的变化
肿瘤相关巨噬细胞(TAM)在放疗作用下由M2型(促肿瘤)转化为M1型(抗肿瘤)。M1型巨噬细胞释放促炎细胞因子,激活更多免疫细胞,同时减少免疫抑制细胞(如Tregs和MDSC),从而增强全身抗肿瘤反应。
3、肿瘤引流淋巴结(TDLN)
高剂量放疗作用于肿瘤引流淋巴结(TDLN),重新激活抗肿瘤免疫反应。放疗能清除免疫抑制细胞,激活新的免疫细胞进入肿瘤区域,增强全身免疫监视,促进AE的发生。
4、p53与外泌体的作用
高剂量放疗通过p53介导肿瘤细胞的凋亡或衰老。外泌体则作为信号传递工具,将免疫激活分子从受照射肿瘤传递到远端,进一步增强免疫反应。
5、免疫检查点抑制剂的结合
免疫检查点抑制剂(如PD-1抑制剂)与放疗联合使用,能显著增强T细胞的抗肿瘤活性,提升AE的发生率。
临床研究与挑战
尽管AE在临床上展示出巨大的潜力,但其发生率依然较低,且多种因素影响其可预测性。治疗方案、放疗剂量、分割模式以及肿瘤类型都会对AE的发生率产生重要影响。例如,黑色素瘤和非小细胞肺癌等肿瘤中AE的发生率较高,但在头颈癌等肿瘤中,联合放疗和免疫治疗的效果则相对较差。
未来前景:开启肿瘤治疗的新路径
随着免疫治疗与放疗技术的进步,未来有望通过优化治疗策略来提高AE的发生率。例如,智能材料和新型放射技术的引入可能进一步增强免疫系统的反应。碳离子放疗等高效放射疗法不仅能有效保护正常组织,还能增强肿瘤细胞的凋亡,从而提高AE的发生率。
此外,个性化的治疗方案和更精准的预测模型也将在未来发挥关键作用。通过选择合适的患者群体,并结合合适的放疗剂量和免疫治疗药物,AE的发生有望在更多类型的肿瘤中被激活。
参考文献:
【1】高玉婷,李鹏飞,马国榕,等. 辐射诱导远隔效应机制的研究进展.中华放射肿瘤学杂志,2023,32(09) : 861-865. DOI: 10.3760/cma.j.cn113030-20220822-00285
【2】周盛颖,丁行晨,王勇,等. 联合免疫治疗后恶性肿瘤放疗远隔效应的研究进展.中华放射肿瘤学杂志,2024,33(10) : 964-970. DOI: 10.3760/cma.j.cn113030-20240305-00089


