Adv Sci:中山大学张星团队研究发现KIFC1被确定为STS的潜在生物标志物和有希望的治疗靶点
时间:2024-10-16 17:00:25 热度:37.1℃ 作者:网络
被诊断患有软组织肉瘤(STS)的患者通常处于中晚期,可用的治疗选择本身就有限。迫切需要确定新的治疗靶点。
2024年10月10日,中山大学张星通讯在Advanced Science 在线发表题为“Targeting KIFC1 Promotes Senescence in Soft Tissue Sarcoma via FXR1-Dependent Regulation of MAD2L1 mRNA Stability”的研究论文。该研究中,通过筛选来自Cancer Genome Atlas (TCGA) 和 Genotype Tissue Expression(GTEx)数据库的STS数据,KIFC1被确定为STS的潜在生物标志物和有希望的治疗靶点。
值得注意的是,观察到KIFC1水平显著增加,这与STS患者的不良预后有很强的相关性。研究结果表明,敲除KIFC1可在体外和体内抑制STS生长。此外,发现KIFC1可调节STS中的细胞衰老,这之前没有报道过。发现靶向KIFC1通过与RNA结合蛋白FXR1相互作用诱导细胞衰老,从而以m6A依赖的方式进一步稳定MAD2L1 mRNA。此外,抑制KIFC1显著减少了患者来源的异种移植(PDX)的生长并引发了衰老。这项研究首次提供了KIFC1抑制通过MAD2L1诱导细胞衰老的证据,强调KIFC1是一种新的预后生物标志物和STS的潜在治疗靶点。

软组织肉瘤(STS)是一种罕见的间叶性肿瘤,主要发生在躯干、四肢和腹膜后。它们占成人恶性肿瘤的1%和儿童恶性肿瘤的15%,具有100多种不同的组织学亚型。尽管实施了手术切除和辅助化疗或放疗,但大约40%的患者在5年内会出现复发或转移。在一线全身治疗失败后,替代治疗策略包括针对血管生成、免疫检查点和特定分子生物标志物的抑制剂。鉴于可用的治疗选择有限,迫切需要确定新的潜在治疗靶点。
驱动蛋白家族成员C1(KIFC1,也称为HSET)属于驱动蛋白超家族(KIF),在使用微管马达运输细胞器、蛋白质和mRNA复合物方面起着关键作用。KIFC1以运输裸露的双链DNA而闻名,这是调节DNA合成的关键过程。此外,KIFC1与其他蛋白质相互作用,在着丝粒聚集和染色体稳定性中发挥调节作用。着丝粒扩增是许多肿瘤的共同特征,而KIFC1作为着丝粒聚集的调节剂,被发现在肿瘤中高表达,显著促进肿瘤的侵袭性,包括治疗耐药性、复发和转移。尽管有令人信服的证据强调KIFC1在肿瘤中具有显著的预测性和潜在的靶向治疗意义,但KIFC1在STS发病机制中的表达和作用仍未得到充分探索。
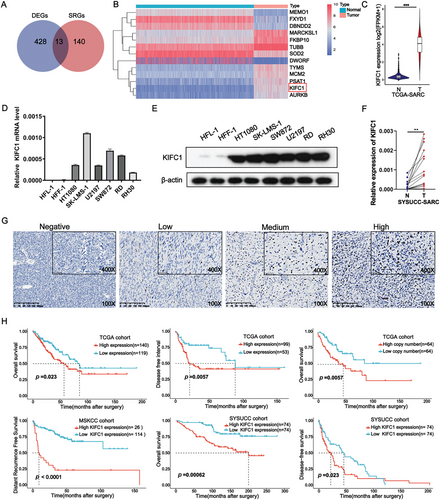
KIFC1表达增加与STS不良预后相关。(图源自Advanced Science )
此外,KIFC1与着丝粒畸变有关,越来越多的证据表明着丝粒缺陷会加速衰老进程。衰老细胞呈现扩大和扁平的形态,表现出衰老相关β-半乳糖苷酶(SA-β-Gal)活性增加,激活p16/p53依赖性细胞周期途径,并分泌多种炎症因子。细胞衰老在肿瘤中起着多方面且矛盾的作用。虽然衰老的基质细胞及其释放的促炎因子可以增强肿瘤干细胞、血管化、治疗抵抗并诱导免疫抑制,但衰老肿瘤细胞中不可逆的细胞周期停滞可能会降低肿瘤的侵袭性,增加对治疗的敏感性,激活抗肿瘤免疫力,并最终促进肿瘤消除。因此,细胞衰老的影响取决于肿瘤类型,并在肿瘤微环境中有所不同。最近的研究表明,诱导细胞衰老可能为肉瘤提供一种新的治疗策略,但STS中细胞衰老的确切机制仍有待完全阐明。
这项研究证明了KIFC1在STS中的致癌作用。KIFC1表达较高的患者预后较差,而KIFC1的消耗会损害体外和体内的STS生长。值得注意的是,这是第一项证明KIFC1的缺失通过调节MAD2L1表达诱导细胞衰老的研究。进一步的分子分析显示,KIFC1与FXR1相互作用,后者随后以m6A依赖的方式稳定了MAD2L1 mRNA。总之,作者的研究结果强调了KIFC1在STS中的重要性,并提出KIFC1可能通过促进细胞衰老成为STS的新型治疗靶点。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202405611


