最新机制研究支持洛塞那肽具有胰腺β细胞保护作用并增强胰岛素分泌及合成
时间:2024-10-16 12:00:43 热度:37.1℃ 作者:网络
近日,《激素与代谢研究》(Horm Metab Res)杂志发表了一篇关于胰高血糖素样肽-1受体激动剂(GLP-1RA)——洛塞那肽的机制研究,该研究揭示了洛塞那肽通过调节PERK/eIF2α信号通路,可以抑制高糖诱导的胰腺β细胞的衰老,促进细胞增殖,改善DNA损伤,增强胰岛素分泌和胰岛素合成。研究结果支持了洛塞那肽在降糖的同时,还对胰腺β细胞具有一定的保护作用,能够通过在细胞水平上改善胰腺β细胞的衰老来促进胰岛素的分泌和合成[1]。

洛塞那肽是我国自主研发的一种长效GLP-1RA,能够显著改善2型糖尿病患者的血糖,并具有降脂、减重、降压、改善肾功能及延缓肾病进展等多重获益,且相比其他GLP-1RA在安全性上具有一定的优势[2],已经广泛应用于临床。然而,目前还没有关于洛塞那肽影响胰腺β细胞衰老方面的研究报告。
众所周知,2型糖尿病主要是由于胰腺β细胞不能分泌足够的胰岛素,以及胰岛素敏感组织对胰岛素没有适当的反应导致的[3]。年龄和衰老是2型糖尿病发展的重要因素,而胰腺β细胞的增殖能力则随着年龄的增长而不断下降[4]。因此,从胰腺β细胞衰老的角度出发,深入了解降糖药物背后的分子机制值得研究。
胰腺β细胞的衰老与内质网应激(ERS)密切相关,内质网应激通过调节蛋白激酶RNA样内质网激酶(PERK)/真核起始因子2α(eIF2α)信号通路介导胰腺β细胞衰老[5]。因此,研究者推测洛塞那肽可能通过介导PERK/eIF2α信号通路来调节胰腺β细胞的细胞衰老,并基于该假设进行实验设计。
研究者对小鼠胰腺β细胞MIN6进行培养,并在高糖环境下对细胞进行诱导,同时采用不同浓度的洛塞那肽对细胞进行处理,然后进行检测分析。结果发现[1]:
● 洛塞那肽能够抑制高糖诱导的胰腺β细胞衰老和SASP因子
SAβ-gal染色表明,高糖诱导可以促进MIN6细胞的衰老,而从低浓度到高浓度的洛塞那肽逐渐逆转了高糖诱导对MIN6细胞衰老的影响,100μM时效果最为明显(图1)。此外,在高糖诱导下,MIN6细胞中衰老相关分泌表型(SASP)因子的表达,如CXCL5、MMP-2、TGF-β和IL-6显著增加,在洛塞那肽治疗后,这些因子以剂量依赖的方式显著下调。
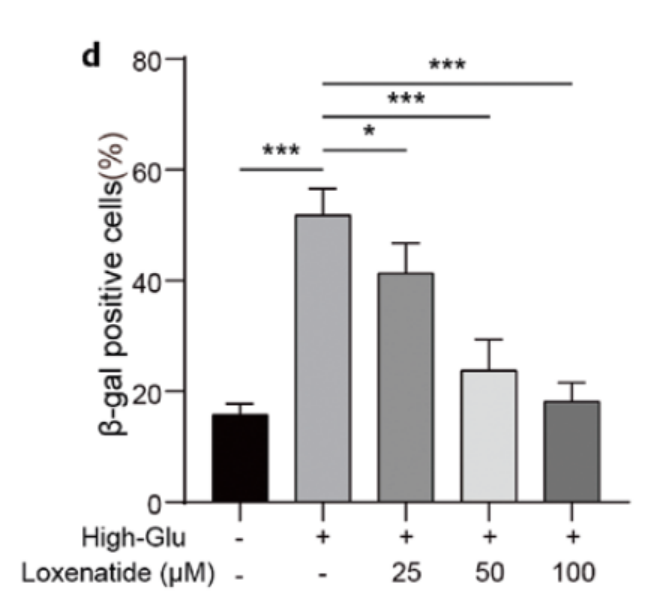
图1. 洛塞那肽逆转高糖诱导的MIN6细胞衰老(SAβ-gal染色)
● 洛塞那肽能够减轻高糖诱导的胰腺β细胞增殖抑制和DNA损伤
免疫荧光检测显示,Ki67(细胞增殖的标志物)阳性细胞在高糖刺激下明显减少,而洛塞那肽以浓度依赖的方式抑制了这一现象(图2)。
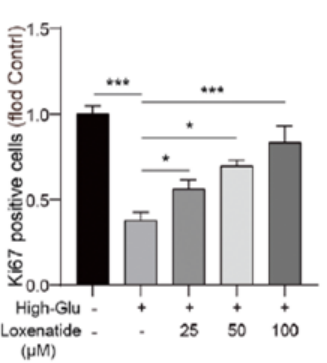
图2.洛塞那肽以浓度依赖方式逆转高糖诱导的Ki67减少(免疫荧光检测)
● 洛塞那肽能够增强葡萄糖刺激的胰岛素分泌,促进胰岛素合成
在2.8 mM葡萄糖浓度下,洛塞那肽对MIN6细胞的胰岛素分泌几乎没有影响。然而,当MIN6细胞暴露于高糖条件下时,洛塞那肽以浓度依赖的方式促进胰岛素分泌(图3)。
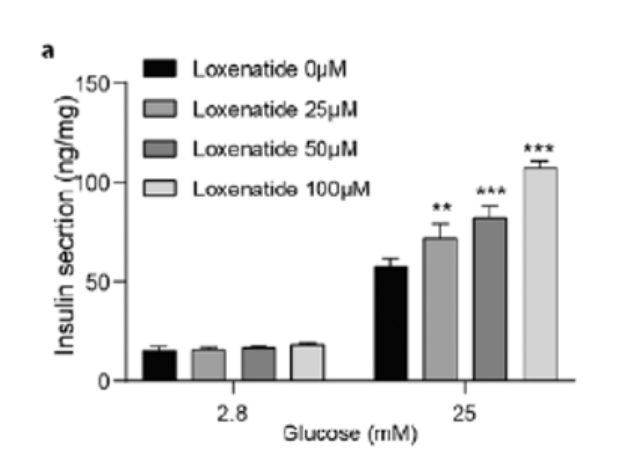
图3.洛塞那肽以浓度依赖方式促进胰岛素分泌
● 洛塞那肽通过灭活PERK/eIF2α信号通路减少胰腺β细胞衰老
已知PERK/eIF2α信号通路与衰老密切相关。蛋白质印迹分析显示,高糖刺激导致p-PERK和p-eIF2α蛋白水平升高,而洛塞那肽以浓度依赖的方式改善高糖诱导的这些改变(图4)。
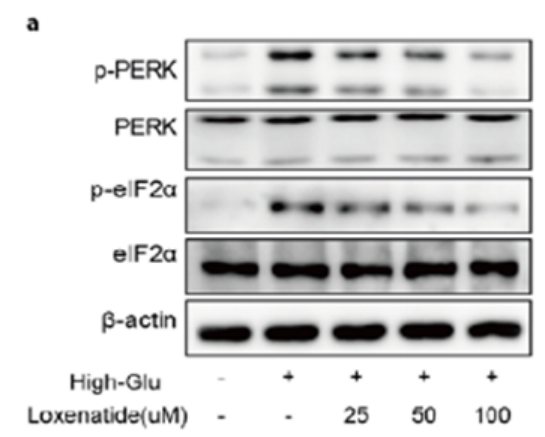
图4.洛塞那肽以浓度依赖方式抑制高糖诱导的p-PERK和 p-eIF2α蛋白水平升高
● 洛塞那肽通过抑制PERK/eIF2α信号通路促进细胞增殖,减轻DNA损伤,增强胰岛素分泌
CCT020312是PERK/eIF2α信号通路的激活剂。Western blot测定显示,在高糖诱导的MIN6细胞中,100μM洛塞那肽导致Ki67和PCNA水平升高,γH2AX水平降低,而CCT020312处理消除了这些变化。此外,CCT020312治疗抵消了100μM洛塞那肽介导的对高糖诱导的MIN6细胞胰岛素分泌的促进作用(图5)。从而证明洛塞那肽是通过PERK/eIF2α信号通路发挥上述作用的。
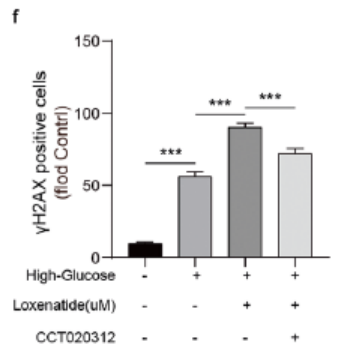
图5. PERK/eIF2α通路激活剂(CCT020312)消除了洛塞那肽对高糖诱导的MIN6细胞胰岛素分泌的促进作用
小结
早期的临床研究发现,洛塞那肽有助改善2型糖尿病患者的HOMA-β指标(一种评价胰岛β细胞功能的指标)[6]。近期一项单中心观察研究表明,洛塞那肽联合SGLT2抑制剂(达格列净)治疗2型糖尿病胰岛素抵抗患者,不仅能够有效纠正糖脂代谢异常,还能提高β细胞功能[7]。但洛塞那肽是如何发挥β细胞保护作用的尚未有过深入研究。这项基础研究首次揭示了洛塞那肽具有延缓胰腺β细胞衰老的机制,从而为洛塞那肽的临床应用提供了更多的实验依据。
参考文献:
[1] Yuan J, Wang Y, Wang D, Yan H, Wang N. Loxenatide Alleviates High Glucose-Induced Pancreatic β-Cell Senescence via Regulating the PERK/eIF2α Pathway. Horm Metab Res. Published online September 27, 2024.
[2] Ying Liu et al. Real-world clinical effectiveness of glucagon-like peptide-1 receptor agonist on mild-to-moderate diabetic kidney disease in patients with type 2 diabetes: a retrospective, single-arm clinical trial.Diabetes, Metabolic Syndrome and Obesity 2024:17 2913–2921.
[3] Galicia-Garcia U, Benito-Vicente A, Jebari S et al. Pathophysiology of type 2 diabetes mellitus. Int J Mol Sci 2020; 21: 6275
[4] Tudurí E, Soriano S, Almagro L et al. The pancreatic β-cell in ageing: Implications in age-related diabetes. Ageing Res Rev 2022; 80: 101674
[5] Lee JH, Lee J. Endoplasmic Reticulum (ER) stress and its role in pancreatic β-cell dysfunction and senescence in type 2 diabetes. Int J Mol Sci 2022; 23: 4843
[6] Chen X, Lv X, Yang G, et al. Polyethylene glycol loxenatide injections added to metformin effectively improve glycemic control and exhibit favorable safety in type 2 diabetic patients. J Diabetes. 2017;9(2):158-167.
[7] 王启生,孟晓萍,柴月星,等. 达格列净联合洛塞那肽治疗2型糖尿病胰岛素抵抗患者的疗效及对糖脂代谢、β细胞功能的影响[J]. 中国医师杂志,2023,25(6):928-931.


