【Blood】Gilles Salles教授:大B细胞淋巴瘤一线临床试验的现状和问题
时间:2024-10-15 12:00:31 热度:37.1℃ 作者:网络
LBCL临床试验
至少25-35%的大B细胞淋巴瘤(LBCL)患者无法通过一线治疗治愈,这部分患者通常预后较差,从而激发了对改善其一线治疗的持续而强烈的兴趣。尽管有数十项研究旨在挑战R-CHOP,但其作为标准方案保持了长达20年,直到最近才被Pola-R-CHP成功挑战,较R-CHOP有无进展生存期(PFS)获益。目前至少有15项有希望的随机研究正在进行中,以评估一线LBCL治疗的新疗法;它们不仅在评估的治疗方法上存在差异,还在对照组的选择、主要终点和患者选择策略上存在差异,包括部分研究针对特定的生物学亚型,部分研究关注特定的高危患者群体,而另一些则纳入老年人或衰弱患者。此外,利用循环肿瘤DNA的新型反应适应性(response-adapted)策略也在进行中。虽然这么多方案的多样性增加了总体成功的可能性,但即使其中几项研究成功,也仍必须在多种可能的治疗方案中做出选择,因为这些方案纳入患者和疗效终点都有差异,从而仍存在挑战。
《Blood》近日发表综述,总结了正在进行的主要一线随机试验(并非预测这些试验的结局,而是考虑这些试验的设计如何影响结果的解读和实施),并讨论了未来几年在临床实践中解释和应用试验结果时可能面临的问题。作者为丹娜-法伯癌症研究所David A Qualls和Philippe Armand教授及纪念斯隆-凯特琳癌症中心淋巴瘤中心主席Gilles A Salles教授。
前言
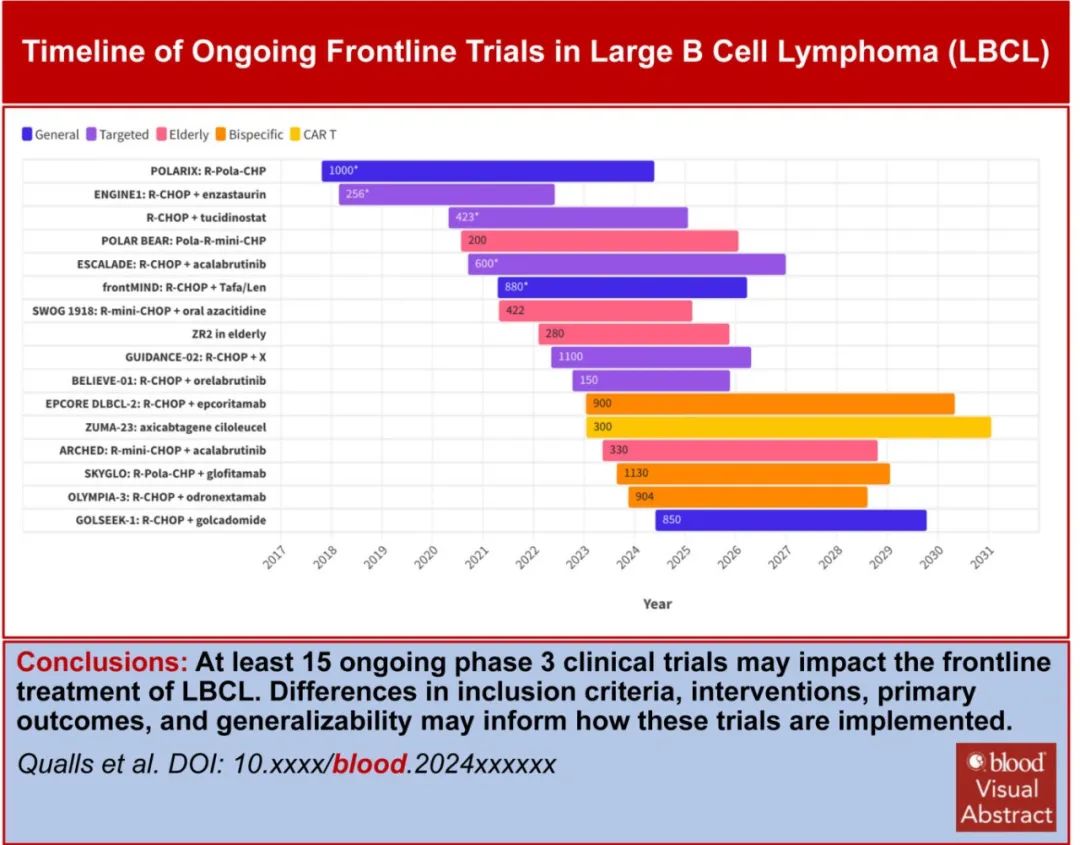
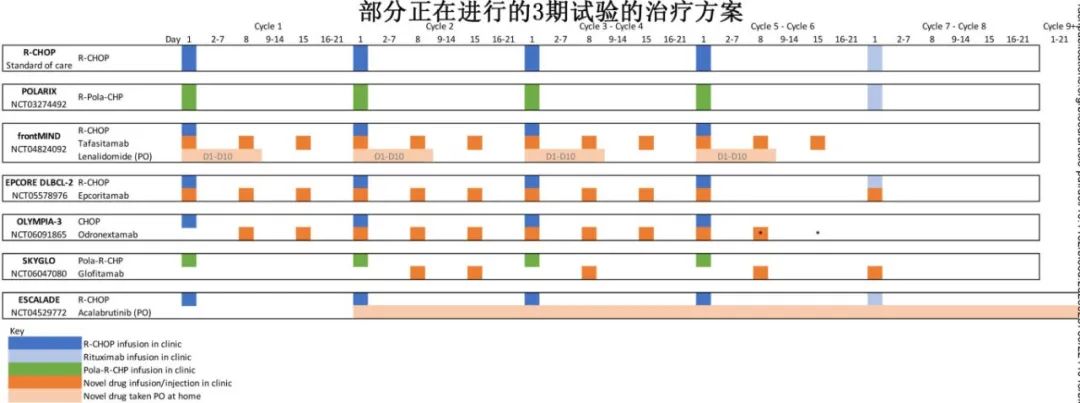
目前至少有15项随机临床试验正在进行中,最终将纳入9000多例患者(表1-3)。这些试验与之前的试验有何不同?如果这些试验中有几项获得阳性结果,后续将如何管理LBCL?
一线LBCL治疗的近期简史
21世纪初,在CHOP化疗中加入利妥昔单抗彻底改变了LBCL的治疗。从那时起多达数十项临床试验纳入10000多例患者,旨在改善R-CHOP。但强化R-CHOP的尝试总体上没有改善生存,并增加毒性。然而利妥昔单抗联合多柔比星、环磷酰胺、长春地辛、博来霉素和泼尼松(R-ACVBP)是一个例外,因为在年龄校正的国际预后指数(IPI)评分为1分的年轻患者中,与R-CHOP相比,其可改善PFS和总生存(OS);然而考虑到给药的复杂性、毒性以及长春地辛可及性,其在欧洲以外的应用有限。R-CHOP后使用依维莫司、enzastaurin、和利妥昔单抗的维持治疗未改善PFS。来那度胺维持可改善60-80岁患者的PFS,但缺乏OS获益及来那度胺相关的毒性限制了其应用。
在R-CHOP方案中添加或替换新药物通常称为“R-CHOP + X”,已经在许多研究中进行评估,虽然结果令人失望,但部分研究的亚组分析证实具有进一步研究的价值。在PHOENIX研究中,虽然伊布替尼未改善总体人群的无事件生存期(EFS),但在60岁以下的患者中显示出显著的EFS和OS获益。使用分子谱的进一步分析发现,具有特定分子亚群的年轻患者(特别是LymphGen定义的MCD和N1亚群,占该研究中的非生发中心B细胞表型患者的比例不到20%)可能获益于加入伊布替尼。同样,ReMoDL-B试验中基因表达谱(GEP)的进一步分析显示,硼替佐米加R-CHOP对活化B细胞(ABC)和分子学高级别淋巴瘤有显著的益处。这些亚组分析有助于规划后续研究,但尚未改变标准临床实践。
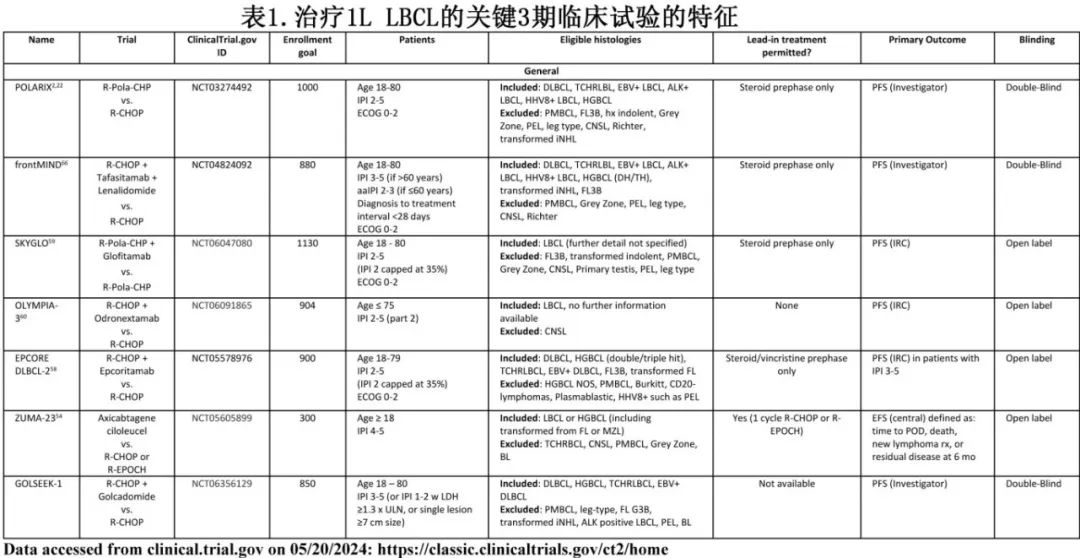
评估Pola-R-CHP (维泊妥珠单抗、利妥昔单抗、环磷酰胺、阿霉素和泼尼松)的POLARIX研究达到了主要终点,也改变了许多患者的治疗(表4)。
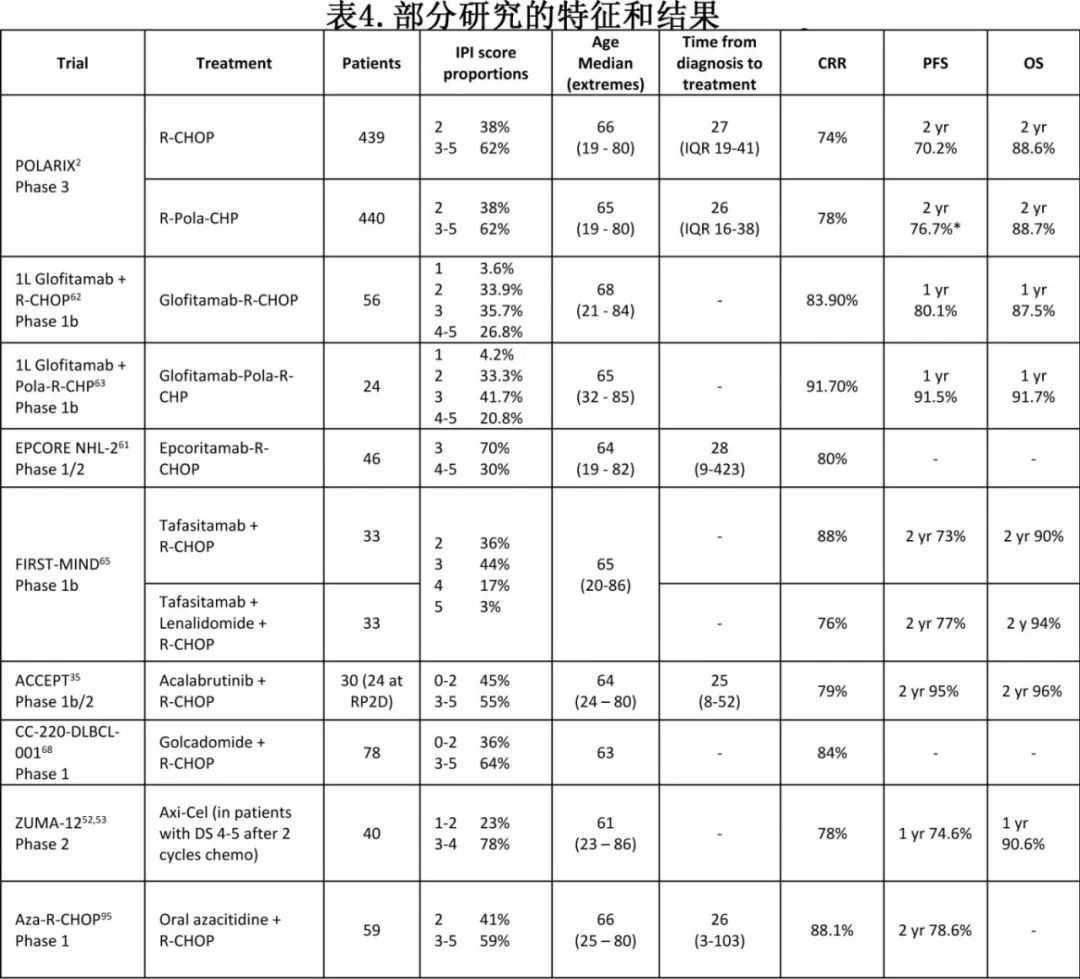
该研究也提出了一些重要问题,对于正在进行和未来试验的设计和解释很重要。首先,与R-CHOP相比,Pola-R-CHP改善了PFS,但OS没有改善。其次,使用GEP对POLARIX进行的事后亚群分析表明,在DLBCL的ABC亚型中有显著获益,但对生发中心B细胞(GCB)型DLBCL没有显著获益。结合上述PHOENIX和ReMoDL-B的亚群分析,证实更个性化的治疗(而非通用方案)可能最终成功改善LBCL患者的生存。
LBCL的生物学:个性化治疗是否成功的关键?
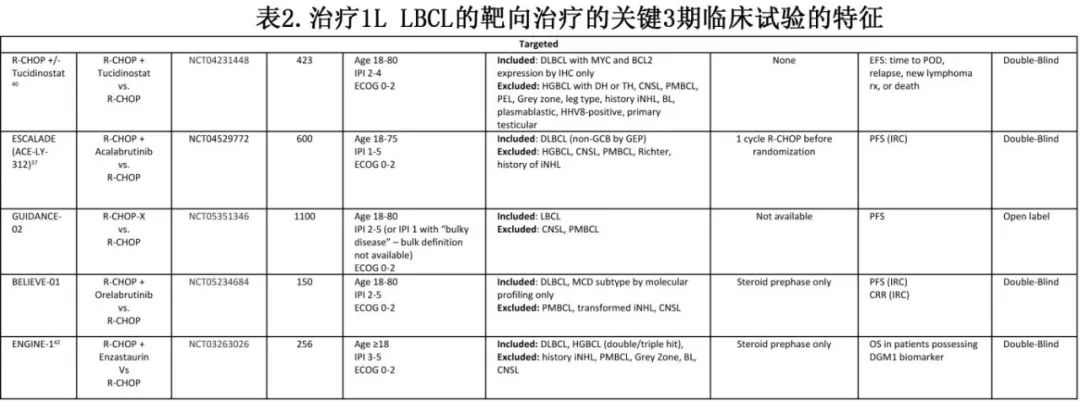
LBCL是一种异质性疾病,可使用多种生物学特征进行分类,包括组织学亚型、基因表达谱、基因组改变或肿瘤微环境。目前已提出多种分类,且这些分类交叉但不相同,从而突出了该疾病的显著生物学差异,以及临床试验入组标准中定义可重复的亚组具有难度。GUIDANCE-02和ESCALADE(见下文)等研究已经在使用基因组标准来选择患者或治疗(表2),这在解读和实施方面提出许多挑战。
定义LBCL生物学亚群的挑战
临床汇总应用生物靶向疗法需要采用与试验相同的分类工具,但目前存在许多分类系统,它们存在重要的差异和局限性。LBCL可根据其“起源细胞”(COO)进行分类,分为GCB亚型和ABC亚型;虽然最理想的方法是使用GEP,但在临床实践中通常使用免疫组化和Hans算法,可能会导致10-20%的患者错误分类。基因组层面已经提出至少5种LBCL亚型;目前有多种分类方法,但可分类肿瘤的亚型描述和比例各不相同,因此均未纳入常规临床实践。此外每个基因组子集在所有LBCL病例中所占比例相对较小,并且在使用基因组分类器的试验中许多患者仍未分类(下图)。将患者群体划分为生物学亚型需要大样本量才能检测到特定亚型的显著差异。最后,LBCL分类正在迅速发展,在试验开始时使用的系统可能在试验结束时已经并非最佳。
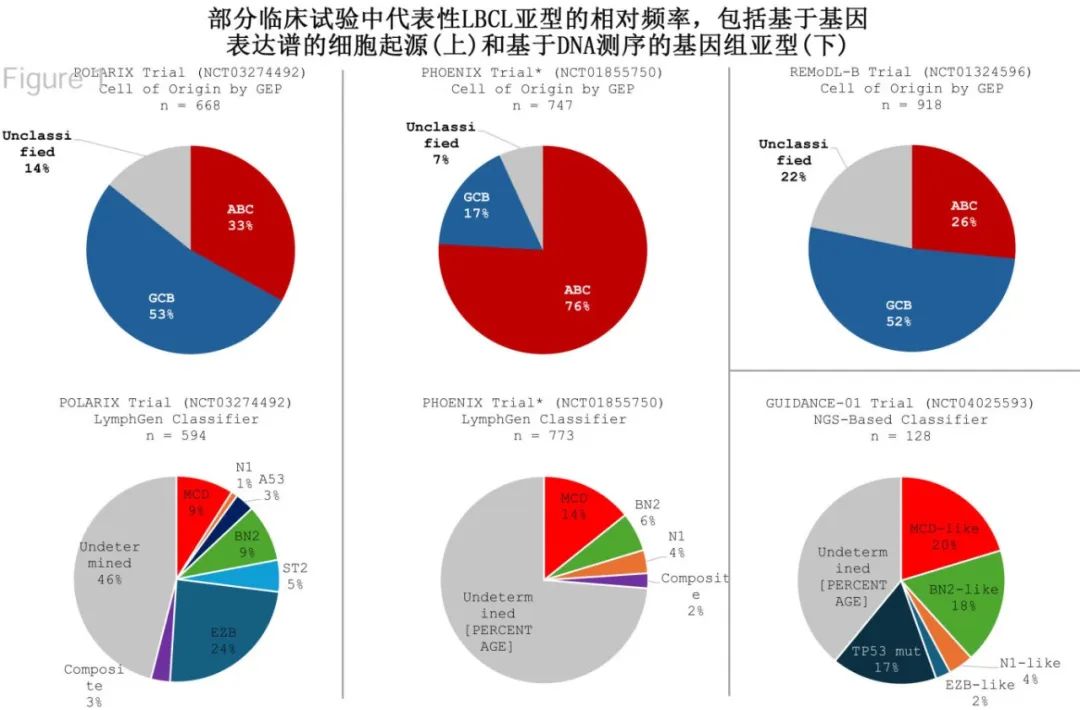
尽管存在这些挑战,但与目前的研究相比,未来要获得显著的治疗获益,确实需要在患者和治疗选择方面有更大的区分度,应寻找可接受的方法,旨在在临床试验中实施基于分子学的患者和治疗选择。下面总结了在这一方向上正在进行的工作。
分子亚型驱动的试验
GUIDANCE-01随机2期试验比较了标准R-CHOP化疗与R-CHOP-X,其中药物“X”根据基因组亚型分配,显示R-CHOP-X显著改善预后。该研究也提出了一个令人兴奋的概念,即基于实时分子学表征给予个性化治疗。然而目前仍存在许多问题。基因组分类法并非标准检测方法,且无法对39%的患者进行分类。该2期研究中所有亚型的显著获益令人惊讶,与使用类似疗法的其他试验相比毒性和脱落率异常低,从而增加了结果可能无法在更广泛的背景下完全重复的可能性。其中许多问题应由确证性3期GUIDANCE-02来回答:1100例患者将进行基因组鉴定,根据基因组亚组分配接受R-CHOP(对照组)或R-CHOP联合奥布替尼、来那度胺或地西他滨。
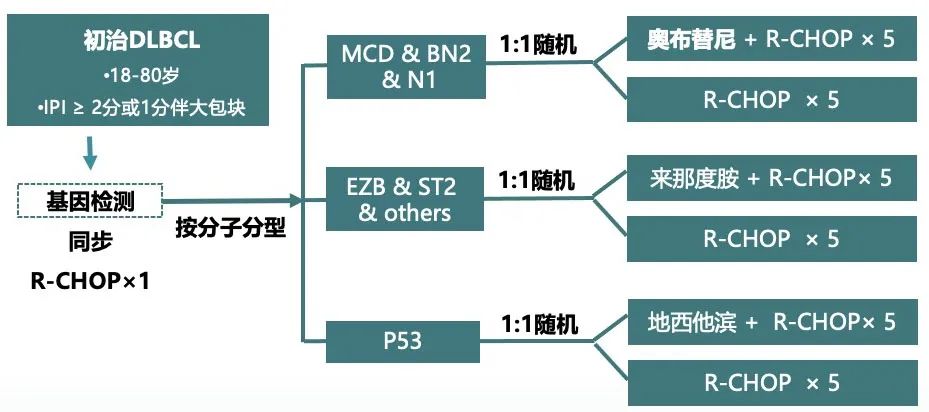
另外三项研究旨在重新审视BTK抑制在LBCL中的可能获益。阿可替尼联合R-CHOP初步显示出安全性和令人鼓舞的结果。一项随机2期试验REMoDL-A正在比较阿可替尼-R-CHOP (A-R-CHOP)和R-CHOP,患者以2:1的比例随机分为A-R-CHOP和R-CHOP,主要终点为PFS,次要终点为特定EGP定义的亚群中的PFS。此外,一项3期试验ESCALADE评估了A-R-CHOP与R-CHOP治疗non-GCB DLBCL,所有患者最初接受一个周期的R-CHOP,以避免在GEP进行时延误治疗,ABC或non-GCB DLBCL患者随后随机分配到5个周期R-CHOP周期+2个周期利妥昔单抗或相同方案+阿可替尼,该试验可能为DLBCL提供首个获批的COO特异性治疗。3期研究BELIEVE-01 (NCT05234684)类似地评估奥布替尼加入R-CHOP治疗LymphGen MCD亚型DLBCL,该研究参考了PHOENIX试验的事后分析结果。
另外两项试验评估了R-CHOP+X策略治疗具有特定生物学特性的LBCL。在R-CHOP中加入组蛋白去乙酰化酶抑制剂tucidinostat,对MYC和BCL2过表达的DLBCL有很好的疗效,促使该特定人群(NCT04231448)开展3期试验。在中国,基于DEB 3期研究结果,西达本胺已获批联合R-CHOP治疗双表达DLBCL。ENGINE1研究评估了IPI评分≥3的患者将enzastaurin加入R-CHOP,主要终点为胚系DGM1多态性患者的OS——2期研究证实其与enzastaurin的获益相关。该研究的独特之处在于所有DLBCL患者都符合条件,但主要结局(需要回顾性确定)仅考虑感兴趣的生物标志物的患者。这样可以更快地纳入患者,没有该生物标志物的患者将无法参与主要分析,并且不需要暴露于额外药物的毒性。
纳入高危人群
R-CHOP治疗对大多数LBCL患者有效,且对低危患者非常有效。先前的临床试验,如Alliance/CALGB 50303研究,比较剂量调整的R-EPOCH(利妥昔单抗、依泊苷、泼尼松、长春新碱、环磷酰胺和多柔比星)与R-CHOP,显示PFS无显著差异,但亚群分析表明R-EPOCH的获益可能局限于IPI评分较高的患者;而低危患者在研究中比例过高,因此使用R-EPOCH并未证实获益。因此,许多试验都招募高危患者(通常由IPI评分来定义),由于这些患者有较高的R-CHOP失败风险,因此在这些患者群体中更容易证明新治疗的获益。
IPI于1993年发表,是LBCL的可靠、有效的预后指标,但在识别真正高危患者方面可能并非最佳。例如最近一项对IPI的多研究验证发现,ECOG PS、LDH和分期与生存率相关性最强,而年龄和结外部位因素的预测性较差,这意味着在相同评分的患者中结局同样有差异。例如,60岁以上IPI评分为2(只有一个额外危险因素)的患者可能比有两个高危因素的年轻患者有更好的预后。年龄调整IPI (aaIPI)仅使用LDH、分期和ECOG PS,可以更好地识别60岁以下的高危患者。最近对IPI 1-2疾病的另一项评估显示,LDH升高(≥正常上限的1.3倍)和/或肿瘤体积>7cm可识别出与IPI 3相似的高危人群。基于这些发现,一些试验正在扩展到IPI之外,以招募高危人群。
除了预后指标外,LBCL试验从诊断到开始治疗 (diagnosis to treatment initiation,DTI)的延迟时间较长,可能导致需要紧急治疗的高危患者被排除在外。该问题促使一些现代试验相应地调整了纳入标准,多项试验现在允许在纳入试验之前接受一个周期的标准免疫化疗,为纳入具有高危特征的患者提供了更容易的路径。其他试验(如frontMIND)则排除DTI超过28天的患者;虽然可能确实排除了一些不需要紧急治疗的较低危患者,但也可能排除因疾病而不能及时完成试验筛查的患者,并且可能排除另一个明显的高危人群。
最后,衰弱患者预后不佳,接受标准免疫化疗时发生毒性的风险较高。确定这些患者的机制已经开发出来,使用新疗法的试验也正在进行中,有希望在改善疗效的同时减轻毒性。
为一线高危患者提供治疗复发/难治性疾病的有效疗法
多种新疗法最近获批用于复发/难治(R/R) LBCL,目前正在一线治疗中进行测试,使用的纳入标准旨在选择高危LBCL患者。
CAR-T细胞疗法已经彻底改变了R/R LBCL的治疗,其中的Axicabtagene ciloleucel (axi-cel)正在评估作为高危LBCL患者的一线治疗方法。2期ZUMA-12研究纳入IPI≥3或双/三击细胞遗传学和2个周期初始免疫化疗后PET CT阳性患者,给予axi-cel而非完成R-CHOP。基于该试验中观察到的有希望的PFS,ZUMA-23 3期试验将随机分配高危患者(定义为 IPI评分4-5)接受axi-cel或标准免疫化疗;允许在入组前进行1个周期的标准免疫化疗,可允许入组高危、短DTI患者。
三种CD3xCD20双特异性抗体(BsAbs), epcoritamab、格菲妥单抗和odronexamab在R/R LBCL患者中疗效良好,epcoritamab和格菲妥单抗已获批治疗R/R患者,也为一线治疗铺平道路;3种抗体目前均在一线随机试验中进行评估。免疫化疗+epcoritamab或格菲妥单抗的一线1/2期研究已显示出高缓解率。在EPCORE DLBCL-2试验中,患者随机分配到R-CHOP联合或不联合epcoritamab组;IPI评分为2-5分的患者符合条件,但IPI评分为3-5分的患者的主要疗效终点为PFS。在随机III期OLYMPIA-3中,IPI评分为2-5的患者接受R-CHOP或odronexamab -CHOP。正在进行的SKYGLO试验,评估将格菲妥单抗加入Pola-R-CHP中,也是唯一一个使用Pola-R-CHP作为对照组的3期试验。
Tafasitamab是一种抗CD19单克隆抗体,联合免疫调节剂来那度胺(Tafa/Len)已获批用于不适合移植的R/R LBCL患者。Tafa/Len+ R-CHOP在初治DLBCL的1b期试验中进行评估,具有足够的安全性和有效性,从而开展3期试验。frontMIND试验纳入IPI评分为3-5或年龄≤60且IPI评分为2-3的患者,单独使用R-CHOP 6个周期或联合Tafa/Len。
最后,新的3期GOLSEEK-1试验评估将golcadomide加入R-CHOP的效果。Golcadomide是一种新型的小脑E3连接酶调节剂,在R-CHOP一线治疗的1b期研究中显示出治疗R/R LBCL的初步疗效和安全性。正在进行的3期试验正在招募IPI≥3或“高危”IPI 1-2伴LDH或肿瘤体积较高的患者。
反应适应性治疗:风险识别的动态手段
相对于在诊断时关注特定的生物学亚群或高危疾病的广泛标志物,根据患者对标准一线治疗的初始反应来识别高危患者或许更可行。PET-CT用于疗效评估,在LBCL中PET适应性方法已用于降低或提高治疗强度。最近,循环肿瘤DNA (ctDNA)也引起极大兴趣,多种ctDNA检测方法已经在LBCL中发展起来,具有不同的方法和性能特征。
很多1期和2期试验以及至少一个3期试验正在评估使用ctDNA的反应适应性疗法。ctDNA定量可作为LBCL负荷及其对治疗反应的替代指标,其风险分层可能比IPI更稳健和动态。此外,ctDNA可实现基因组改变的定性评估,促进生物学表征。最近的研究证明了基于ctDNA的前瞻性检测的可行性。在一项研究中,经过2个R-CHOP周期后血浆ctDNA减少小于2对数的患者(该阈值与不良预后相关)接受格菲妥单抗加R-CHOP治疗。SAKK 38/19 2期试验评估PET-CT和ctDNA引导方法的使用,其中定性ctDNA分析评估MCD基因组亚型,定量ctDNA评估对初始治疗的反应,旨在确定是否将阿可替尼加入R-CHOP。
与PET-CT相比,阶段性变异富集和检测测序(Phased variant enrichment and detection sequencing,PhasED-seq)也特别有希望,对微留疾病检测具有高灵敏度和良好能特征。ALPHA3试验使用PhasED-seq随机分配标准一线治疗结束时的MRD阳性患者使用cemacabtagene ansegedleucel(异基因CD19 CAR-T细胞产品)进行强化。预计在不久的将来将开展利用这些技术的其他试验。
重点关注老年和衰弱人群
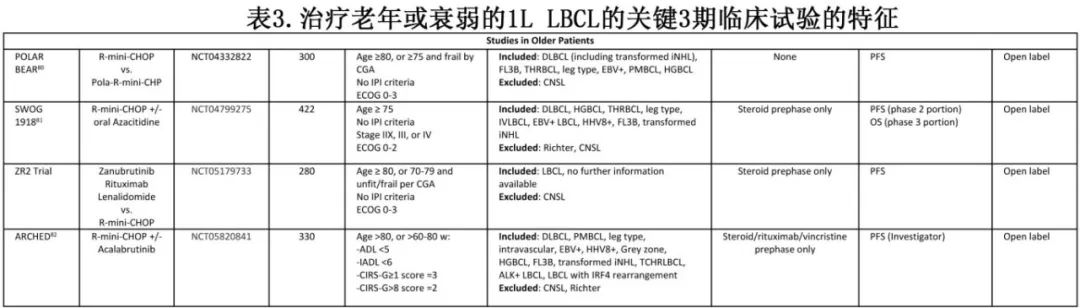
约1/3的DLBCL患者年龄超过75岁,且预计病例数将随着人口老龄化而增加。剂量减毒疗法,如R-mini-CHOP,目前是不适合全剂量R-CHOP的患者的标准治疗方案,特别是年龄超过80岁或有广泛合并症的患者。进行中的试验正在评估在这些患者中基于或替代R-mini-CHOP的方法。
与POLARIX类似,POLAR BEAR研究80将患者随机分配到R-mini-CHOP或R-Pola-mini-CHP组,用维泊妥珠单抗替代长春新碱;纳入年龄超过80岁,或75-80岁且经简化综合老年评估(CGA)为衰弱的患者。初始安全性数据显示两组的安全性和耐受性相似。另外两项试验目前正在评估将口服阿扎胞苷或阿可替尼加入R-mini-CHOP。
一项3期试验纳入年龄≥80岁或70-79岁CGA unfit/frail患者,比较R-mini-CHOP与泽布替尼、来那度胺和利妥昔单抗(ZR2)的无化疗联合方案。在R/R LBCL中使用ZR2的初步1/2期数据,以及一线治疗的回顾性数据均显示出有希望的疗效;但由于随访时间有限,该联合方案的长期治愈潜力仍存在疑问。
针对老年、unfit或frail患者开展试验存在独特挑战。首先是如何定义这些人群,fitness和frailty的标准不同,需要统一的标准来正确解读、比较和应用试验结果。另一个重要的问题为毒性。为了降低毒性,给予R-mini-CHOP代替R-CHOP,但加入另一种药物必然会增加毒性。此外由于符合试验纳入标准的患者必须符合严格的纳入标准,因此unfit或frailty但符合试验纳入标准的患者可能不能完全代表“真实世界”中的unfit或frailty患者,后者可能有更多的合并症、较差的体能状态且对治疗的耐受性较差。还需要进一步的随访和基于人群的研究来确保这些人群的耐受性和疗效。最后,这类试验可能迫使我们深思治愈的概念。相对于R-mini-CHOP,未来可能会出现治愈潜力较小但耐受性或短期疗效更好的方案,可改善短期生存但长期无法维持。对于个体患者的这种权衡,需要细致入微、个性化的方法,并谨慎考虑预期寿命和患者偏好。
试验设计:比较的对象和终点是否有意义?
选择对照组
对于一个与临床实践相关的随机试验,对照组应考虑该疾病可接受的标准治疗。POLARIX研究的一个重要意义在于,当EFS或PFS作为主要终点时,R-CHOP可能是过时的对照组。目前除了SKYGLO之外,所有正在进行的试验都使用R-CHOP作为对照组,从而导致其解释复杂化。如果在某试验中观察到OS优于R-CHOP,则将为支持该方案提供强有力的理由,而非Pola-R-CHP(尚未显示OS优于R-CHOP);但如果仅证明PFS获益,则可能对同一患者群体提供两种(或更多)选择。此外在没有对疗效进行直接比较的情况下,还必须考虑其他因素。如果新方案比Pola-R-CHP毒性更大、更昂贵或更具后勤挑战性,则不太可能被采用。如果在特定的生物学亚型中观察到特定治疗方案的获益,则根据生物学特征使用该方案将很有可能,但可能导致过度解读亚组分析。
优化研究终点
在几乎所有3期试验中,主要终点要么是PFS,要么是EFS。在 LBCL 一线治疗(如 ZUMA-23 中的axi-cel)中加入对 R/R 患者高度有效的治疗时,采用 PFS 或 EFS 可能存在问题。该研究的主要终点为EFS,但EFS无法反映一线免疫化疗失败患者接受二线 CAR-T 治疗的获益;即使该研究结果为阳性,在一线中使用CAR-T治疗高危患者是否优于初始免疫化疗(采用CAR-T作为二线治疗)仍是悬而未决的问题。ALPHA3研究(如上所述)使用异基因CD19 CAR-T细胞产品作为巩固治疗,也使用EFS作为主要终点,并提出类似的问题;该情况下另一个值得关注的事实在于,正在研究的产品并非已获批治疗R/R LBCL的药物,理论上可能会损害标准CD19 CAR-T细胞产品的未来疗效。
另一个值得关注的问题在于LBCL中PFS替代OS。如上所述,POLARIX研究还没有显示出OS获益。如果PFS的获益伴随几乎没有增加毒性(如POLARIX的情况),并且对挽救治疗的疗效没有显著影响,那么缺乏OS的获益可能不会成为其障碍。但是,如果毒性负担大幅增加(包括经济毒性),或者如果药物的一线使用可能对其后期使用产生重要影响(如CAR-T细胞或BsAb),则很难接受单纯PFS获益(而不伴随OS获益)可以改变标准临床实践。
因此,在这些试验中,OS应该是一个非常密切关注的终点。即使有OS获益,在治疗失败的情况下也应注意方案后治疗。是否允许交叉,以及是否有CAR-T细胞等有效的二线疗法,都会显著影响OS。此外还需要关注长期毒性(如心肌病、感染和第二肿瘤)及其对长期生存的影响。
PFS之外:生活质量、成本和多样性
虽然疗效是选择特定疗法的关键因素,但毒性、后勤和费用(所有这些因素都会影响患者的生活质量)也将最终决定其在临床实践中的应用。例如,除了成本之外,采用Pola-R-CHP相当简单,因为它遵循相同的给药方案,并且毒性与R-CHOP相似。
上面提到的几乎所有试验都是在R-CHOP或Pola-R-CHP的基础上增加治疗,这几乎肯定会导致更大的毒性(表5)。
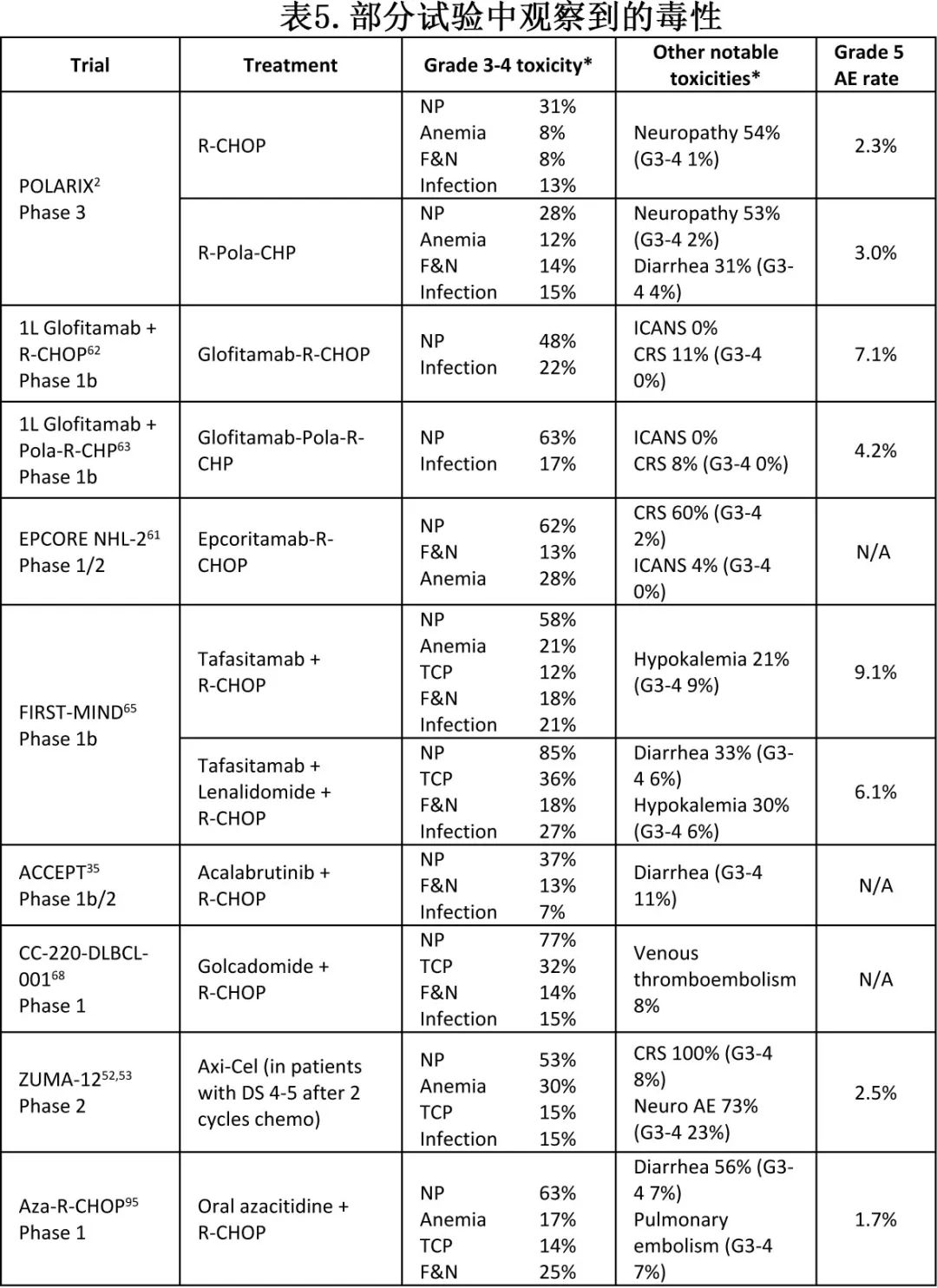
例如,BsAb和CAR-T治疗与感染风险增加有关,在COVID-19大流行期间尤为突出。在tafasitamab/来那度胺-R-CHOP的1/2期试验中,3-4级中性粒细胞减少症、血小板减少症和感染高发。虽然似乎没有显著影响R-CHOP剂量强度,但这些毒性在真实世界中可能会被放大,因为这些方案会用于有合并症的患者,并且没有临床试验中使用的严格监测。在某些情况下,毒性增加可能超过抗肿瘤疗效的获益,要充分认识这一点还需要长期试验的结果。
正在研究的一些治疗方案显著增加所需就诊的频率和次数(下图)。从每3周就诊和输液1次转变为每1周1次会显著增加患者和医疗系统的治疗负担。使用CAR-T细胞(在某种程度上还有bsab)等复杂疗法会带来额外的负担,可能需要住院治疗,而且往往仅限于专门的治疗中心,可能导致在新型联合疗法的应用方面存在地域和社会经济差异。
鉴于医疗保健的经济负担不断膨胀,还必须考虑新型疗法的费用,包括Pola-R-CHP、格菲妥单抗-Pola-R-CHP和tafasitamab/来那度胺-R-CHOP或CAR-T细胞治疗。疾病进展和死亡的减少是否证明这些药物的成本合理,还需要包括患者和多个利益相关方在内的仔细分析,并评估长期数据。
此外,LBCL治疗进展的可及性因地理、社会经济地位、种族和性别等而存在差异,包括临床试验的患者多样性也可能受影响。
展望未来:停止化疗
R-CHOP能被新药联合方案完全取代?对老年患者开展的ZR2研究是提出这一问题的唯一3期研究,但令人鼓舞的早期研究可能会推动未来的试验。基于“Smart Start”试验的有利结果,“Smart Stop”2期试验正在评估来那度胺、tafasitamab、利妥昔单抗和阿可替尼一线治疗(uLTRA)。在A部分,患者接受初始uLTRA治疗,然后根据反应深度接受2-6个周期R-CHOP治疗。受uLTRA高反应率的鼓舞,完全缓解者中完全排除R-CHOP的第二个队列正在进行中。
将化疗完全从一线LBCL治疗中移除会引发许多问题。首先是新方案是否具有治愈性。CHOP方案已有数十年随访,需要更长的时间来证明采用新疗法获得的完全缓解是否可以转化为治愈。如果患者在新型治疗后,在挽救治疗中使用R-CHOP 的结局也可能受到影响,在这种情况下总体策略可能有害。如果无化疗(chemotherapy-free)治疗确实是治愈性的,另一个问题在于这样的方案是否可避免长期 CHOP 相关的风险,特别是第二肿瘤和心脏毒性,以及是否发生新的长期毒性。总体而言,无化疗治疗具有吸引力,但在完全放弃化疗作为 LBCL 一线治疗之前,还需要明确的获益和安全性证据。
结论
虽然在过去的20年里,改善LBCL的一线治疗一直是一项艰巨的挑战,但仍有许多令人兴奋的新疗法正在进行试验。在最好的情况下(其中数项试验获得成功),那么它们在设计、患者人群、对照组、终点、毒性和费用方面的差异将为结果的解读和应用提供详细信息。希望通过仔细的方法学评估和积极讨论(甚至在试验宣读之前),可以以最佳方式应用这些发现来改善患者结局,并开发下一代早期和随机试验。
参考文献
David A Qualls, Philippe Armand, Gilles A Salles.The current landscape of frontline large B cell lymphoma trials.Blood . 2024 Sep 24:blood.2023023789. doi: 10.1182/blood.2023023789.


