【Blood】如何改善TP53突变AML的预后?
时间:2024-09-13 06:02:02 热度:37.1℃ 作者:网络
TP53突变AML
TP53突变急性髓性白血病(AML)和骨髓增生异常综合征(MDS)现在已确定为独特的分子学亚型,其特点为预后极差(总生存期约6个月)和治疗选择不足。此外,关于其潜在的病理生理学、分类、预后和最佳治疗等关键问题也仍未解决。《Blood》近日发表文章阐明了这些关键问题,并就未来的研究如何解决这些问题提供观点,不仅可以提高对TP53突变MDS/AML的理解,还可以为其未来管理提供信息。
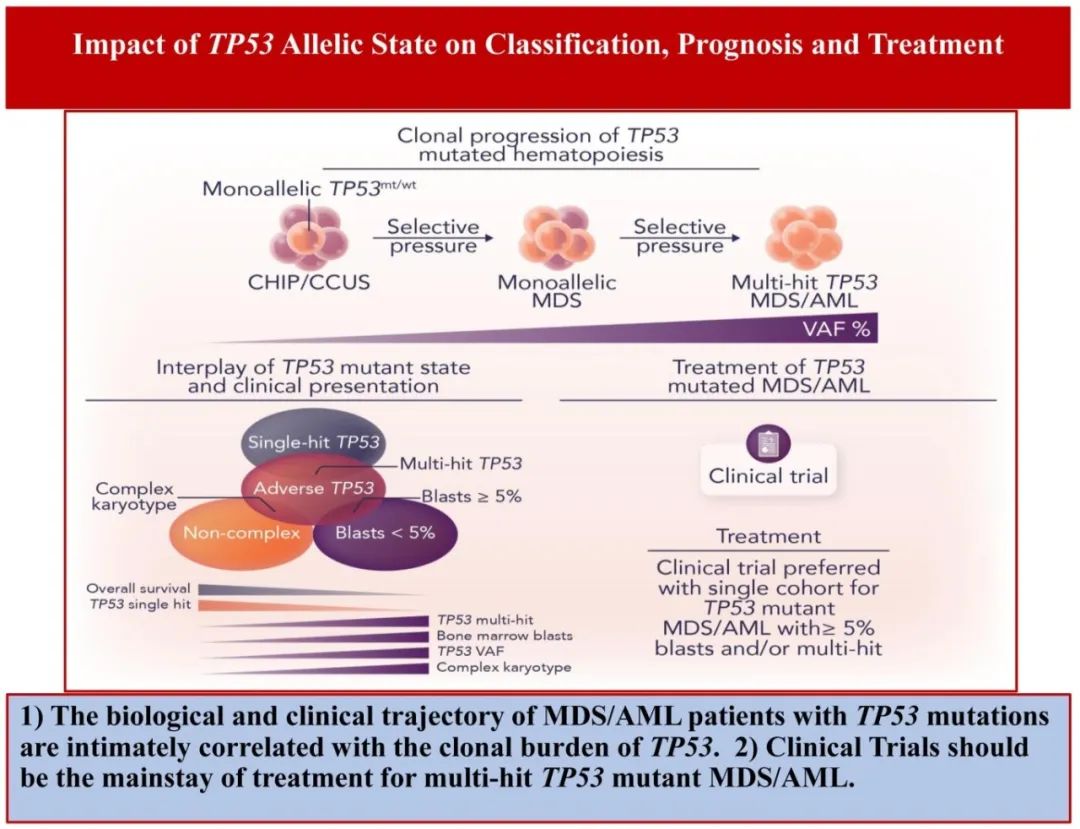
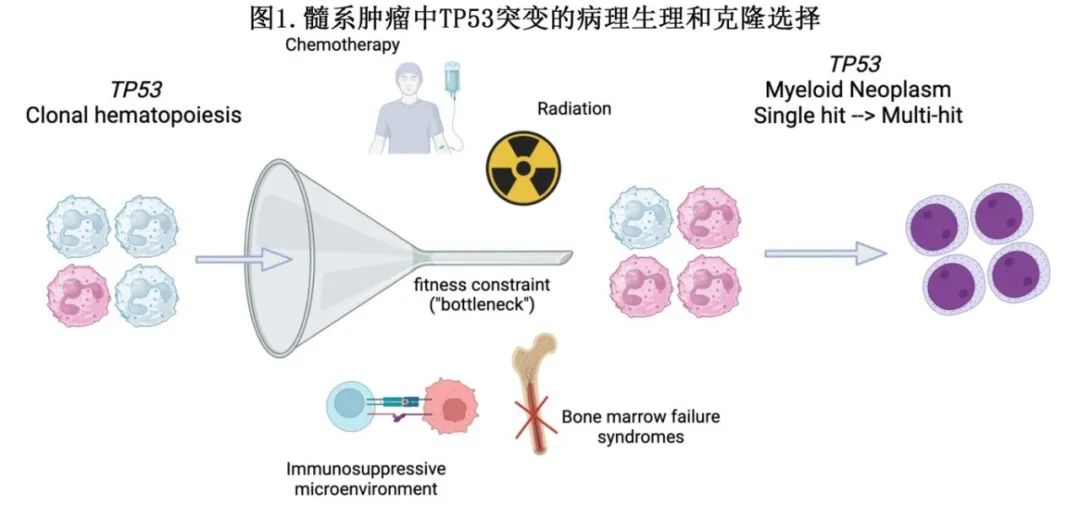
TP53突变从克隆性造血扩展到髓系恶性肿瘤的机制:白血病的发展可以认为是其恶变前克隆群体(称为克隆性造血[CH])随着时间的推移逐渐扩大,因此与正常的非克隆性造血竞争。关键问题在于,细胞内在健康度优势和细胞外在扰动(perturbations)在多大程度上促使TP53突变随着时间的推移而发挥克隆优势(图1)。
TP53突变具有多种功能后果,包括功能丧失(LOF)、功能获得(GOF)和突变TP53等位基因对剩余野生型TP53等位基因的显性负作用(dominant negative effect,DNE)。LOF是TP53缺失(如17p染色体缺失)或移码和stop-gain突变的结果。然而,作为AML中TP53突变的主要类型,p53 DNA结合域(DBD)的错义突变如何发挥克隆优势仍存在争议。最近的研究表明,AML中TP53突变的体内选择可以由DNE和GOF驱动。在混合嵌合小鼠模型中,在DBD中携带TP53错义突变的造血干细胞和祖细胞(HSPC)比TP53单等位基因缺失的HSPC具有相对的竞争健康度优势,但比TP53双等位基因缺失的HSPC具有竞争劣势。不同TP53基因型的相对竞争健康度依赖于剩余野生型p53蛋白的数量(双等位基因丢失>错义突变>单等位基因丢失),这在TP53突变的MDS伴低原始细胞患者的临床环境中得到了概述,而MDS伴原始细胞增多(MDS-IB)和AML患者的数据在下文混合讨论。此外,GOF效应通过表观遗传学机制,通过与EZH2相互作用和增强自我更新和分化,已证明存在于TP53突变髓系肿瘤。
TP53突变可发生于潜力未定的克隆性造血(CHIP)和意义未定的克隆性血细胞减少(CCUS)中(~2%),并在最终发展为治疗相关髓系肿瘤的患者中富集(~30%)。虽然TP53突变已纳入CH风险评分,但该研究中TP53突变与髓系肿瘤并无关联。这是根据先前的研究经验完成的,该研究显示该亚组的外显率很高,分析的是最终发展为AML的患者。值得注意的是,这些研究结果的差异可能是由于等位基因状态、克隆大小和选择压力影响的差异造成的。虽然之前的研究针对的是髓系恶性肿瘤患者和既往接受过化疗的患者,但英国生物样本库的样本包括了其他方面健康的参与者。
重要的是,与CH中最常见的突变DNMT3A突变相比,TP53突变具有相对较低的内在健康度效应。此外,在小鼠模型中诱导的TP53突变可促进自我更新,但需要获得额外的信号突变来诱导明显的白血病转化。这些数据证明了细胞外部影响对TP53突变细胞健康度的重要性,并在临床中得到验证。首先,已证明放疗和化疗在应用DNA损伤诱导疗法之前提供瓶颈(bottleneck,见图1),导致TP53突变CH以小频率优先扩张,这也在骨髓衰竭综合征中得到证明。在这种情况下,一个关键的开放性问题在于,对于发生TP53突变治疗相关髓系肿瘤的患者,有多大比例在接受化疗之前TP53克隆已经存在,以及克隆大小的范围是什么,如何影响未来的风险。另外,这些突变干细胞的免疫逃逸表型以及无活性的免疫抑制微环境导致基础克隆的传播和进展(图1)。
p53病理生理学方面的见解对未来改善预后和治疗干预有什么意义?首先,如果与LOF突变相比,施加DNE的TP53错义突变具有不同的功能后果,是否应该重新定义TP53突变的MDS和AML的预后模型?其次,如果细胞外部健康度约束(fitness constraints)在TP53克隆扩增中起着如此关键的作用,是否可以修改其中的一部分或在骨髓转化之前早期进行干预(例如避免辅助化疗)?最后,考虑到TP53突变随时间发生的克隆扩增,异基因造血干细胞移植(allo-HSCT)的最佳时机是什么?理想情况下应在获得第二次TP53突变打击之前进行allo-HSCT,但在哪种TP53突变克隆大小下早期allo-HSCT的获益超过其相关风险,也需要在未来的研究中谨慎定义。
TP53突变AML和MDS是同一个亚型,但也有少数例外:开发针对TP53突变的AML患者的新疗法的一个主要挑战在于TP53突变AML与TP53突变MDS的区分比较随意,导致相关挑战积累和临床策略的差异。WHO第五版和最近的ICC分类都认为TP53是独特的分子亚型。WHO仅根据双等位基因状态对TP53进行分类,双等位基因状态定义为≥2个突变,VAF>50%或突变合并拷贝数丢失或拷贝中性杂合性丢失,与骨髓原始细胞计数无关。值得注意的是,WHO不认为TP53 AML(即≥20%的原细胞)是独特的分子亚型,而ICC对TP53突变MDS的分类基于多打击状态,包括上述以及复杂核型的存在,但另外要求TP53变体的VAF大于10%。此外,任何VAF>10%的TP53突变都认为存在于原始细胞>10%的TP53特异性亚群中(原始细胞10-19%为MDS/AML,≥20%为AML)。虽然等位基因状态在MDS中具有显著的预后相关性,但最近在AML中的数据显示,TP53等位基因状态与预后的相关性存在不同的结果。虽然大多数研究显示等位基因状态与预后无关,但其他研究表明等位基因状态可能仍影响MDS-IB或AML患者的预后。值得注意的是,与原始细胞<5%的MDS(其中约25%的 TP53 突变为多打击)相比,在 MDS-IB 和 AML 中绝大多数 TP53 畸变为多打击(高达91%)。由于许多中心无法进行拷贝数分析,因此替代方法为TP53克隆的VAF。最近有研究确定23%的VAF截止值,将患者分为单等位基因与双等位基因,具有强大的预后区分;这是建立在2个早期队列的基础上,其中VAF临界值在20-23%之间是预后分层的最佳临界值。综上所述,上述数据有力地支持将TP53 MDS/AML统一为单个疾病亚型,用于原始细胞≥5%和/或多打击患者。理想情况下,未来WHO/ICC分类系统的迭代和协调将认可TP53突变髓系肿瘤定义的扩展。更重要的是,为了更快地为患者改善治疗选择,与监管机构讨论统一TP53分类至关重要。
TP53突变MDS/AML的治疗:TP53突变AML是最迫切需要新的治疗策略的分子亚群,标准治疗下其中位OS<6个月。虽然没有针对所有TP53突变的MDS/AML患者的标准治疗,但作者仍提出一种如图2所示的治疗算法。优先考虑在可行的情况下参与临床试验,对于适合allo-HSCT的患者,作者更倾向于使用基于HMA+维奈克拉的方案在移植前快速减少原始细胞,使移植物抗白血病(GVL)效应有足够的时间呈现。对于不适合移植的患者,作者更倾向于单药HMA治疗。虽然与单独使用HMA相比,HMA+维奈克拉可能诱导更高的缓解率,但尚未证明可提高TP53突变AML的总生存期,事实上有研究显示,TP53的克隆清除率与单药地西他滨无差异。如果不适合移植患者在4-6个周期内HMA没有反应,则作者考虑添加维奈克拉。一般来说,作者会在 TP53突变AML中避免强化疗,因为强化疗的生存结局与减低强度化疗相似,但副作用通常更高。然而对于 TP53 突变患者,可以考虑 CPX-351 强化疗或大剂量阿糖胞苷方案作为亚克隆或挽救治疗,尽管只有原始细胞>20%患者有支持数据(图2)。
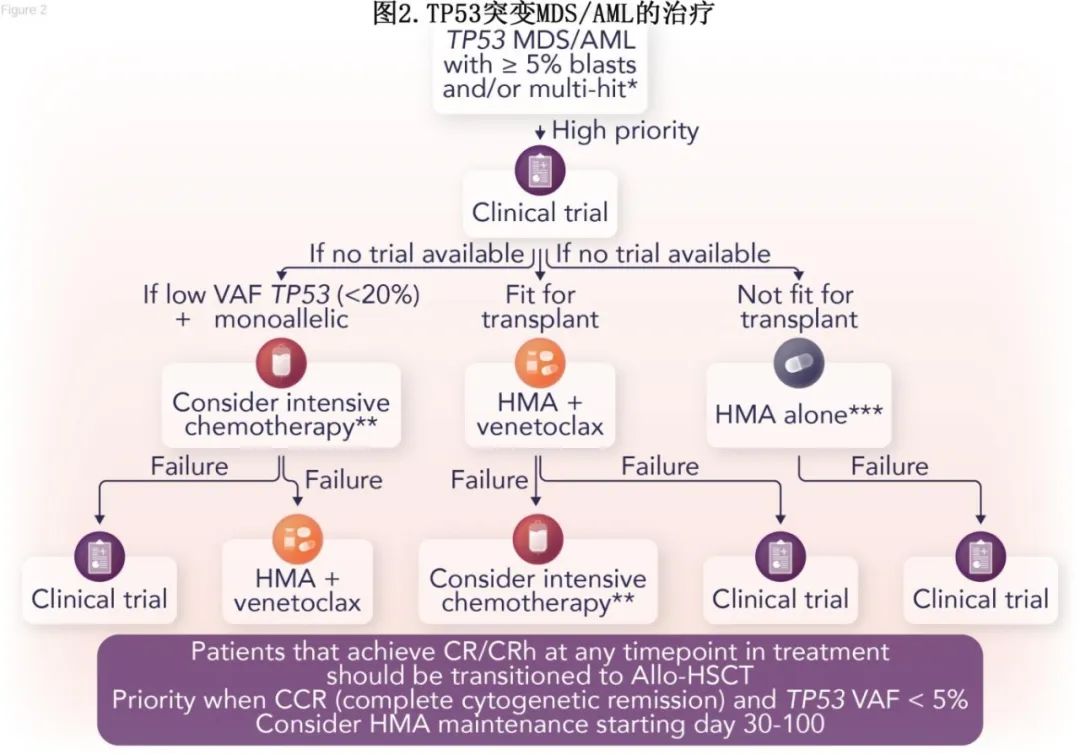
对于未来的前瞻性研究,应该采用高危TP53突变的统一定义,尽管通过原始细胞计数分层可能对最优平衡更实用。值得注意的是,通过国际合作已经证明快速招募TP53特异性MDS和AML研究是可行的,临床试验需要成为这些患者治疗模式的核心(图2)。迄今为止,研究最多的两种药物包括p53再激活剂eprenetapopt(APR-246)和抗CD47药物magrolimab。值得注意的是,APR-246的CR率在平行2期研究中很高(40-50%),桥接移植患者的OS更优(中位OS 27个月)。然而在随机III期研究中,尽管CR率有改善的趋势(33% vs 22%,P=0.13)但未达到主要终点;该研究和关键亚组分析均未报道OS。重要的是,最近的数据已经确定 XPO1是APR-246耐药的关键靶点,为一线和复发/难治性患者的联合治疗提供了强有力的理由。此外,突变型特异性p53再激活剂(如rezatapopt)正在实体瘤的临床试验中,已证明具有稳健疗效,别是在AML模型中联合治疗时(即XPO-1、MDM2和BCL-2抑制剂)。同样,在早期研究中,与历史数据集相比,阿扎胞苷+magrolimab治疗MDS和AML患者的中位OS分别为16个月和10个月,具有良好的结果。然而,阿扎胞苷+magrolimab与阿扎胞苷+维奈克拉或强化化疗(医生选择)的ENHANCE-2 TP53 AML研究因无效而早期关闭。值得注意的是,CD47-SIRPα通路的二代抑制剂(如SL172154)在这一分子亚组中也显示出有前景的早期活性。然而,迄今为止缺乏转化数据来支持抗CD47治疗在这一患者群体中的疗效。
移植还是不移植?最具争议的争论之一是TP53突变MDS/AML患者异基因造血干细胞移植,因长期生存率约为20%。虽然在回顾性研究分析中,接受异基因造血干细胞移植已多次证明是改善OS的预测因素,但在TP53突变AML中缺乏随机对照试验。由于生存率是移植中心认证的关键因素,而这一人群的合并症评分通常较高(例如治疗相关疾病富集),导致该话题变得更加有争议。在allo-SCT之前清除 TP53克隆(<5% VAF)可能会改善OS,已经得到回顾性队列和前瞻性干预性临床试验的支持。然而来自前瞻性CTN-1102研究的最新数据并未显示清除TP53克隆的MDS患者的OS得到改善,尽管研究中具有纵向NGS的队列很小,并且可能富集基线低VAF负荷患者。克隆大小减小与移植结局的相关性也需要进一步的前瞻性研究,此时未清除TP53克隆不应妨碍患者考虑移植。考虑到不良OS是由复发引起,围移植期的临床试验策略将重点放在增加GVL上具有很高的价值。此外,早期维持策略(如HMA)可能对该患者群体有益,因为大多数患者群体接受减低强度预处理,因此可以增加GVL时间。比如,阿扎胞苷联合APR-246维持的RFS为12.5个月,1年OS率为 79%,理想情况下未来将开展该联合方案的随机研究。
结论:TP53突变MDS/AML是一种独特的疾病亚型,预后较差,需要在患者整个治疗过程中进行前瞻性干预,以提高治疗标准。
参考文献
Sallman DA, et al. TP53 Mutated Acute Myeloid Leukemia: How Can We Improve Outcomes?Blood . 2024 Sep 5:blood.2024024245. doi: 10.1182/blood.2024024245.


