综述|低级别胶质瘤临床治疗进展
时间:2024-09-10 23:00:35 热度:37.1℃ 作者:网络
摘 要 低级别胶质瘤(low-grade glioma,LGG)是起源于胶质细胞的原发性脑肿瘤,生长缓慢,总体预后较好,但不能治愈,绝大多数仍会复发,甚至进展为高级别胶质瘤(high-grade glioma,HGG)。LGG治疗方案至今仍存在争议,目前治疗包括手术切除,放疗(radiation therapy, RT)、化疗(chemical treatment),靶向及免疫治疗,但其有效性和安全性有待进一步临床探索。现对LGG的治疗方案包括手术、放疗、化疗、靶向及免疫治疗等方面进行阐述,以便制定个体化的治疗方案,为最大化地延长患者生存时间,改善患者预后提供理论策略。
关键词
低级别胶质瘤;手术;放疗;化疗;靶向治疗;免疫治疗
2021年第5版WHO中枢神经系统肿瘤将脑胶质瘤分为1~4级,其中1、2级为低级别胶质瘤(low-grade glioma,LGG)[1-2]。相较于2016年的版本,新版指南加入了分子诊断,凸显了分子诊断在胶质瘤诊疗中的重要地位[2];将所有的IDH突变型弥漫性星形细胞肿瘤归为单一类型(星形细胞瘤,IDH突变型),并在此基础上根据关键基因及变异分子将其分为2级、3级和4级;同时在新版指南中也首次提出了儿童型弥漫性LGG[2]。虽然LGG生长缓慢,预后相对较好,但仍有进展为高级别胶质瘤(high-grade glioma,HGG)的可能 [3]。因此,基于关键基因及变异分子的基础上了解LGG的手术、放疗(radiation therapy,RT)、化疗(chemical treatment)以及靶向和免疫治疗,对制定LGG的个体化治疗方案显得尤为重要。
1 手术治疗
1.1 偶发性低级别胶质瘤治疗 在目前临床诊疗中关于偶发性低级别胶质瘤(incidental low-grade gliomas,iLGG)的最佳治疗方案是“保守观望”还是“早期手术”一直存在争议。一种观点提倡“保守观望”的治疗方案[4],即患者出现临床症状或MRI提示有转化为HGG的特征时进行手术干预。而一项多中心的研究发现,38.73%接受早期手术的iLGG患者在随访期间出现了肿瘤复发(tumor recurrence,TR)[5],提示iLGG是缓慢发展的肿瘤,并非惰性病变,该研究结果极大支持了早期手术的观点。另一些研究[6-7]显示,与症状性低级别胶质瘤(symptomatic low-grade glioma,sLGG)相比,iLGG更容易切除,同时切除范围(extent of rep,EOR)更大,生存时间更长,而这些研究结果也支持将早期手术作为iLGG治疗的第一选择[5-8]。
1.2 手术切除的程度 LGG弥漫性和浸润性生长特性对肿瘤全切除造成了严峻的挑战。肿瘤体积大小是最大的独立预后因素,较大的肿瘤往往更易扩展到功能区,从而阻碍肿瘤的全切除[9]。尽管不完全切除的风险相对较高,但手术仍是临床有效治疗的首选。肿瘤EOR与总生存期(overall survival,OS)密切相关,SMITH等[10]对LGG患者肿瘤残留量分析结果显示:EOR≥90%的患者5年和8年OS分别为97%和91%,EOR<90%的患者的5年和8年OS率分别为76%和60%。因此得出的结论:切除范围越大,预后越好。
一项回顾性队列研究[9]在术前和术后采用FLAIR成像评估肿瘤体积以确定EOR,结果表明肿瘤全切除(total rep, GTR)、近全切(near-total rep, NTR)和次全切(subtotal rep, STR)的5年OS分别为95%、80%和70%,表明GTR优于NTR和STR,并且当肿瘤位于功能区影响完全切除时,NTR和STR可为患者的预后提供一定的生存优势。因此,只要在安全的前提下应始终首选GTR,而当肿瘤位于功能区时,可尝试NTR或STR。如果LGG位于非功能区,可行超全切(supratotal rep,SupTR),即手术切除FLAIR信号的部分,同时切除影像学上肿瘤边缘浸润的组织[11-13],而且在接受SupTR的患者一般不再需要辅助治疗,其疗效与GTR、STR相比预后相似甚至更好,同时 SupTR术后癫痫发生的概率更低,但目前以损害神经功能为代价行SupTR仍没有足够的证据支持[11, 14-15] 。
研究[9]表明LGG患者良好的预后与更高的EOR相关,而与有利的基因图谱无关。因此,即使LGG患者缺乏良好的基因图谱,如1p/19q基因缺失,高的EOR也可能有利于预后,应始终首选手术治疗增加患者OS。IJNENGA等[16]根据2016年WHO对LGG的分类,在校正了IDH突变等分子特征后,研究了患者术后肿瘤的残留体积与OS的关系,得出术后微小残留对患者的OS产生了负面影响。因此,无论肿瘤大小及基因图谱如何,应在安全的前提下行更高的EOR,尽可能地切除肿瘤残留物。
1.3 术中尖端设备的应用 术中磁共振成像(intraoperative magnetic resonance imaging,iMRI) 引导下进行肿瘤切除,可以提高患者的OS。NIMSKY等[17]报道,iMRI提高了9例手术患者中7例EOR,而另外2名患者是由于肿瘤位于功能区,阻碍了EOR。术中超声 (intraoperative ultrasound,IOUS)的应用已被证明能够提供实时定位和确定肿瘤大小和形状,同时帮助识别残留肿瘤并解决大脑“漂移移位”问题[18-19]。EL BELTAGY等[20]在25例脑肿瘤患儿中使用B型IOUS后发现, IOUS图像可以提高肿瘤边缘与正常脑组织的辨别能力。术中荧光定位技术可以标记肿瘤边界,最大限度地安全切除肿瘤,以提高肿瘤全切率和神经血管保护率,从而提高患者PFS和OS[21]。在过去的20年中,术中唤醒过程中电生理监测的使用有所增加。这种干预已被证明可以增加EOR,改善术后生活质量,延长幕上LGG患者的OS[22]。这些术中尖端设备的应用为多模态辅助下精准手术切除肿瘤提供了安全保障。
2 放射治疗
RT在成人LGG治疗中一直存在争议。CHAMMAS M等[9]根据年龄和EOR将LGG患者分为低风险组和高风险组,低风险组为40岁以下并接受过GTR的患者,而高分险组为年龄40岁以上或接受了STR或NTR的患者。低风险患者通常在确诊时可以推迟辅助治疗,只要随访观察即可[9]。然而低风险组中有一个特殊的亚群(即IDH野生型),可在术后RT和化疗中受益,因此其应同高分险组的患者一样术后行RT和化疗[23]。RT的关键主要包括2个方面:①进行RT的时间;②所需的放射剂量。根据胶质瘤放疗中国专家共识(2017年)[24]中对于高风险LGG术后RT时机是术后应尽早开始,建议术后4~8周,多项指南推荐术后RT剂量45~54 Gy,单次照射 1.8~2.0 Gy/次。
尽管RT对LGG患者的预后有益处,但治疗后脑白质病变和长期记忆力下降等较为严重的不良反应也不可忽视[9]。因此,应根据患者的具体情况及突出的不良反应制定个体化的治疗方案。
3 化学治疗
目前LGG已有几种化疗方案应用于临床,但最佳的方案尚未确定。对于高分险组LGG患者而言,相比较于单纯的RT,联合化疗是一种更好的治疗方案。一项来自BUCKNER[25]的大型试验发现高分险组LGG患者,在放疗后接受丙卡巴肼、洛莫司汀和长春新碱(procarbazine, lomustine and vincristine,PCV)化疗患者的中位生存期(median survival times,MST)(13.3年)明显高于仅接受RT的(7.8年)。相比较于PCV ,临床医生更倾向选择毒性更小的替莫唑胺(temozolomide,TMZ)用于联合RT。仅RT的LGG患者MST约为7.2~7.6年,而 RT联合TMZ治疗的患者MST为5.6~9.1年[26]。因此对于PCV的疗效是否优于TMZ仍需进一步研究。
MCDUFF等[27]研究则认为并不是所有的高危LGG患者都可广泛使用 TMZ ,应根据 IDH 状态调整化疗方案,如对于IDH 突变肿瘤(包括 1p/19q 缺失和非1p/19q缺失的肿瘤)患者应进行PCV辅助治疗。一项前瞻性试验(ALLIANCE-N0577-CODEL)[28]通过对1p/19q缺失肿瘤(WHO III级胶质瘤或高风险WHO II级低级别胶质瘤)患者进行随机分组,让患者分别在放疗后接受 PCV或TMZ 辅助治疗来解决这一争议。总之,对于LGG的患者,根据欧洲、 美国及中国的指南认为PCV和TMZ的化疗方案均可行,但要找到最佳化疗方案,仍需要等待进一步的研究。
4 新治疗方式
尽管术后RT和化疗在高危组LGG的治疗中已显示出良好效果,但LGG仍可能复发或进展为更具侵袭性和致命性的HCG。因此,迫切需要寻找新的治疗方式,延长LGG患者的生存时间,提高生存质量。
4.1 靶向治疗 LGG的主要特征是IDH突变,并且IDH突变也常在其他恶性肿瘤中发现,如急性髓系白血病、胆管癌、软骨肉瘤和骨髓增生异常综合征[29]。IDH突变在其他肿瘤中(如白血病)通常代表较差的预后[3],但它在LGG中却相反。目前有关IDH1突变的靶向治疗被广泛研究。正在研究中的艾伏尼布(AG-120),主要用于治疗复发或进展性IDH突变胶质瘤。AG-120已被证明对突变的IDH1具有很强选择性,并在治疗IDH突变的胶质瘤(包括66例复发或进展性胶质瘤)的I期研究中,发现其可以降低血液中2-HG的水平[30]。
除此之外,通过干扰α-KG使细胞变得依赖于末端连接酶进行DNA修复,从而提高聚腺苷酸二磷酸核糖聚合酶抑制剂(PARPI)也有治疗胶质瘤的作用[31]。临床前研究[31]发现IDH突变胶质瘤细胞对PARPI敏感,同时PARPI也增加了胶质母细胞瘤对TMZ的敏感性。一些正在进行的I期和II期研究正在单独使用奥拉帕尼或与RT和化疗联合使用,以治疗复发性IDH突变型HGG(NCT03561870、NCT03212742、NCT01390571)。高甲基化状态是LGG胶质瘤的另一个靶点,IDH突变诱导的高甲基化是导致肿瘤进展的潜在机制[32]。地西他滨一种低甲基化剂,目前正在与西达唑胺(一种胞嘧啶脱氨酶抑制剂,可防止地西他滨在胃肠道降解)联合研究复发/进行性非增强型IDH突变型胶质瘤的I期试验(NCT03922555)。在临床前模型中有关其他药物的研究[33]显示,谷氨酰胺酶的抑制剂(CB-839)使IDH突变细胞对氧化应激更敏感。目前CB-839正在接受RT和TMZ辅助化疗的IDH突变星形细胞瘤患者中进行试验(NCT03528642)。
4.2 免疫治疗 鉴于免疫治疗在其他肿瘤中的显著疗效,针对LGG患者进行了大量临床前和临床试验,但目前取得的效果十分有限[34]。在一个涉及IDH1 R132H特异性疫苗的动物模型中,针对IDH突变的靶向疫苗产生了免疫反应并减缓肿瘤生长[3]。NOA-16是一项I期临床试验(NCT02454634),主要用来评估IDH1 R132H特异性疫苗在TMZ化疗期间用于32例新诊断的III级和IV级IDH突变胶质瘤患者的安全性和免疫源性。
研究表明接受过化疗的IDH突变LGG患者,大部分会进展为HGG。而目前程序性死亡配体1(PD-L1)免疫检查点抑制剂阿维鲁单抗与放疗相联合主要用于这类转化为IV级的IDH突变胶质瘤患者(NCT02968940)[35-36]。同时接受过化疗的 IDH 突变胶质瘤患者中,大部分会出现超突变表型 ,可能导致肿瘤中新抗原负荷增加,这也在理论上为LGG的免疫治疗提供了新思路。LGG患者手术、放疗、化疗、靶向及免疫治疗的方案以及结果见表 1。
表1 低级别胶质瘤治疗方案及结果Tab.1 Treatment plan and results of LGG
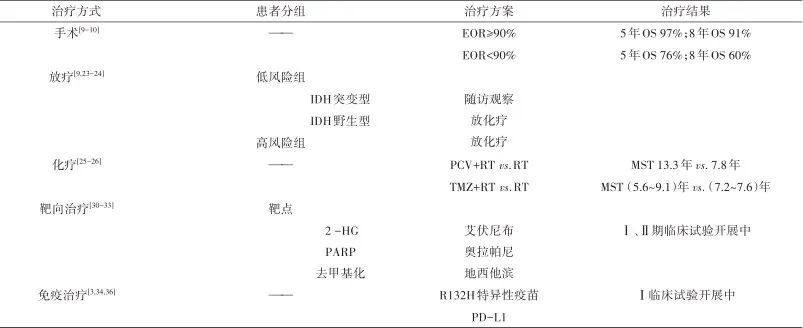
注:EOR,切除范围;IDH,异柠檬酸脱氢酶;RT,放疗;PCV,丙卡巴肼、洛莫司汀和长春新碱;TMZ,替莫唑胺;MST,中位生存期;2-HG,2-羟基戊二酸;PARP,聚腺苷酸二磷酸核糖聚合酶抑制剂;——,无。
5 总结与展望
LGG是起源于胶质细胞的原发性脑肿瘤,治疗后其总体预后相对较好,但绝大多数仍会复发,甚至进展为胶质母细胞瘤。目前最大限度的手术安全切除是初始治疗的标准方法(也有观点认为对iLGG患者早期安全手术切除的EOR更大,生存时间更长),然后再对高危患者(主要是年龄超过40岁和/或进行了次全切除的患者)及低危IDH野生型患者进行RT和化疗。PCV和TMZ联合RT都可提高患者生存率,但目前尚不清楚这两种方案是否等效,还需要等待 CODEL结果以及进一步的研究。靶向和免疫治疗或可为LGG胶质瘤的治疗提供新思路,但有效性和安全性需要有待进一步临床探索。因此,既要找到能延长患者生存期,又要在不良反应可接受范围内的最佳治疗方案还需进一步研究。
参考文献:
1. KOMORI T. Grading of adult diffuse gliomas according to the 2021 WHO Classification of Tumors of the Central Nervous System[J]. Lab Invest, 2022,102(2): 126-133.
2. LOUIS D N, PERRY A, WESSELING P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary[J]. Neuro Oncol, 2021, 23(8): 1231-1251.
3. YOUSSEF G, MILLER J J. Lower Grade Gliomas[J]. Curr Neurol Neurosci Rep, 2020,20(7): 21.
4. GOGOS A J, YOUNG J S, PEREIRA M P, et al. Surgical management of incidentally discovered low-grade gliomas[J]. J Neurosurg, 2020, 135(2): 480-487.
5. IUS T, NG S, YOUNG J S, et al. The benefit of early surgery on overall survival in incidental low-grade glioma patients: A multicenter study[J]. Neuro-Oncology, 2022,24(4): 624-638.
6. IUS T, CESSELLI D, ISOLA M, et al. Incidental Low-Grade Gliomas: Single-Institution Management Based on Clinical, Surgical, and Molecular Data[J]. Neurosurgery, 2020,86(3): 391-399.
7. OPOKU-DARKO M, EAGLES M E, CADIEUX M, et al. Natural History and Growth Patterns of Incidentally Discovered Diffusely Infiltrating Low-Grade Gliomas: A Volumetric Study[J]. World Neurosurg, 2019, 132: e133-e139.
8. BOETTO J, NG S, DUFFAU H. Predictive Evolution Factors of Incidentally Discovered Suspected Low-Grade Gliomas: Results From a Consecutive Series of 101 Patients[J]. Neurosurgery, 2021, 88(4): 797-803.
9. CHAMMAS M, SAADEH F, MAALIKI M, et al. Therapeutic Interventions in Adult Low-Grade Gliomas[J]. J Clin Neurol, 2019,15(1): 1-8.
10. SMITH J S, CHANG E F, LAMBORN K R, et al. Role of extent of rep in the long-term outcome of low-grade hemispheric gliomas[J]. J Clin Oncol, 2008, 26(8): 1338-1345.
11. KREATSOULAS D, DAMANTE M, GRUBER M, et al. Supratotal Surgical Rep for Low-Grade Glioma: A Systematic Review[J]. Cancers, 2023, 15(9): 2493.
12. ROSSI M, GAY L, AMBROGI F, et al. Association of supratotal rep with progression-free survival, malignant transformation, and overall survival in lower-grade gliomas[J]. Neuro Oncol, 2021, 23(5): 812-826.
13. VOGELBAUM M A. Balancing maximal rep and functional preservation in surgery for low-grade glioma[J]. Neuro-Oncology, 2022, 24(5): 794-795.
14. de LEEUW C N, VOGELBAUM M A. Supratotal rep in glioma: a systematic review[J]. Neuro Oncol, 2019,21(2): 179-188.
15. SOLIMAN M A, KHAN A, AZMY S, et al. Meta-analysis of overall survival and postoperative neurologic deficits after rep or biopsy of butterfly glioblastoma[J]. Neurosurg Rev, 2022,45(6): 3511-3521.
16. WIJNENGA M, FRENCH P J, DUBBINK H J, et al. The impact of surgery in molecularly defined low-grade glioma: an integrated clinical, radiological, and molecular analysis[J]. Neuro Oncol, 2018, 20(1): 103-112.
17. NIMSKY C, FUJITA A, GANSLANDT O, et al. Volumetric assessment of glioma removal by intraoperative high-field magnetic resonance imaging[J]. Neurosurgery, 2004, 55(2): 358-370, 370-371.
18. SHI J, ZHANG Y, YAO B, et al. Application of Multiparametric Intraoperative Ultrasound in Glioma Surgery[J]. Biomed Res Int, 2021,2021: 6651726.
19. 邬立, 陆斌, 赵蕾, 等. 多模态神经导航及术中超声在高级别胶质瘤手术中的应用[J]. 中国神经精神疾病杂志, 2022,48(8): 463-468.
20. EL B M, AGGAG M, KAMAL M. Role of intraoperative ultrasound in rep of pediatric brain tumors[J]. Childs Nerv Syst, 2010, 26(9): 1189-1193.
21. 丁晏, 程兴, 王世强, 等.荧火素钠辅助手术切除非小细胞肺癌脑转移瘤[J].中国神经精神疾病杂志, 2023, 49(3): 129-135.
22. DUFFAU H. Is non-awake surgery for supratentorial adult low-grade glioma treatment still feasible?[J]. Neurosurg Rev, 2018,41(1): 133-139.
23. OBERHEIM B N, CHANG S. Treatment Strategies for Low-Grade Glioma in Adults[J]. J Oncol Pract, 2016,12(12): 1235-1241.
24. 李田源, 董秉琪, 吴慧. 成人新诊断高危低级别胶质瘤术后治疗的现状及争议[J]. 中国肿瘤临床, 2021,48(9): 478-482.
25. BUCKNER J C, CHAKRAVARTI A, CURRAN W J. Radiation plus Chemotherapy in Low-Grade Glioma[J]. N Engl J Med, 2016, 375(5): 490-491.
26. FISHER B J, PUGH S L, MACDONALD D R, et al. Phase 2 Study of a Temozolomide-Based Chemoradiation Therapy Regimen for High-Risk, Low-Grade Gliomas: Long-Term Results of Radiation Therapy Oncology Group 0424[J]. Int J Radiat Oncol Biol Phys, 2020, 107(4): 720-725.
27. MCDUFF S G R, DIETRICH J, ATKINS K M, et al. Radiation and chemotherapy for high‐risk lower grade gliomas: Choosing between temozolomide and PCV[J]. Cancer Medicine, 2020,9(1): 3-11.
28. 王文岩, 薛晓英. 2020年低级别脑胶质瘤诊疗指南解读[J]. 河北医科大学学报, 2020, 41(9): 993-998.
29. FARSHIDFAR F, ZHENG S, GINGRAS M C, et al. Integrative Genomic Analysis of Cholangiocarcinoma Identifies Distinct IDH-Mutant Molecular Profiles[J]. Cell Rep, 2017,18(11): 2780-2794.
30. FAN B, MELLINGHOFF I K, WEN P Y, et al. Clinical pharmacokinetics and pharmacodynamics of ivosidenib, an oral, targeted inhibitor of mutant IDH1, in patients with advanced solid tumors[J]. Invest New Drugs, 2020, 38(2): 433-444.
31. SULKOWSKI P L, CORSO C D, ROBINSON N D, et al. 2-Hydroxyglutarate produced by neomorphic IDH mutations suppresses homologous recombination and induces PARP inhibitor sensitivity[J]. Sci Transl Med, 2017, 9(375): eaal2463.
32. FLAVAHAN W A, DRIER Y, LIAU B B, et al. Insulator dysfunction and oncogene activation in IDH mutant gliomas[J]. Nature, 2016, 529(7584): 110-114.
33. MCBRAYER S K, MAYERS J R, DINATALE G J, et al. Transaminase Inhibition by 2-Hydroxyglutarate Impairs Glutamate Biosynthesis and Redox Homeostasis in Glioma[J]. Cell, 2018,175(1): 101-116.
34. HADDAD A F, YOUNG J S, OH J Y, et al. The immunology of low-grade gliomas[J]. Neurosurgical Focus, 2022, 52(2): E2.
35. BARTHEL F P, JOHNSON K C, VARN F S, et al. Longitudinal molecular trajectories of diffuse glioma in adults[J]. Nature, 2019,576(7785): 112-120.
36. JONSSON P, LIN A L, YOUNG R J, et al. Genomic Correlates of Disease Progression and Treatment Response in Prospectively Characterized Gliomas[J]. Clin Cancer Res, 2019,25(18): 5537-5547.
【引用格式】郭鹏航,谢东,赵全堂,等 . 低级别胶质瘤临床治疗进展[J]. 中国神经精神疾病杂志,2024,50(5):310-314.
【Cite this article】GUO P ,XIE D,ZHAO Q T,et al. Progress in clinical treatment of low-grade gliomas[J]. Chin J Nervous Mental Dis,2024,50(5):310-314.
DOI:10.3969/j.issn.1002-0152.2024.05.011


