Adv Sci:上海大学陈雨/余美花/谢雨洁合作报道对肿瘤抗原特异性免疫的高度多样化和能力的2D纳米片癌症疫苗
时间:2024-09-08 06:05:23 热度:37.1℃ 作者:网络
疫苗在临床上治疗癌症的治疗效果仍然有限。
2024年9月3日,上海大学陈雨、余美花、谢雨洁共同通讯在Advanced Science 在线发表题为“2D Differential Metallic Immunopotentiators Drive High Diversity and Capability of Antigen-specific Immunity Against Tumor”的研究论文。该研究报道了一种合理设计的癌症疫苗,该疫苗将免疫原性差异化且临床认可的铝(Al)或锰(Mn)与抗原一起放置在2D纳米片(NS)结构中。
结构最优的NS具有高Mn/Al摩尔比(MANS-H)具有独特的免疫调节作用,显着促进注射部位异质先天免疫细胞的流入。刺激多种树突状细胞(DC)亚群可显着提高抗原特异性T细胞的水平、亚型和功能。MANS-H通过启动T辅助(Th)2细胞而不是T滤泡辅助(Tfh)细胞,在产生抗原特异性抗体方面表现出比商业佐剂(Alhydrogel)更高的效率。除了体液免疫之外,MANS-H还能引发高频率的抗原特异性Th1和CD8+细胞免疫,与广泛用于兽医疫苗的Quil-A相当。使用MANS-H佐剂疫苗进行免疫的小鼠通过促进效应T细胞浸润肿瘤并克服多种高度侵袭性肿瘤模型中的肿瘤耐药性,在肿瘤消退中发挥强大效力。这种具有有趣NS结构和安全免疫增强剂的工程免疫原为癌症免疫治疗带来了下一个临床进展。

新型疫苗的突破性发展可以挽救数百万人的生命,其中佐剂是疫苗制剂中必不可少的成分,可利用宿主对抗原的免疫反应,显著提高免疫反应的强度、持续时间和有效性。尽管佐剂(例如1926年首次使用的铝盐)在人类疫苗中的使用已有100多年的历史,但迄今为止,只有少数佐剂在临床许可的疫苗中获得批准。许多含有不同免疫刺激剂的创新佐剂平台正在进行爆炸式探索,以补充传统佐剂,因为传统佐剂很难针对多种难以预防或治愈的疾病引发适当的免疫反应,例如癌症、艾滋病毒(人类免疫缺陷病毒)和疟疾。
对佐剂作用机制的理解具有重要意义,它为佐剂开发和疫苗学的进步奠定了基础。已知含铝佐剂能产生强大的抗体反应和T辅助细胞2(Th2)细胞反应,但细胞免疫力有限。尽管如此,细胞免疫反应,特别是CD8+T细胞,是消除病毒感染细胞或突变癌细胞的关键介质。为了了解免疫系统如何感知和响应含铝佐剂,已经提出了几种流行的机制,但存在争议。
1931年Glenny及其同事提出的“储库理论”表明铝盐介导注射部位的持续抗原释放,延长了免疫系统的刺激。最近的研究强调了先天免疫细胞在启动适应性免疫反应中的关键作用,其中PollyMatzinger于1994年提出了“危险假说”。它表明铝盐颗粒引起的组织损伤导致细胞死亡,从而释放危险信号,最终引起先天免疫细胞和淋巴细胞的激活。最近,Veit Hornung及其同事观察到,吞噬颗粒铝盐会引发炎症小体激活,从而调节其免疫原性。要从细胞和分子水平上充分了解含铝佐剂的作用机制,仍需付出巨大努力。
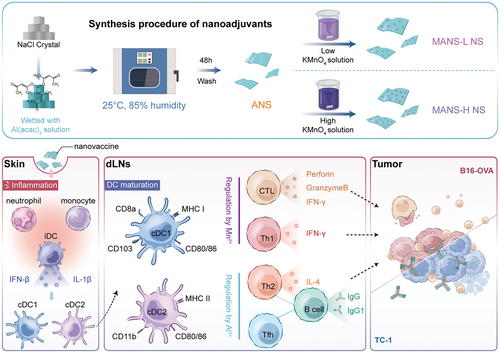
免疫原性不同的Mn和Al的NS佐剂的制备过程示意图(图源自Advanced Science )
另一种在免疫调节中被深入研究的化学元素是锰。江等人的开创性工作首次发现,锰离子对于宿主通过环状鸟苷酸-腺苷酸合酶(cGAS)感知细胞浆双链DNA(dsDNA)并触发下游干扰素基因刺激因子(STING)信号传导以抵抗病毒感染是必不可少的。令人惊讶的是,锰离子被发现是一种有效的免疫刺激剂,它以cGAS独立的方式直接激活STING-I型干扰素(IFNs)通路。锰离子的佐剂活性因其物理形式而异。研究发现,锰盐的胶体形式,而不是可溶性游离离子,能有效刺激NLR家族吡啶结构域3(NLRP3)-凋亡相关斑点样蛋白,该蛋白含有C端caspase募集结构域(ASC)炎症通路。这种激活增强了佐剂的效力,与锰-STING信号相结合,产生强大的细胞和体液免疫反应。
这些发现对于支持锰盐在癌症免疫治疗中的临床研究具有重要意义,激发了人们对开发先进锰基佐剂的巨大研究兴趣。除无机佐剂外,针对其他模式识别受体(PRR)的小分子佐剂的最新进展,例如Toll样受体(TLR)7/8激动剂、环二核苷酸(CDN)和MSA-2的STING激动剂,揭示了这些免疫刺激剂在微米或纳米颗粒中的配方的重要性,这显著增强了免疫原性,降低了免疫毒性,并改变了它们在组织特异性先天免疫细胞(例如引流淋巴结(dLN)驻留的树突状细胞和肿瘤浸润单核细胞)中的药物生物分布。薄层2D纳米片(NS)免疫刺激剂配方在技术上令人着迷,它通过提供高表面积与体积比和增强的纳米免疫相互作用,为癌症免疫治疗带来了前所未有的进步。然而,放置在NS结构中的免疫原性差异铝或锰的异质性如何影响癌症疫苗接种中先天和适应性免疫的协调仍未得到探索。
在这里,作者报告了具有不同铝锰摩尔比的2DNS佐剂的构建(图1顶部面板),并探索了它们在癌症疫苗中的佐剂活性和作用机制。结果表明,具有高锰铝比的双金属NS佐剂(MANS-H)显着触发了注射后皮肤上异质先天免疫细胞亚群的募集,例如促炎性巨噬细胞、单核细胞和中性粒细胞(图1底部面板)。MANS-H在增强抗原摄取和激活不同亚群的树突状细胞方面表现出色,包括1型常规树突状细胞(cDC1、CD103+迁移树突状细胞和CD8+驻留树突状细胞)、2型常规树突状细胞(cDC2、CD11b+树突状细胞)和朗格汉斯细胞(LC),这是通过刺激STING-I型IFN和白细胞介素-1β(IL-1β)炎症途径实现的。
从机制上讲,Mn在启动抗原特异性IL-4+CD4+Th2、IFN-γ+CD4+Th1和多功能CD8+T细胞方面表现出显著更高的效果,这些细胞进一步发展为记忆表型。相比之下,Al则表现出激发CXCR5+CD4+Tfh和抗体产生的效力。接种MANS-H佐剂疫苗的小鼠表现出显著的肿瘤抑制作用,其方式是促进具有不同活化表型的肿瘤浸润CD8+细胞和细胞毒性自然杀伤(NK)细胞的频率,同时抑制肿瘤部位的抑制性先天免疫细胞和CD4+Foxp3+ Treg。MANS-H与肿瘤相关或特异性抗原结合的强效治疗效果在侵袭性小鼠癌症模型中得到验证,表明双金属氧化物NS佐剂癌症疫苗免疫疗法在增强临床疗效方面具有巨大潜力。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202405729


