病例报告|新型冠状病毒感染相关急性坏死性脑病1例
时间:2024-09-01 15:01:21 热度:37.1℃ 作者:网络
摘 要 报告1例成人新型冠状病毒感染相关的急性坏死性脑病(COVID-19-associated acute necrotizing encephalopathy,ANEC)病例。患者在新型冠状病毒感染后12 d出现意识障碍、癫痫发作,脑MRI上显示双侧丘脑、脑干、小脑半球为主的信号改变,与急性坏死性脑病(acute necrotizing encephalitis,ANE)特征性影像表现一致。早期给予甲泼尼龙冲击联合大剂量人免疫球蛋白治疗,但患者一直处于持续昏迷状态并最终死亡。ANEC往往起病急,进展快,以意识障碍、癫痫等为主要表现,影像学丘脑及幕下对称性、多灶性病灶对诊断具有特异性,但治疗及预后仍面临挑战,需要深入研究。
关键词 新型冠状病毒;急性坏死性脑病;新型冠状病毒感染相关急性坏死性脑病;意识障碍;癫痫;丘脑病变;预后
急性坏死性脑病(acute necrotizing encephalopathy,ANE)是一组与病毒感染及疫苗注射相关的,以意识障碍、抽搐等为主要表现,且具有相似脑影像学特征的临床综合征[1]。其发病机制与感染等继发人体免疫反应增强及炎性因子风暴有关,部分患者具有一定基因易感性[2]。近年来,随着新型冠状病毒的流行,其引发的ANE逐渐被发现并报告,但由于临床较为罕见,其疾病轮廓尚不清晰。本文报告1例新型冠状病毒感染相关ANE(COVID-19-associated acute necrotizing encephalopathy,ANEC)的诊治并结合文献对其流行病学、发病机制、临床特征及诊治、预后进行分析、总结以提高临床认识。
1 临床资料
患者,女,74岁,因“间断发热12 d余,意识障碍2 d”于2023年6月7日入住。5月25日患者出现发热,最高体温38℃,伴咳嗽,1周后 “新冠病毒核酸咽拭子检测”阳性。次日患者突发烦躁、胡言乱语及肢体抽搐。6月5日患者症状加重,出现意识不清,遂入住宁夏医科大学总医院神经重症监护室。查体:浅昏迷,双侧瞳孔直径2 mm,对光反射灵敏,疼痛刺激四肢无明显活动,双侧巴氏征阴性,查氏征阳性,颈无抵抗。颅脑磁共振检查示双侧脑室旁、丘脑、海马、脑干及小脑半球对称性长T1、长T2及T2 Flair、DWI高信号(图1)。胸部CT示双肺间质性改变并肺气肿。新型冠状病毒核酸阳性。血常规:白细胞计数 12.06×109/L(正常值:3.5×109~9.5×109/L),中性粒细胞相对值85.7%(正常值:40% ~75%)。血白介素-6(IL-6)24.50 pg/mL(正常值:≤7 pg/mL)。腰穿示脑压120 mmH2O(正常值:80 ~180 mmH2O)。脑脊液白细胞2个/mm3(正常值:0 ~8个/mm3)。脑脊液蛋白1.9 g/L(正常值:0.12 ~0.6 g/L),糖5.8 mmol/L (正常值:2.2~3.9 mmol/L),氯化物133 mmol/L(正常值:120~130 mmol/L)。脑电图:中度异常脑电监测,昏迷期背景慢波改变。明确诊断“新型冠状病毒感染,ANEC”,并给予甲泼尼龙琥珀酸钠500 mg/d冲击治疗及大剂量人免疫球蛋白治疗。治疗13 d后患者仍持续昏迷,自主呼吸弱,四肢无自主活动,家属遂放弃治疗,离院后死亡。基因测序未发现RANBP2基因突变。
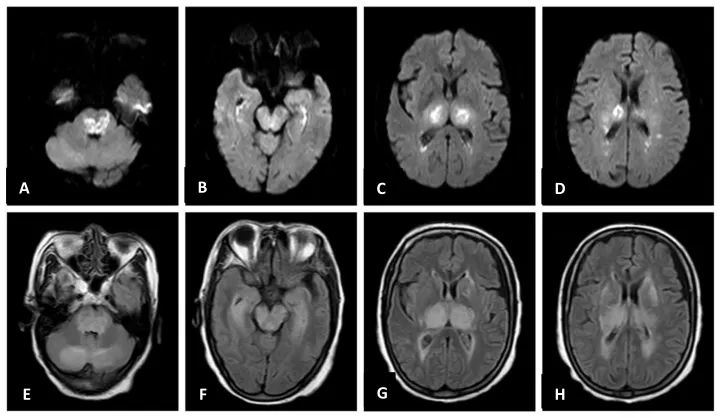
图1 患者脑磁共振,入院当日显示双侧小脑、脑干、丘脑及内侧颞叶、侧脑室后角旁等部位多发性异常信号 A~D:DWI序列显示病灶弥散受限。E~H:T2 Flair序列显示了较DWI更大范围的异常信号。Fig.1 Brain MRI of the patient, showed multiple abnormal signals in the bilateral cerebellum, brainstem, thalamus, medial temporal lobe, and posterior Angle of lateral ventricle on admission
2 讨论
ANE是一种罕见的快速进展性脑病,常发生在急性病毒感染,如甲型或乙型流感病毒、人类疱疹病毒6型、轮状病毒等感染的儿童中,成人相对少见。近年来,随着新型冠状病毒的暴发流行,ANEC逐渐受到医学界的关注。2020年POYIADJI N等[3]首次报道1例女性患者,其在感染新型冠状病毒后出现精神症状,颅脑MRI显示双侧丘脑和内侧颞叶对称性T2 Flair高信号,该患者被诊断为ANEC。但至今,ANEC仍多以个案报道出现,发病率尚不清楚,国内目前报道较少,原因考虑与其本身发病率较低有关,同时不排除临床漏诊情况的存在。
新型冠状病毒感染可引起多种严重的神经系统并发症,包括卒中、癫痫发作、自身免疫性疾病和脑病等,其机制包括病毒直接侵袭、免疫失调、低氧血症、血栓形成、多器官功能障碍和细胞因子风暴等[4],其中ANEC普遍被认为是由新型冠状病毒感染后引发的细胞因子风暴引发,升高的促炎细胞因子导致构成血脑屏障的蛋白水解性破坏被认为是ANE的核心发病机制,而非病原体直接入侵所致[5]。所以有学者认为 ANEC是一种副感染性神经系统并发症,可称为“第三脑炎”[6]。本文中患者脑脊液白细胞数未升高,也进一步支持了ANEC非病毒侵入中枢神经系统所导致的发病机制推测。
基因易感性被认为是新型冠状病毒感染后引发ANE的关键因素。研究发现,RANBP2基因的错义突变与家族性急性坏死性脑病(familial acute necrotic encephalopathy,ANE1)密切相关[7]。RANBP2基因定位于染色体2q13,编码RAN结合蛋白2核孔成分,在神经元代谢中起重要作用[8],其突变可在病毒感染时引发细胞因子风暴、血脑屏障破坏和氧化损伤[9],但还需环境因素作用才能致病[10]。本报道中患者基因检测未发现RANBP2基因突变,提示患者发病原因的异质性。
ANEC临床主要表现为发热、头痛、癫痫、精神状态及神志改变,部分患者可伴有局灶性神经功能缺损,其进展迅速,症状常出现在病毒感染后的12~72 h,也可在1周后出现[11]。本例在新冠感染12 d以后首先出现精神异常,随后出现抽搐、意识障碍等神经系统表现,起病急速且进展迅猛,短时间内即达到危重状态,以持续性意识障碍为突出表现,与文献报道的大多数病例一致[12]。严重的意识障碍考虑与患者双侧丘脑及脑干病变导致上行网状激活系统受损有关。
影像学对于ANE的诊断具有较高价值。较为对称的多灶性小脑、脑干及丘脑损伤是ANE最经典的影像表现。其中头颅磁共振表观弥散系数(apparent diffusion coefficient,ADC)上出现丘脑三层现象(trilaminar appearance,TA)是其特征性表现[13]。尸体病理研究证实 TA 分别代表 :外层为血管性水肿(ADC高信号);中层细胞毒性水肿(ADC 低信号);内层出血或坏死(ADC高信号)[14]。也有岛叶发现TA现象的报道[10]。本患者具有典型的ANEC影像学特征:颅脑磁共振可见双侧丘脑为主并累及小脑、脑干、基底节、颞叶、侧脑室旁及半卵圆中心的多发对称性长T1、长T2及T2 Flair、DWI高信号。尽管未能完成ADC检测,但患者在发病10 d后复查脑CT发现丘脑坏死性低密度病灶及灶性疑似出血性高密度病灶,与TA十分吻合。
研究发现,早期人免疫球蛋白、血浆置换和糖皮质激素冲击等治疗对ANE患者具有一定疗效[15],但由于发病急骤,发展迅速,即使治疗,ANE死亡率仍可达30%,幸存者也往往遗留严重和持续的神经系统后遗症[5],而ANEC则更加凶险,死亡率可达到53.3%[12]。本例在早期即给予大剂量激素冲击,并同时联合大剂量人免疫球蛋白治疗,但仍旧结局不良。目前,对于ANEC的治疗仍存在很多疑问,如激素治疗的最佳剂量、最佳时间和持续时间等,需更深入地研究。有报道称托珠单抗可通过抑制上游IL -6介导的促炎级联及其对应物来降低ANE的风险[16]。患者在住院期间IL-6持续性升高,但由于经济原因,家属未能同意使用托珠单抗治疗,从而我们没有机会观察并评估IL-6抑制剂在重症ANEC治疗中的疗效。
综上,本文报道1例新型冠状病毒感染后出现严重意识障碍及癫痫发作,影像学显示双侧丘脑、小脑半球及脑干对称性病灶,经大剂量甲泼尼龙冲击治疗及联合人免疫球蛋白冲击治疗,病情仍短期内恶化并最终死亡的ANEC患者。该患者的诊治提示我们,ANEC虽较为罕见,但其症状及影像均具有一定特异性,临床遇到类似患者应注意及时识别,避免延误诊断。此外,患者虽经过积极治疗未能逆转病情,但现有研究提示细胞因子风暴为核心致病机制,故免疫治疗对于ANEC患者具有一定疗效,对于ANEC患者仍应早期积极予以免疫调节治疗,以努力降低其致死、致残率。
参考文献:
1. 孙皓晨,王晓银,沙瑞娟. 成人急性坏死性脑病2例[J]. 中国神经精神疾病杂志, 2022, 48(9): 544-548.
2. PALAZZO A F, JOSEPH J, LIM M, et al. Workshop on RanBP2/Nup358 and acute necrotizing encephalopathy[J]. Nucleus, 2022, 13(1): 154-169.
3. POYIADJI N, SHAHIN G, NOUJAIM D, et al. COVID-19-associated Acute Hemorrhagic Necrotizing Encephalopathy: Imaging Features[J]. Radiology, 2020, 296(2): E119-E120.
4. NAJJAR S, NAJJAR A, CHONG D J, et al. Central nervous system complications associated with SARS-CoV-2 infection: integrative concepts of pathophysiology and case reports[J]. J Neuroinflammation, 2020, 17(1): 231.
5. WU X, WU W, PAN W, et al. Acute necrotizing encephalopathy: an underrecognized clinicoradiologic disorder[J]. Mediators Inflamm, 2015, 2015: 792578.
6. 关鸿志. 病毒性脑炎的诊治[J]. 中华神经科杂志, 2022, 55(7): 747-754.
7. NEILSON D E, ADAMS M D, ORR C M, et al. Infection-triggered familial or recurrent cases of acute necrotizing encephalopathy caused by mutations in a component of the nuclear pore, RANBP2[J]. Am J Hum Genet, 2009, 84(1): 44-51.
8. JIANG J, WANG Y E, PALAZZO A F, et al. Roles of Nucleoporin RanBP2/Nup358 in Acute Necrotizing Encephalopathy Type 1 (ANE1) and Viral Infection[J]. Int J Mol Sci, 2022, 23(7):3548.
9. LEVINE J M, AHSAN N, HO E, et al. Genetic Acute Necrotizing Encephalopathy Associated with RANBP2: Clinical and Therapeutic Implications in Pediatrics[J]. Mult Scler Relat Disord, 2020, 43: 102194.
10. 田茂强, 彭龙英, 刘书邑, 等. 伴岛叶三层现象的急性坏死性脑病一家系临床及遗传学分析[J]. 临床儿科杂志, 2021, 39(10): 771-774.
11. CIOLAC D, CRIVORUCICA I, ZOTA E, et al. Extensive cerebellar involvement and cognitive impairment in COVID-19-associated acute necrotizing encephalopathy[J]. Ther Adv Neurol Disord, 2021, 14: 1756286420985175.
12. KARAMI S, KHALAJ F, SOTOUDEH H, et al. Acute Necrotizing Encephalopathy in Adult Patients With COVID-19: A Systematic Review of Case Reports and Case Series[J]. J Clin Neurol, 2023, 19(6): 597-611.
13. BISWAS A, VARMAN M, GUNTURI A, et al. Teaching NeuroImages: Acute necrotizing encephalopathy of childhood: Neuroimaging findings[J]. Neurology, 2018, 90(2): e177-e178.
14. MIZUGUCHI M, HAYASHI M, NAKANO I, et al. Concentric structure of thalamic lesions in acute necrotizing encephalopathy[J]. Neuroradiology, 2002, 44(6): 489-493.
15. QIN N, WANG J, PENG X, et al. Pathogenesis and Management of Acute Necrotizing Encephalopathy[J]. Expert Rev Neurother, 2023, 23(7): 641-650.
16. FARHADIAN S F, SEILHEAN D, SPUDICH S. Neuropathogenesis of acute coronavirus disease 2019[J]. Curr Opin Neurol, 2021, 34(3): 417-422.


