Nature Genetics:序列特征与药物疗效的巧妙结合:无义突变治疗的未来
时间:2024-08-28 18:02:24 热度:37.1℃ 作者:网络
引言
过早终止密码子(Premature Termination Codons, PTCs)是在编码序列中由于碱基突变引发的非正常终止信号,导致翻译过程提前结束,生成截短的、功能丧失的蛋白质。大约10%到20%的遗传性疾病与PTCs相关,这类突变还在肿瘤抑制基因的失活中起着关键作用。例如,常见的囊性纤维化(Cystic Fibrosis)和杜氏肌营养不良症(Duchenne Muscular Dystrophy)中,PTCs都与疾病的发病机制息息相关。此外,PTCs不仅导致不完全蛋白质的合成,还通过无义介导的mRNA降解(nonsense-mediated mRNA decay, NMD)进一步减少截短蛋白质的产生,从而加剧疾病的症状。
现今的研究表明,通过翻译贯通(translational readthrough)的策略,有可能缓解PTCs带来的负面效应。翻译贯通指的是小分子药物通过促进近似密码子的tRNA替代终止因子(translation termination factors),从而绕过PTCs,继续翻译出全长蛋白质。尽管在动物模型中已经显示出部分药物的疗效,但在不同疾病基因的临床应用中,药物诱导的贯通效率存在显著差异,特别是某些PTCs的响应性较差,极大限制了这些疗法的实际应用。
为了应对这一挑战,8月22日Nature Genetics的研究报道“Genome-scale quantification and prediction of pathogenic stop codon readthrough by small molecules”,通过深度突变扫描(Deep Mutational Scanning, DMS)的方法,系统性地量化了八种小分子药物对约5800个人类病理性PTCs的贯通效果。研究发现,不同药物对于不同PTCs的作用效果与局部序列环境密切相关。基于这些数据,研究者们构建了可解释的预测模型,能够准确预测药物在全基因组范围内诱导的贯通效率。通过对内源性终止密码子贯通的定量分析验证了这些模型的准确性,为将来设计临床试验和开发个性化无义突变抑制疗法(nonsense suppression therapies)提供了理论支持和实践指南。

过早终止密码子(Premature Termination Codons, PTCs)是由于基因突变导致的提前翻译终止现象,通常引发蛋白质合成不完全,导致遗传性疾病或肿瘤抑制基因失活。PTCs导致的蛋白质截短效应还会激活无义介导的mRNA降解(Nonsense-Mediated Decay, NMD),进一步减少蛋白表达,导致病理性影响。近年来,研究人员试图通过促进翻译贯通(Translational Readthrough)的方法来应对PTCs带来的不良影响。该方法通过小分子药物诱导翻译跳过PTCs,生成全长蛋白质,减少或逆转遗传性疾病的症状。然而,不同的PTCs对不同的药物反应存在差异,因此开发精准的治疗策略仍然面临挑战。
该研究的目的是通过深度突变扫描(Deep Mutational Scanning, DMS)技术,对5800多个人类病理性PTCs的翻译贯通效率进行量化,并评估八种不同的小分子药物在这些PTCs上的效果。研究者希望通过大规模的数据,构建能够预测全基因组范围内药物诱导PTC翻译贯通效果的模型,为未来的个性化无义突变抑制疗法(Nonsense Suppression Therapy)提供理论支持和实践参考。
构建PTC库:研究团队从ClinVar、TCGA和MSK-IMPACT数据库中收集了3498个与孟德尔疾病相关的PTCs和2372个癌症相关的PTCs。每个PTC包含其周围144个核苷酸序列,以确保准确的上下游分析 。
双荧光报告系统:研究者将这些PTC克隆至双荧光蛋白报告系统中,该系统通过EGFP和mCherry两个荧光蛋白的表达检测翻译贯通效率。具体而言,EGFP用于控制表达水平,而mCherry则用于检测贯通效应 。
药物处理:研究中使用了八种小分子药物,包括CC90009、clitocine、2,6-二氨基嘌呤(DAP)、庆大霉素(Gentamicin)、G418、SJ6986、SRI-41315和5-氟尿嘧啶(FUr)。这些药物覆盖了不同的分子机制,代表了多种促进翻译贯通的途径 。
细胞实验:通过将PTCs整合到HEK293T细胞系中,研究者对每种药物进行不同浓度的处理,并结合流式细胞术和Illumina测序技术,对各个PTC的贯通效率进行量化分析 。
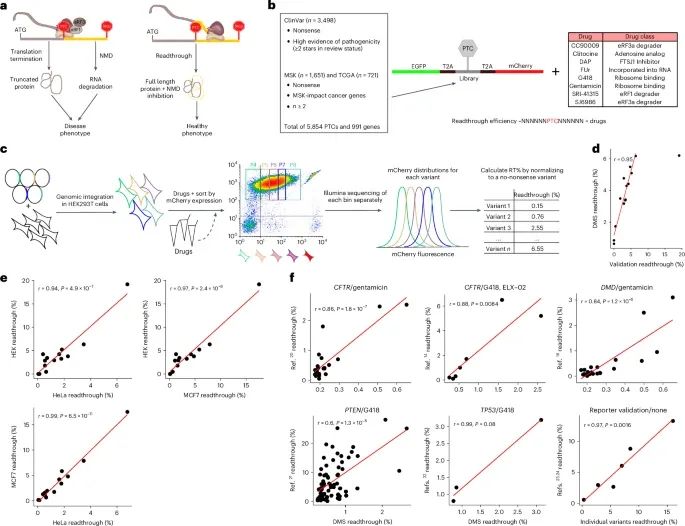
定量分析致病性PTC的翻译贯通(Credit: Nature Genetics)
通过翻译贯通促进全长蛋白质合成:翻译贯通的基本原理(图a),小分子药物可以通过促进核糖体绕过过早终止密码子(PTCs),使其继续翻译,从而生成全长蛋白质。通常,PTCs会激活无义介导的mRNA降解(NMD),阻止蛋白质的进一步合成,而药物的贯通则有助于缓解这种效应。
实验设计 (图b):PTCs来源:从ClinVar、TCGA和MSK-IMPACT等数据库中收集了5,871个与孟德尔疾病和癌症相关的PTC变异。报告系统:实验采用了双荧光蛋白报告系统,其中EGFP用于控制表达,而mCherry用于报告翻译贯通的发生。细胞系:将这些PTC变异整合至HEK293T细胞基因组中,确保每个细胞系只表达一个PTC。测试药物:实验中使用了8种不同的小分子药物,每种药物都已知能够通过不同机制诱导翻译贯通。
荧光分选-测序流程 (图c):通过流式细胞术分选并结合测序技术,量化药物诱导的翻译贯通效果。每个表达特定PTC变异的细胞根据其mCherry荧光信号进行分选,并通过测序分析每种药物在不同PTCs上的贯通效率。
贯通测量的相关性 (图d):对于15个特定变异在SRI药物处理下的个体贯通测量和深度突变扫描(DMS)结果的相关性,相关系数达到r = 0.95,显示出高通量DMS实验的可靠性。
跨细胞系的验证 (图e):将这15个PTCs的贯通效率在其他细胞系(MCF7和HeLa)中的表现与HEK293T细胞系进行对比,结果显示高Pearson相关系数(r = 0.94 至 r = 0.99),表明贯通效果在不同细胞系中具有一致性。
与其他研究的比较 (图f):将本研究的DMS结果与之前已发表的贯通数据进行了比较,相关系数在r = 0.56 到 r = 0.94之间,验证了实验方法的准确性和结果的可重复性。
药物对PTC的影响差异
研究显示,八种药物在不同的PTCs上表现出显著不同的贯通效率。例如,SJ6986和DAP在某些PTCs上的贯通率较高,而庆大霉素在多个PTCs上的贯通效果较弱。总体而言,药物诱导的贯通率从0.08%(庆大霉素)到1.32%(SJ6986)不等 。
SJ6986和DAP表现出的高效贯通
研究显示,在所有评估的PTCs中,SJ6986和2,6-DAP表现出相对较高的贯通效率。具体来说,这两种药物在多个PTCs上的平均贯通率可以达到1.32%,这表明它们在诱导特定PTCs跳过终止信号时具有较强的作用。高效的贯通意味着这些药物能够在较大程度上克服PTC对蛋白质合成的阻断作用,产生更多完整的蛋白质。这使得它们成为未来无义突变抑制疗法(nonsense suppression therapies)的潜在候选药物。
庆大霉素和G418效果较弱
相比之下,庆大霉素和G418在多个PTCs上的贯通效果较弱。数据显示,庆大霉素的平均贯通率仅为0.08%,而G418也未能在大多数PTCs上取得明显的贯通效果。这一结果与庆大霉素和G418的作用机制有关。庆大霉素虽然是一种常用的抗生素,但其在促进翻译贯通方面的能力有限,可能是因为其作用机制更适用于细菌核糖体而非哺乳动物核糖体。
药物作用的显著差异
这种药物效果的显著差异提示,单一药物难以有效覆盖所有疾病相关的PTCs。SJ6986和2,6-DAP可能适用于某些特定类型的PTCs,但对其他PTCs则效果有限。另一方面,庆大霉素和G418虽然在实验中效果较弱,但在某些细菌感染的治疗中有其独特的作用。这意味着,在开发无义突变抑制疗法时,不能依赖单一药物,而是需要根据患者的具体PTC突变类型选择合适的药物组合,才能确保临床疗效。
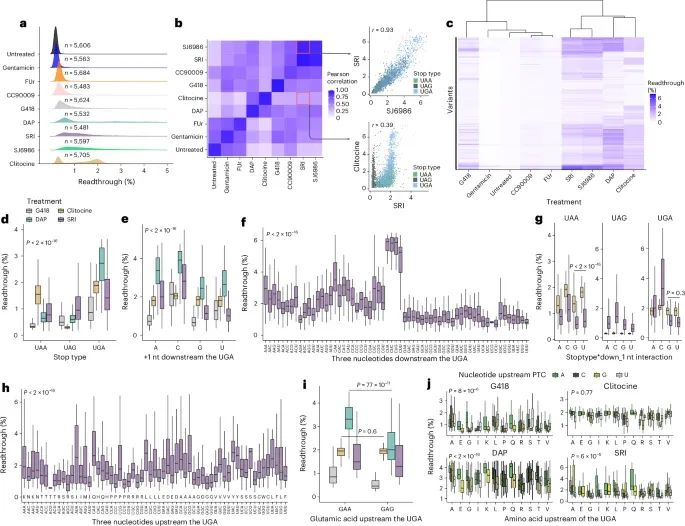
序列特征解释了不同PTCs和药物的贯通差异(Credit: Nature Genetics)
药物诱导贯通的广泛变化 (图a):不同药物在诱导翻译贯通时的效果分布。研究评估了每种药物在数千种PTC变异中的贯通率,并展示了这些药物在实验中恢复的高置信度变异的数量(读数≥10),以及对应的贯通百分比。
药物间的相关性 (图b):不同药物在诱导PTC贯通时的相关性。某些药物之间的贯通效果相关性较高,例如SRI和SJ6986,它们对相同的PTCs表现出高度相关的贯通率(相关系数r = 0.93)。然而,其他药物之间的相关性较低,例如SRI与Clitocine的相关性仅为r = 0.39,这表明尽管它们都能诱导贯通,但它们对不同PTCs的作用机制和效果存在显著差异。
序列特征对贯通效率的影响 (图c-j):研究发现,PTC下游序列(+1、+2、+3位碱基)对药物诱导的贯通有显著影响。例如,+1位为C(胞嘧啶)时,大多数药物表现出最高的贯通效率(s41588-024-01878-5)。
不同类型PTC终止密码子(UGA、UAG、UAA)对贯通效率的影响。数据显示,UGA型PTC通常具有最高的贯通率(P < 2×10⁻¹⁶,Kruskal-Wallis检验)(图d)。
+1位碱基对贯通效率的影响显示,C碱基显著提高了所有药物的贯通效率(P < 2×10⁻¹⁶),这表明+1位序列的碱基类型是决定药物作用效果的重要因素(图e)。
+2和+3位碱基的影响则因药物而异。某些药物在+2位为A时表现出较高的贯通效率,而另一些药物在+3位为C时效果更佳(图f)。
对于不同类型的PTCs,+1位碱基的效果也不同。例如,Clitocine在UAA类型的PTC下表现出U > G的序列偏好,而在UGA类型的PTC下则无明显差异(P = 0.3)(图g)。
上游序列的碱基和氨基酸残基对药物的贯通效率也有显著影响。例如,GAA型前导氨基酸的PTCs在DAP处理下表现出显著的贯通提升,而Clitocine对其几乎无效(P = 7×10⁻¹¹)(图h-i)。
在所有药物中,末尾为A的三联密码子表现出更高的贯通效率,尤其是在DAP、G418和SRI处理下,这些A结尾的密码子比其他密码子高出1.1至1.3倍的贯通率(P < 6×10⁻⁵)(图j)。
序列上下游的影响
PTC下游序列的影响
PTC后的+1、+2和+3位核苷酸在不同药物诱导的贯通过程中表现出显著的差异性。研究表明,+1位碱基对于贯通效率具有至关重要的影响,尤其是胞嘧啶(Cytosine,C)作为+1位时,在几乎所有药物下均表现出最高的贯通效率。例如,在使用DAP和SRI时,+1位为C的PTCs贯通率比其他碱基类型高出4.65倍和1.64倍。+2和+3位的核苷酸同样对贯通效率有影响,但药物之间的表现有所不同。比如,SJ6986在+1位为C的PTCs上表现出较高的贯通率,而其他药物则在+2或+3位的不同碱基条件下效果更佳。
不同药物在不同PTC上的表现
不同药物在不同类型PTC上的表现也不同。研究中,G418和SRI对UGA类型的PTCs贯通效果最好,而对UAG和UAA的效果相对较弱。对于DAP而言,UGA PTCs的贯通率是UAG的2倍以上,远超其他PTCs。类似地,SRI对UGA的效果优于其他两类PTCs,而Clitocine在UAA PTCs上效果较好。研究表明药物对不同类型PTCs的反应性存在显著差异,需要根据具体的PTC类型选择适合的药物。
PTC上游序列的影响
除了下游序列,PTC上游的核苷酸序列也对药物诱导的翻译贯通产生了显著影响。研究发现,某些药物对PTC前的-1、-2、-3位碱基具有特定的偏好。例如,在SRI处理下,前导氨基酸为脯氨酸(P)、甘氨酸(G)和异亮氨酸(I)的PTCs表现出较低的贯通率,而前导氨基酸为酪氨酸(Y)和谷氨酰胺(Q)的PTCs则表现出高贯通率。
研究还发现,前导序列的碱基结构也对药物反应产生了不同的影响。例如,以A为末尾碱基的上游序列在多种药物下表现出较高的贯通率,尤其是在DAP、G418、SRI等药物处理下,平均贯通率比其他碱基类型提高了1.1-1.3倍。
上下游序列与药物的交互作用
研究表明,PTC周围的序列特征不仅影响药物效果,还可能与药物机制之间存在交互作用。这意味着某些药物在特定的序列上下文中能更好地发挥作用,而其他药物则可能在不同的上下文环境中表现出不同的效果。为此,研究者构建了一个预测模型,该模型能够通过序列上下文准确预测不同药物在全基因组范围内的贯通效率。
模型构建与验证
研究者通过对5800多个不同的PTCs进行了深度突变扫描(Deep Mutational Scanning, DMS),利用这些大规模数据构建了一个能够预测不同药物诱导贯通效率的模型。
研究者使用了从ClinVar、TCGA、MSK-IMPACT等数据库收集的大量PTCs数据,并结合实验获得的翻译贯通率,构建了一个模型。模型能够解释94%的实验数据,这意味着模型在对不同药物在不同PTCs上的作用效果具有高度的解释力。具体而言,模型利用了PTCs的序列上下游序列信息,包括+1、+2、+3位的碱基类型,以及药物的作用机制,通过算法对这些信息进行整合分析,进而生成贯通效率的预测结果。
为了验证模型的准确性,研究者进一步通过实验对多个内源性终止密码子的贯通效率进行了独立验证。通过在不同药物处理下测量这些终止密码子的翻译贯通效率,研究者发现模型的预测结果与实验数据的相关性达到0.95。这意味着模型在实际应用中的表现高度准确,可以可靠地预测不同药物在多种PTCs上的作用效果。
在实验验证中,研究者选择了15个具有代表性的PTCs,涵盖了不同类型的终止密码子(UGA、UAA、UAG)以及不同的序列上下文背景。实验数据显示,这些PTCs的贯通效率与模型预测的结果高度一致,尤其是在+1位为C(胞嘧啶)的情况下,模型准确地预测了SJ6986和DAP的高效贯通效果。
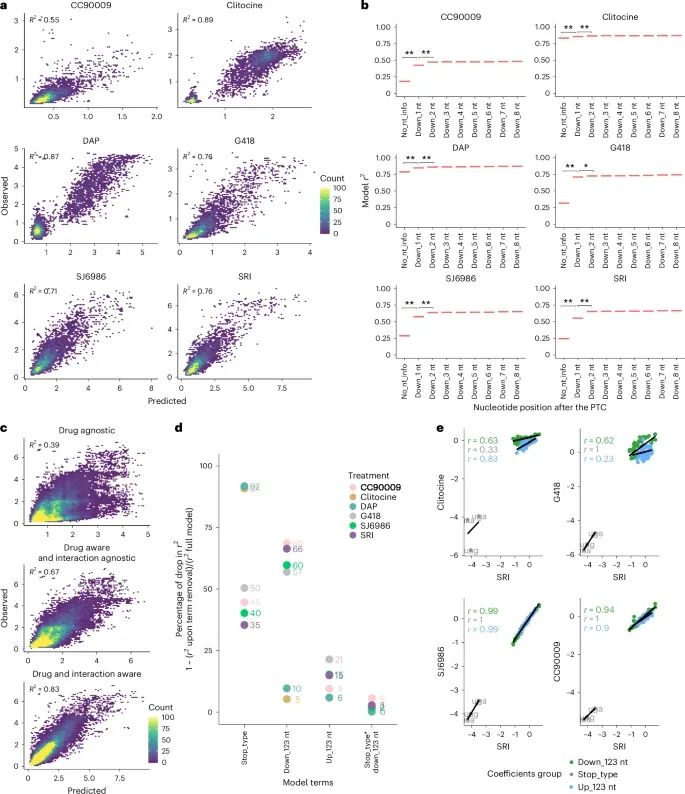
可解释模型根据序列上下游预测贯通效率(Credit: Nature Genetics)
药物特异性的预测模型性能 (图a):针对不同药物(CC90009、Clitocine、DAP、G418、SJ6986和SRI)的预测模型的交叉验证结果。这些药物的贯通预测模型分别达到了较高的预测性能,相关系数(r²)在0.55到0.89之间。Clitocine和DAP的模型表现最佳,分别达到r² = 0.89和r² = 0.87。
下游序列对模型贡献 (图b):研究表明,下游的8个核苷酸对药物诱导的贯通效率有重要影响。在所有模型中,固定预测变量包括终止密码子的类型和PTC上游的3个核苷酸。通过逐一添加下游核苷酸,模型性能逐步提升,显示出序列上下文对药物效果的调控作用。
跨药物模型的预测性能 (图c):该模型在药物不相关的情况下预测效果较差(r² = 0.39),但当药物作为预测特征纳入模型时,性能显著提高(r² = 0.83)。这表明药物和序列上下游序列的相互作用对贯通预测至关重要。
序列特征对药物特异性模型的贡献 (图d):量化了每个序列特征对不同药物模型的贡献。研究显示,当移除某一特定序列特征时,模型性能的下降程度可以反映出该特征对预测的影响。例如,移除+1核苷酸(紧邻PTC后的位置)会导致模型的r²下降最大,表明这一位点对药物诱导的贯通至关重要。
药物特异性模型系数的相关性 (图e):通过颜色编码展示了不同药物模型系数之间的相关性,发现某些药物(如Clitocine和DAP)的模型系数相关性较高,这意味着这些药物对相似的序列特征具有相似的响应。
该研究提供了大量关于PTC翻译贯通的实验数据,并成功构建了能够预测药物效果的模型,为未来的个性化治疗设计提供了有力支持。研究结果表明,单一药物可能无法在所有患者的PTCs上有效发挥作用,因此,针对不同患者的个性化治疗方案需要通过精确匹配药物与PTCs的组合来实现。
未来的研究可以进一步探索药物在不同基因组背景下的效果,特别是在内源性基因组中的表现。此外,药物诱导的贯通产物是否具有功能性也是未来临床应用的关键问题。为了实现更有效的治疗,研究还应考虑药物的药代动力学(Pharmacokinetics, PK)、药效学(Pharmacodynamics, PD)和毒性等因素 。
参考文献
Toledano I, Supek F, Lehner B. Genome-scale quantification and prediction of pathogenic stop codon readthrough by small molecules. Nat Genet. 2024 Aug 22. doi: 10.1038/s41588-024-01878-5. Epub ahead of print. PMID: 39174735.
https://www.nature.com/articles/s41588-024-01878-5


