Eur Heart J 哈医大附属第二医院于波/张毛毛/吴健团队揭示VWF介导的中性粒细胞胞外诱捕网形成在心衰进展中的作用及机制
时间:2024-08-23 22:00:32 热度:37.1℃ 作者:网络
心衰(HF)是一种由心脏结构和功能异常引起的临床综合征,在世界范围内具有很高的发病率、死亡率和医疗费用负担。长期以来,人们一直认为持续的炎症对HF的发病和进展以及随之而来的不良临床结果有重要影响。尽管抗炎疗法已被提出作为一种潜在的治疗策略,但大多数研究此类疗法的临床试验都产生了令人失望的结果。因此,亟需开发更有效的炎症靶向治疗方法。
中性粒细胞是炎症和组织损伤的关键效应细胞,在介导炎症和HF进展中起关键作用。中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs)是活化的中性粒细胞释放的,由去致密的染色质和蛋白酶组成的网状结构。由于NETs具有连接炎症和血栓形成的独特结构,因此已被广泛认为是心血管疾病的重要参与者。然而,对于NETs在HF发病中的作用和机制知之甚少。
2024年8月21日,哈尔滨医科大学附属第二医院于波教授、张毛毛教授、吴健教授团队在European Heart Journal上发表题为“Von Willebrand factor exacerbates heart failure through formation of neutrophil extracellular traps”的研究论文,揭示了VWF-SLC44A2-NETs轴破坏线粒体功能稳态导致心肌细胞凋亡并促进HF的作用及机制,以该轴为靶点可能为HF治疗提供新思路。

首先,研究者在HF患者中发现NETs水平升高,且证实其与心功能及炎症生物标志物具有相关性。接着,研究者通过构建小鼠TAC心衰模型,发现小鼠HF中NETs水平也同样升高。
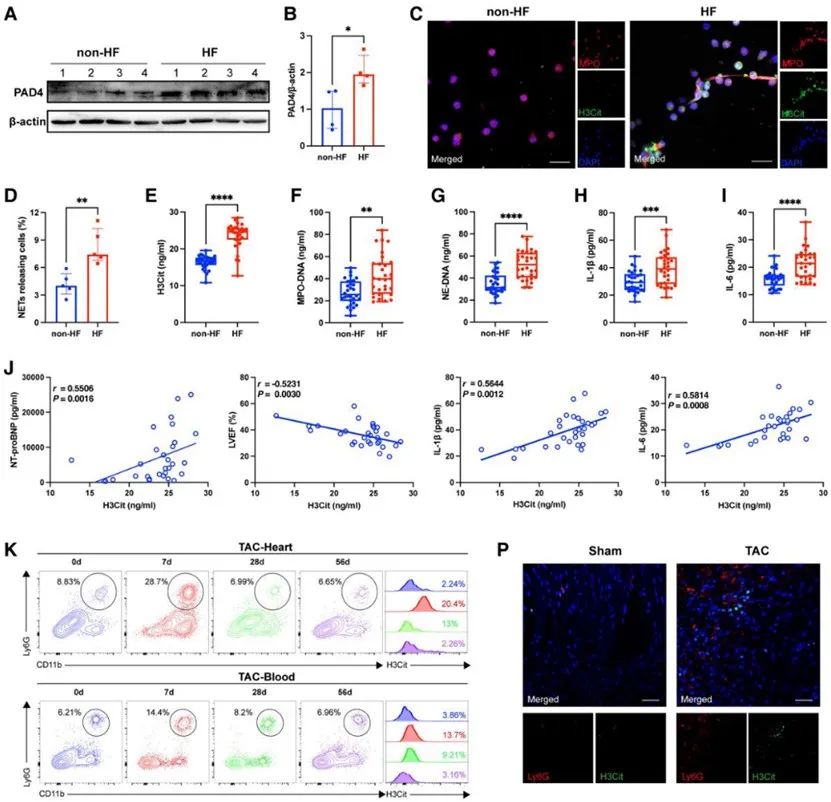
为了探究NETs在HF中的潜在作用机制,研究者发现NETs具有促进心肌细胞线粒体功能障碍进而导致心肌细胞凋亡的作用。
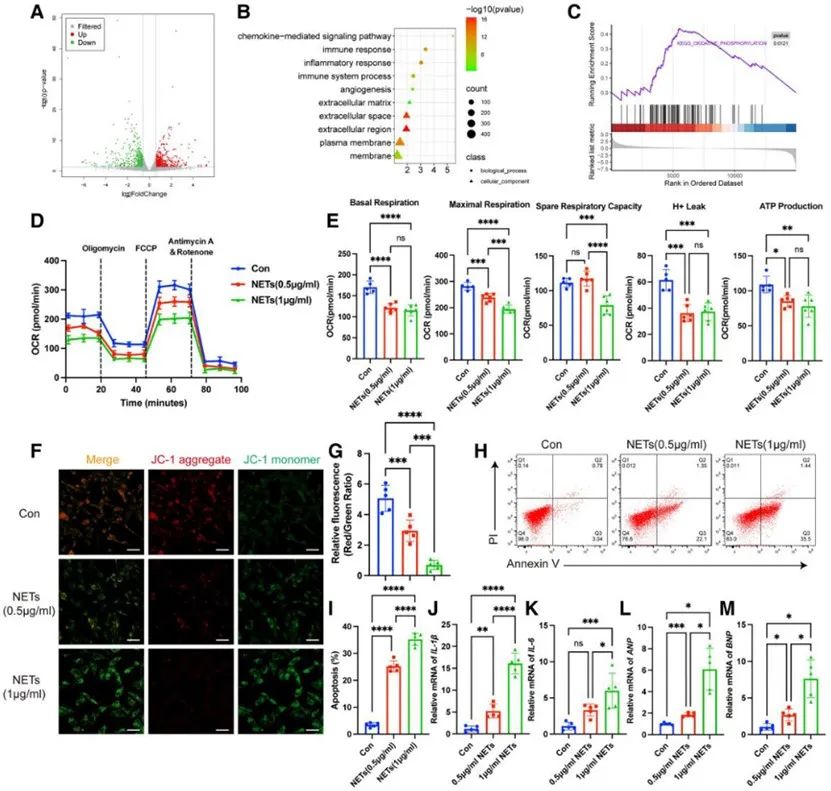
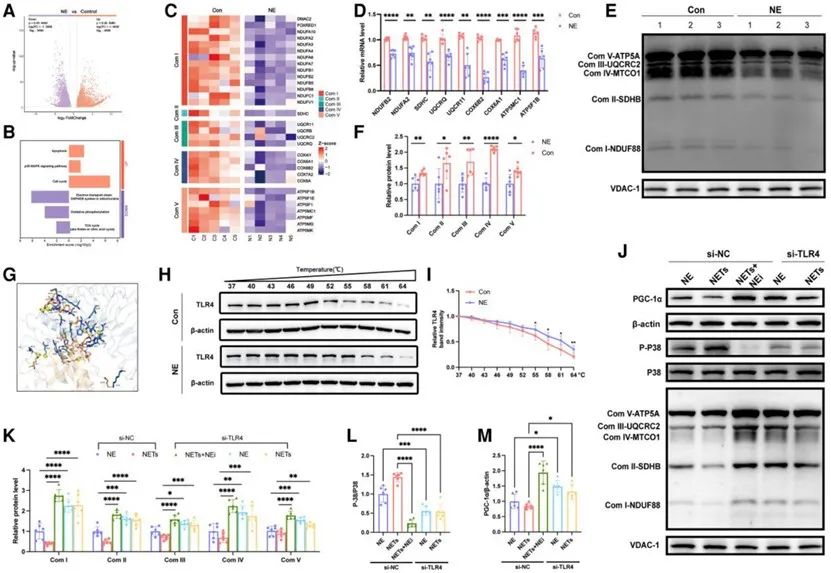
为了进一步阐明NETs导致心肌细胞线粒体功能障碍及凋亡的具体机制,研究者发现NETs通过NE释放影响心肌细胞线粒体生物发生。接着通过转录组测序、荧光定量PCR、WB等系列实验证实NETs释放NE通过TLR4-p38-PGC-1α途径抑制线粒体生物发生。
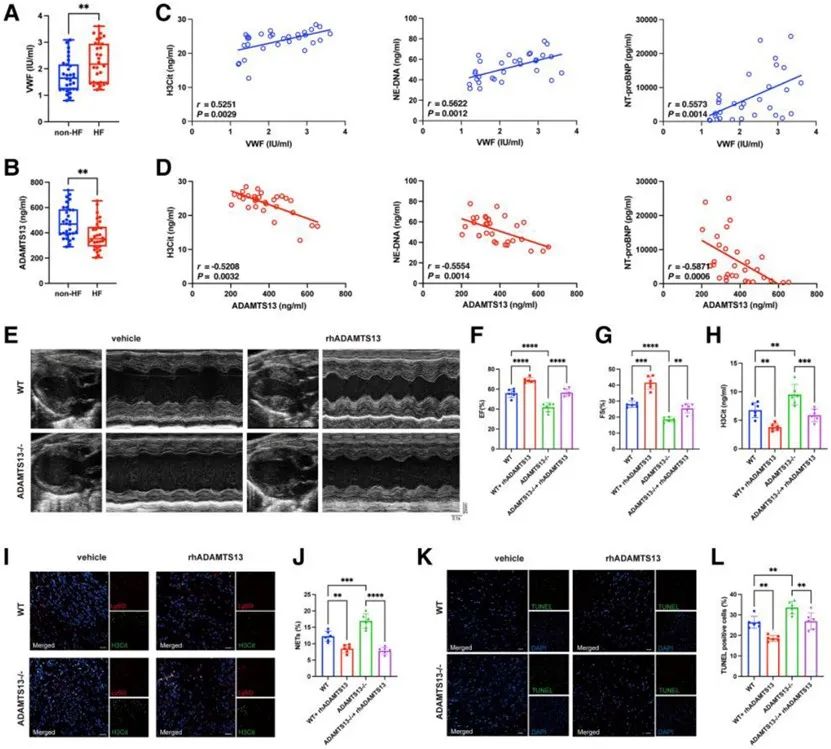
为了探究HF中NETs产生的机制,本研究首先通过ELISA证实HF患者中VWF水平升高和ADAMTS13水平减少,且发现VWF/ADAMTS13与NETs及HF指标之间具有相关性。接着通过ADAMTS13-/-小鼠及重组ADAMTS13蛋白的使用,在小鼠HF模型中证实VWF/ADAMTS13介导NETs生成参与HF进程。
为了探究VWF/ADAMTS13介导NETs生成的机制,研究者发现中性粒细胞上SLC44A2介导VWF促进NETs的发生。接着通过构建SLC44A2-/-小鼠,并在小鼠HF模型中证实VWF-SLC44A2-NETs轴参与HF中不良心脏重构。
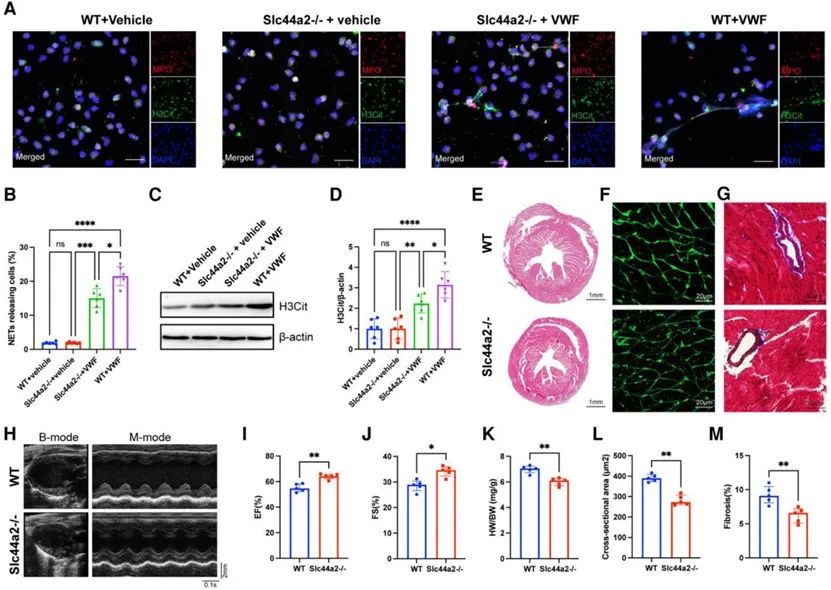
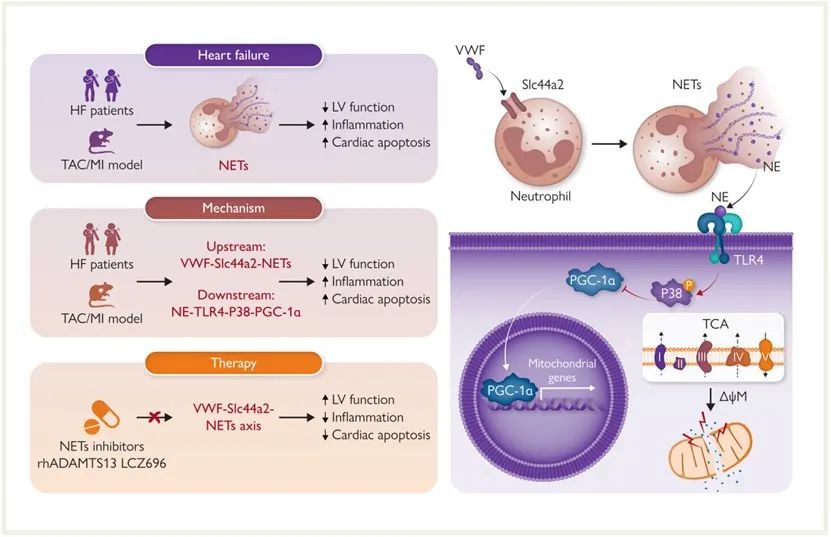
综上所述,本研究首先在HF患者和小鼠模型中检测到升高的NETs水平,证实其参与HF的进程。上游机制阐明VWF通过参与中性粒细胞上的SLC44A2促进NETs的产生。下游机制阐明NETs通过NE-TLR4途径抑制PGC-1α从而阻碍线粒体生物发生。因此,靶向VWF-SLC44A2-NETs轴将为HF治疗提供新思路。
哈尔滨医科大学附属第二医院于波教授、张毛毛教授、吴健教授及首都医科大学宣武医院博士后金家企为本文的共同通讯作者,哈尔滨医科大学附属第二医院莽鸽为本文的第一作者。该工作获得国家自然科学基金等资助。
原文链接:
https://academic.oup.com/eurheartj/advance-article-abstract/doi/10.1093/eurheartj/ehae517/7737809?redirectedFrom=fulltext


