围术期麻醉管理:注意脓毒症患者的凝血系统改变
时间:2024-08-11 06:02:52 热度:37.1℃ 作者:网络
据统计,全球每年『脓毒症』患病人数超过1900万,其中有600万患者死亡,病死率超1/4。在脓毒症的病理生理中,炎症反应和凝血系统改变是相互作用的,机体往往呈现高凝状态和微循环的纤维沉积,最终形成弥漫性血管内凝血(DIC),进而导致低灌注,以及多器官功能障碍和死亡。
一、脓毒症的病理生理改变
脓毒症是感染引起的机体反应失调,进而导致循环功能障碍及器官功能损害。主要临床表现为寒战、发热(或低体温)、心慌、气促、精神状态改变等。
一般采用序贯器官衰竭评分(SOFA)进行器官损伤评估(SOFA≥2分:存在器官损伤)。采用qSOFA快速筛查脓毒症患者(动脉收缩压≤100mmHg,呼吸频率≥22bpm,精神状态改变等)。
脓毒症病理生理包括病原体侵入、细胞因子释放、毛细血管渗漏和微循环功能障碍等。
早期:病原菌入侵后,单核/巨噬细胞和中性粒细胞通过表达的模式识别受体(PRRs)来识别病原菌表面的病原相关分子模式(PAMPs)和应激及损伤组织细胞释放的危险相关分子模式(DAMPs),诱导免疫细胞的活化以及细胞内一系列信号通路的激活,启动全身炎症反应。
中后期:机体快速进展为免疫抑制状态,免疫细胞对病原菌的反应减弱,患者出现原发感染灶难以清除、继发二重感染以及体内潜伏病毒活跃复制等临床表现。
脓毒症发生时,机体因大量炎症因子激活释放使凝血系统处于高凝状态,继而凝血物质大量消耗又使机体处于低凝期,最后出现『继发性纤溶亢进』。
研究表明脓毒症患者凝血功能障碍与多器官衰竭的发生和死亡密切相关,因此我们应当格外重视脓毒症患者的凝血功能,根据相关指标进行相应处理。
二、脓毒症患者凝血系统变化
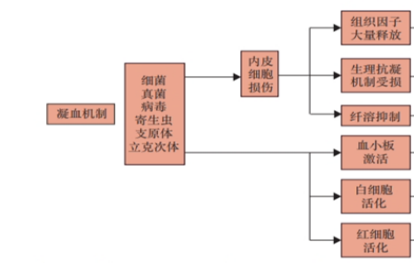
凝血系统激活
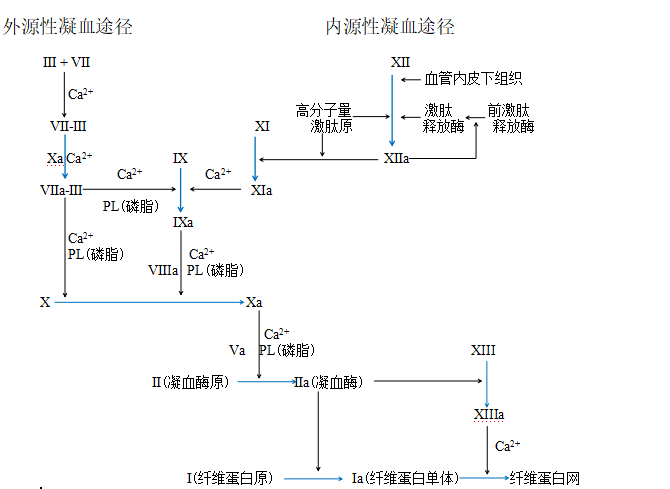
病原微生物入侵机体,血管内皮细胞、中性粒细胞和血小板等释放组织因子(TF),TF进入血液后激活外源性凝血途径,进而激活内源性凝血途径,形成广泛的微血管血栓。
抗凝系统受损
脓毒症时肝脏功能受损导致抗凝血酶的合成减少,同时抗凝血酶与凝血酶(Ⅱa)结合生成复合物以及中性粒细胞释放弹性蛋白酶对抗凝血酶的灭活。
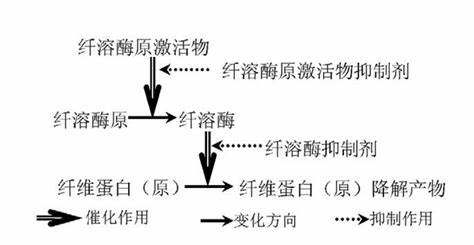
纤溶受抑
血管内皮细胞通过分泌纤溶酶原激活物(t-PA)和其抑制剂纤溶酶原激活抑制剂(PAI-1)调节纤维蛋白溶解。脓毒症时t-PA与PAI-1结合形成复合物,使t-PA失活从而阻断纤溶。
内皮功能不良
脓毒症相关DIC的一个典型特征就是内皮损伤。病原微生物和炎症刺激下,内皮广泛受损,促发t-PA释放,继而PAI-1快速产生上调,导致微环境中大量纤维素沉积。
血小板聚集
脓毒症DIC的主要诊断标准之一就是血小板降低。脓毒症患者血小板计数受多种因素影响,在病原微生物和炎症刺激下,血小板生成明显降低;血小板激活也导致了血小板计数降低、血栓形成、炎性细胞因子释放。
同时,血小板本身又被凝血酶、炎性介质等激活加重脓毒症相关DIC,形成恶性循环。
三、围术期评估及处理
脓毒症可以引起患者贫血、凝血纤溶系统功能紊乱,甚至DIC,危及患者生命。对于此类患者,专家共识中推荐术前应密切观察患者皮肤、粘膜颜色(是否有出血点、瘀斑等),初步评估是否存在重度贫血、凝血功能异常等情况;常规检测血常规和凝血功能,必要时采用血栓弹力图(TEG)等手段动态监测凝血功能变化,对症处理。
关于脓毒症患者麻醉方式,根据临床经验和专家共识:局部浸润麻醉、区域阻滞麻醉、全身麻醉等均可应用于脓毒症患者手术,应根据患者手术部位和手术类型,选择适宜的麻醉方式。
关于术中处理,有文献表明抗感染及外科治疗是其基础,血液成分输注、调节凝血酶和抗纤溶治疗为其辅助治疗。
-
输血治疗:血小板<50X107/L,可以输血小板; 有出血,PT和APTT延长(>1.5倍正常值上限),可以输注新鲜冰冻血浆15〜20ml/kg; 出血伴纤维蛋白原<1.5g/L,可输注冷沉淀或纤维蛋白原浓缩液。
-
调节凝血酶治疗:肝素和低分子肝素不建议使用。早期应用抗凝血酶可以预防多器官功能衰竭,提高生存率。抗凝血酶和凝血酶1:1结合,使凝血酶失活,同时终止凝血酶激活炎症反应。
-
抗纤溶治疗:在用新鲜冰冻血浆纠正后持续出血,可使用抗纤溶药物如氨甲环酸治疗,可显著减少出血的死亡率。
当脓毒症患者围术期出现DIC的症状和体征时,应当及时完善血栓弹力图检查,根据患者及手术情况和相关检验指标进行相应的处理治疗。
参考文献
[1]于吉人,王锷,王迪芬,等.老年脓毒症患者围术期管理专家共识(2021年)[J].协和医学杂志,2021,12(04):481-489.
[2]曹钰,柴艳芬,邓颖,等.中国脓毒症/脓毒性休克急诊治疗指南(2018)[J].感染、炎症、修复,2019,20(01):3-22.


