人血白蛋白—肝硬化感染并发症治疗的关键角色
时间:2024-08-05 15:00:39 热度:37.1℃ 作者:网络
肝硬化患者的感染现状
肝硬化是各种慢性肝病进展至以肝脏弥漫性纤维化、假小叶形成、肝内外血管增殖为特征的病理阶段,伴随肝脏微循环障碍、免疫紊乱、肝脏局部至全身的炎症反应[1]。肝硬化患者可能发生感染等并发症[1],自发性细菌性腹膜炎(SBP)是肝硬化患者常见的腹腔感染之一,此外,肝硬化患者泌尿系统、胃肠道、呼吸道等部位均易发生感染[1]。EASL 2024对肝硬化患者的感染现状进行了呈现,并深入探讨了肝硬化易发生感染的机制以及人血白蛋白治疗肝硬化感染并发症的机制和临床疗效。
EASL 2024展示的一项多中心回顾性研究[2](OS-037)对5家中心肝硬化患者的感染现状进行了分析。该研究共纳入两家肝移植中心,三家非肝移植中心的325例已出院、肝硬化失代偿期合并细菌感染患者,并进行了为期3个月的随访。如图1结果显示,与移植中心相比,非移植中心的尿路感染(20% vs 27%)和SBP(13% vs 22%)比例显著更高(P<0.01);而移植中心耐多药细菌(MDR)感染发生率更高。
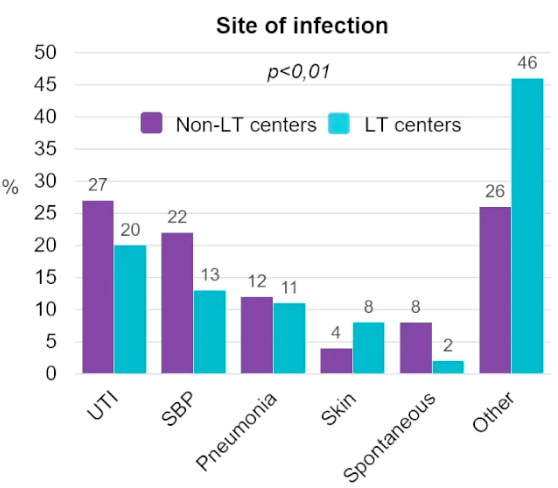
图1 移植中心与非移植中心肝硬化患者感染部位
EASL 2024发布的另一项临床研究[3](FRI-089)纳入了ATTIRE试验的777例患者,对肝硬化感染患者的预后情况及影响因素进行分析。结果显示,因肝硬化急性失代偿住院患者基线感染率达27%(n=211);如图2,基线存在感染是死亡的独立预测因素(HR=1.51,P=0.002)。相关性分析显示,利福昔明治疗与180天死亡风险增加相关(HR=1.9,P=0.019)、抗生素预防治疗存在增加死亡风险的趋势(HR=3.09,P=0.057)。可见肝硬化患者发生感染则预后不佳,且针对肝硬化患者的抗感染治疗仍存一定难点。
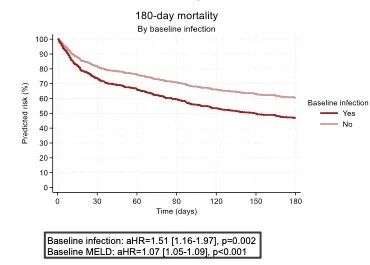
图2 肝硬化感染/非感染患者180天死亡风险
MDR感染是肝硬化患者面临的一大挑战。一项临床研究[4](THU-067)对南亚队列1203例肝硬化患者的MDR感染情况进行分析,受试患者中44.2%发生细菌感染,其中21.8%为MDR引起。和非MDR感染相比,MDR感染基线血清白蛋白水平显著更低(2.53 vs 2.40 g/dl, P<0.001),多部位感染、低血压、ACLF发生率显著更高,住院时间显著更长。并且MDR感染患者对抗生素治疗缺乏响应,短期死亡率更高。
肝硬化患者感染发生机制
肝硬化引起的免疫功能障碍可影响患者的先天和适应性的免疫激活,导致免疫功能下降。
EASL 2024发布的一项临床研究[5](WED-100-Yi),纳入健康对照患者(HC,n=10)及肝硬化不同阶段的患者:代偿期肝硬化(CC,n=10)、失代偿期肝硬化(DC,n=12)、慢加急性肝衰竭(ACLF,n=9)。通过流式细胞术识别肝硬化不同阶段的循环B淋巴细胞的分化/活化阶段、使用凋亡标志物评估B淋巴细胞的凋亡程度,并分析血清微环境在肝硬化进展中的作用。结果证实,和HC相比,不同肝硬化阶段的患者淋巴细胞绝对计数均显著减少,且这在ACLF患者中最为显著。B细胞分化状态分析结果如图3所示,幼稚和记忆B淋巴细胞在所有肝硬化患者中显著减少。在系统性炎症的影响下,B细胞亚群的凋亡标志物增加,这表明肝硬化患者循环B淋巴细胞减少更为显著。
此外,研究还将健康B淋巴细胞用肝硬化患者血清培养48小时,然后对细胞凋亡情况进行了分析。结果显示,肝硬化患者的血清微环境会导致健康B细胞的凋亡显著增加,尤其是ACLF患者血清。
总之,在肝硬化的不同阶段,细胞凋亡的增加以及患者循环B淋巴细胞减少,可能是肝硬化患者易发感染的原因之一。
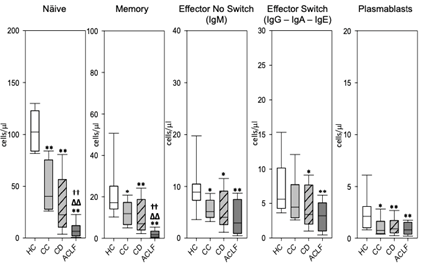
(* p<0.05 患者 vs. HC ;∆ p<0.05 CD/ ACLF vs. CC ;† p<0.05 ACLF vs. CD
** p<0.01 Patients vs. HC ;∆∆ p<0.01 CD/ ACLF vs. CC ;†† p<0.01 ACLF vs. CD)
图3 B细胞不同亚型在HC、CC、CD和ACLF中的含量对比
人血白蛋白抗感染作用机制和疗效
1.人血白蛋白在肝硬化治疗中发挥多重作用
EASL 2024报告了一项研究[6](WED-087),旨在探究人血白蛋白对B细胞产生免疫球蛋白的潜在影响。研究纳入1213例失代偿期肝硬化患者和30例健康对照。对受试人群的外周单核细胞(PBMC)及B细胞进行分离,通过流式细胞术分析B细胞免疫表型。并使用免疫球蛋白G(IgG)产生诱导剂和15 mg/mL的人血白蛋白(或空白基质)对肝硬化患者PBMC进行孵育,分析人血白蛋白能否改善PBMC生成lgG的能力。
B细胞免疫表型结果显示,肝硬化患者的B细胞群受到严重抑制,IgM、IgG等的循环水平明显失调;PBMC孵育试验结果则进一步证实(如图4),人血白蛋白孵育后的PBMC中IgG水平显著增加,IgG/IgM的比率提高;IgG亚型分析结果显示,lgG水平的增加是IgG1、IgG2和IgG3亚型增加的结果,这些亚型对病毒和细菌抗原具有反应性。研究证实,人血白蛋白通过增强B细胞功能和促进免疫球蛋白产生,这可能是长期输注人血白蛋白能够降低感染风险的原因。
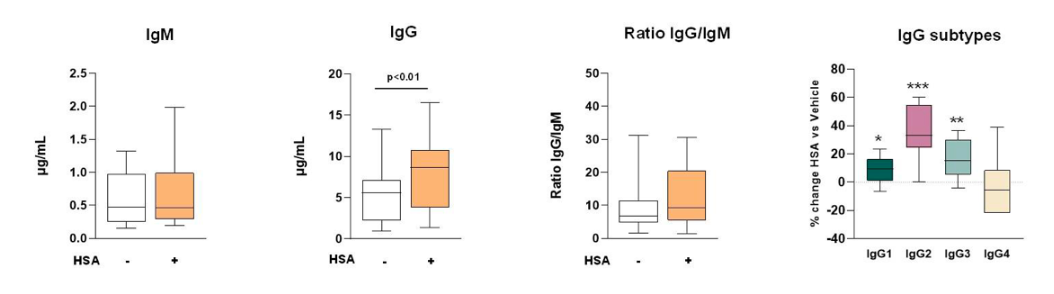
图4 人血白蛋白孵育后PBMCs产生lgG水平显著增加
抗生素是抗感染治疗的基石,药物血浆蛋白结合情况是影响抗菌药物药代动力学参数的重要因素。疾病病理状态对抗生素药物的药代动力学产生影响,导致肝硬化感染患者感染部位不能达到足够的药物浓度,可能导致抗菌治疗失败[7]。
一项前瞻性队列[8]研究证实,低白蛋白血症与抗菌素治疗有效反应率的下降相关(调整后OR,0.69;95% CI,0.52-0.92;P=0.012)。其中,β-内酰胺类、氨基糖苷类抗生素药物可能更易受到血清白蛋白水平影响,造成血浆药物水平波动[7]。法国抗生素治疗[9]指南建议在使用β-内酰胺抗生素治疗开始时应至少测量一次血清白蛋白水平,并检测其与治疗药物结合水平。此外,有研究[10]显示重症监护室患者使用氨基糖苷类药物时,血清白蛋白水平< 25 g/L将影响氨基糖苷类药物达到最佳治疗效果。
2.临床研究证实,人血白蛋白有效治疗肝硬化患者感染并发症
人血白蛋白在肝硬化感染患者的应用获国内外权威指南推荐,临床证据充分。国际权威指南共识[11,12]一致推荐人血白蛋白用于肝硬化SBP治疗,尤其是基线血清胆红素≥4 mg/dl或血清肌酐≥1 mg/dl的患者,以预防AKI和提高生存率。EASL指南[11]明确推荐了SBP患者人血白蛋白输注剂量:诊断时1.5 g/kg,第3天1 g/kg。此外,中国肝硬化诊治指南[1]推荐对于脓毒症及严重感染患者,在使用抗菌药物的同时可输注大剂量人血白蛋白、低血压时应加用血管活性药物。
一项meta分析[13]纳入42项RCT研究数据,旨在探究肝硬化患者输注人血白蛋白的死亡率和并发症情况。如图5,亚组分析结果显示,输注人血白蛋白可显著降低伴有SBP肝硬化患者的死亡率(OR,0.36;95% CI,0.20-0.64;P=0.0005)。
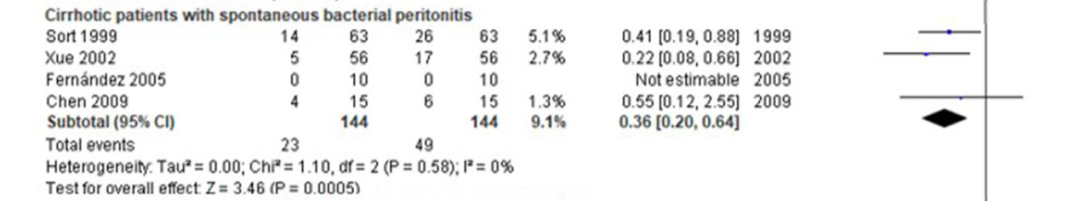
图5 输注人血白蛋白降低伴SBP肝硬化患者死亡率森林图
除了指南中明确推荐的SBP和脓毒症患者,临床研究[14]证实,人血白蛋白输注在肝硬化其他感染患者中也具有一定的潜在治疗价值。一项多中心、开放标签、随机对照研究[14]纳入118例非SBP感染的肝硬化患者,随机分为输注人血白蛋白+抗生素治疗组(n=61)和仅使用抗生素对照组(n=57),旨在比较两种治疗方案的临床疗效。如图6结果显示,与仅使用抗生素组相比,输注人血白蛋白+抗生素治疗组新发细菌感染的累积发生率显著更低(P=0.01),并且ACLF的缓解率更高(P=0.03)。
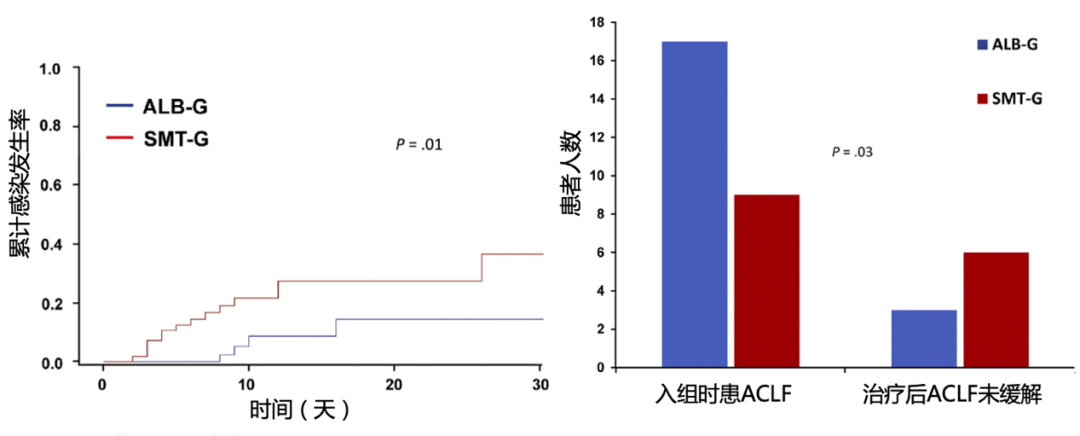
图6 受试者累计感染发生率(左)和ACLF缓解情况(右)
EASL 2024揭示了肝硬化的感染并发症现状,强调了多重耐药细菌感染对经验性抗生素治疗的挑战。深入了解肝硬化患者的感染特点有助于优化治疗策略。在机器学习[15](OS-095)和基因组学[16](WED-088-YI)快速发展的背景下,快识别感染血样中的病原体和抗菌药耐药性成为可能,肝硬化患者的感染治疗将得到进一步优化。
肝硬化患者因细胞凋亡导致循环B细胞下降,易发感染;人血白蛋白的治疗通过重塑B细胞功能,促进免疫球蛋白产生,发挥抗感染的治疗效果。在调节免疫反应和改善抗生素疗效双重作用下,静脉输注人血白蛋白成为对肝硬化感染患者具有重要治疗价值的药物。人血白蛋白的应用和研究将为肝硬化并发症治疗带来更多可能性。
参考资料:
[1] 中华医学会肝病学分会. 肝硬化诊治指南 [J] . 中华肝脏病杂志,2019,27 (11): 846-865. DOI: 10.3760/cma.j.issn.1007-3418.2019.11.008.
[2] Clàudia Torras et al.Comparison in epidemiology and outcomes of bacterial infections in patients with cirrhosis between university hospitals with and without liver transplant EASL 2024 OS-037.
[3] Nikolaj Torp et al. Infections and outcomes in patients hospitalized with an acute decompensation of cirrhosis: insights from the ATTIRE trial EASL 2024 FRI-089.
[4] Chitta Ranjan Khatua, et al. Predictors of clinical response to empirical antibiotic therapy in patients with cirrhosis and bacterial infections: results from a resource-constrained setting EASL 2024 THU-067.
[5] L. Paule et al. Role of apoptosis in B-cell compartment retraction during decompensation of cirrhosis and acute-on-chronic liver failure EASL 2024 WED-100-Yi.
[6] Berta Romero-Grimaldo et al. Exploring the potential of human serum albumin to reprogram B cell function EASL 2024 WED-087.
[7] Wiedermann C J. Hypoalbuminemia as Surrogate and Culprit of Infections[J]. Int J Mol Sci, 2021, 22(9).https://doi.org/10.3390/ijms22094496
[8] Zhang J, Li X, He R, et al. The Effectiveness of Clinical Pharmacist-Led Consultation in the Treatment of Infectious Diseases: A Prospective, Multicenter, Cohort Study[J]. Front Pharmacol, 2020, 11: 575022.https://doi.org/10.3389/fphar.2020.575022
[9] Guilhaumou R, Benaboud S, Bennis Y, et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients-guidelines from the French Society of Pharmacology and Therapeutics (Société Française de Pharmacologie et Thérapeutique-SFPT) and the French Society of Anaesthesia and Intensive Care Medicine (Société Française d'Anesthésie et Réanimation-SFAR)[J]. Crit Care, 2019, 23(1): 104.https://doi.org/10.1186/s13054-019-2378-9
[10] Counts J P, Elefritz J L, Reed E E, et al. Risk Factors Associated with Suboptimal Tobramycin Levels in the Medical Intensive Care Unit[J]. Eur J Drug Metab Pharmacokinet, 2022, 47(2): 271-278.https://doi.org/10.1007/s13318-021-00749-2
[11] EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis[J]. J Hepatol, 2018, 69(2): 406-460.https://doi.org/10.1016/j.jhep.2018.03.024
[12] Bai Z, Méndez-Sánchez N, Romeiro F G, et al. Use of albumin infusion for cirrhosis-related complications: An international position statement[J]. JHEP Rep, 2023, 5(8): 100785.https://doi.org/10.1016/j.jhepr.2023.100785
[13] Bai Z, Wang L, Wang R, et al. Use of human albumin infusion in cirrhotic patients: a systematic review and meta-analysis of randomized controlled trials[J]. Hepatol Int, 2022, 16(6): 1468-1483.https://doi.org/10.1007/s12072-022-10374-z
[14] Fernández J, Angeli P, Trebicka J, et al. Efficacy of Albumin Treatment for Patients with Cirrhosis and Infections Unrelated to Spontaneous Bacterial Peritonitis[J]. Clin Gastroenterol Hepatol, 2020, 18(4): 963-973.e14.https://doi.org/10.1016/j.cgh.2019.07.055
[15] Scott Silvey et al.A machine learning algorithm generated using routine parameters could avoid unnecessary taps to exclude SBP in a national VA cohort with internal and external validation EASL 2024 OS-095.
[16] Merianne Mohamad, et al. Enhancing infection diagnostics and antimicrobial resistance detection in cirrhosis: a clinical metagenomics approach for blood culture assessment EASL 2024 WED-088-YI.


