论文解读│宋伟宏/张韵教授团队揭示内质网应激通过剪切XBP1上调人胰岛淀粉样多肽的表达
时间:2024-08-01 17:00:42 热度:37.1℃ 作者:网络
内质网应激(ER stress)被认为与2型糖尿病(T2DM)的发生与进展密切相关,可以导致β细胞功能障碍、胰岛素分泌受损和细胞凋亡增加。然而,确切的潜在机制尚不完全了解。在95%以上的T2DM患者胰腺中观察到人胰岛淀粉样蛋白(human islet amyloid polypeptide, hIAPP)的聚集,为T2DM的病理特征之一。hIAPP是由含有89个氨基酸的前体蛋白preproIAPP按顺序剪切而成(图1)。尽管我们对hIAPP聚集的确切机制尚不清楚,但动物研究表明hIAPP的表达水平升高会导致淀粉样沉积的形成。这提示β细胞产生和分泌的hIAPP的含量会影响其淀粉样沉积的程度。当内质网无法正确折叠新合成的hIAPP时,错误折叠的hIAPP分子会积累并启动淀粉样纤维的形成。然而,目前还不清楚内质网应激是否也调节IAPP的生成。深入了解内质网应激、IAPP的产生与聚集以及糖尿病发展之间的相互关系对于开发潜在的治疗策略具有重要意义。
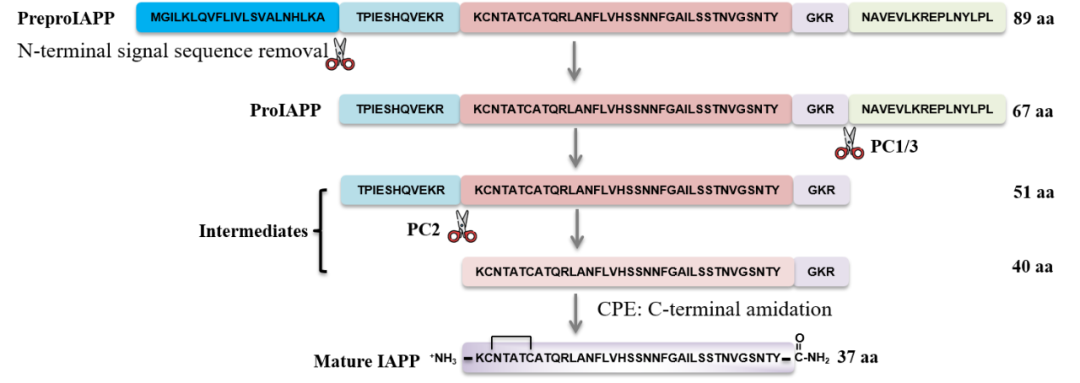
图1 PreproIAPP到mature IAPP的剪切示意图。
近日,来自首都医科大学宣武医院的宋伟宏/张韵教授课题组在本刊发表了题为“XBP1 splicing contributes to endoplasmic reticulum stress-induced human islet amyloid polypeptide up-regulation”的研究论文。为了研究内质网应激对hIAPP合成和分泌的影响,作者团队使用人胰岛β细胞作为研究对象,采用内质网应激诱导剂Tunicamycin和Thapsigargin进行处理。实验结果显示,内质网应激增加了hIAPP的表达水平(图2A、B)。同时,作者团队还观察到hIAPP的表达上调与细胞凋亡的增加相关(图2C)。
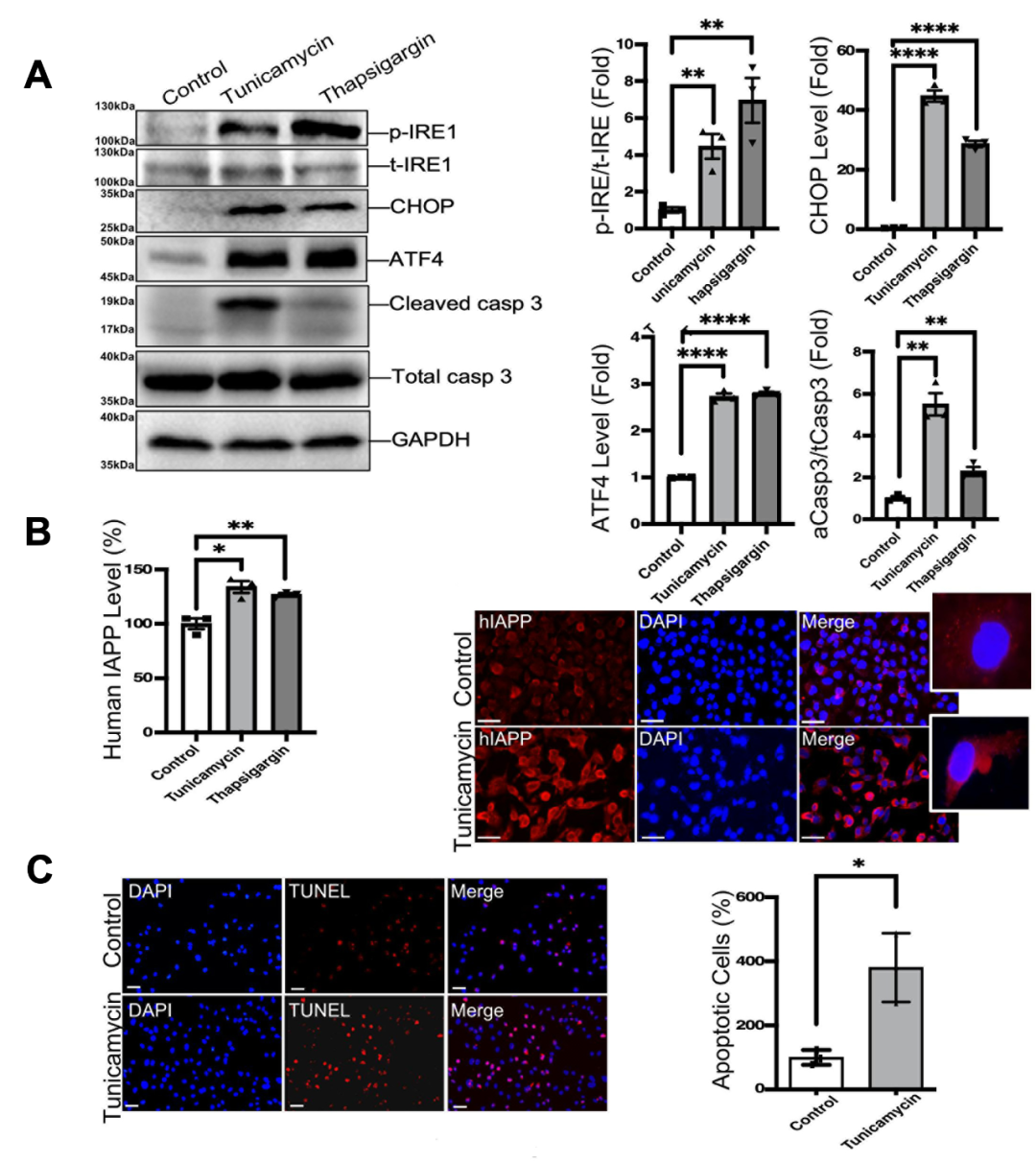
图2 内质网应激促进剂Tunicamycin和Thapsigargin对hIAPP表达及人胰岛β细胞活性的影响。
为了进一步探究内质网应激是否通过调控基因转录来影响hIAPP的表达,作者团队构建了不同长度hIAPP基因启动子片段(图3A、B)。通过荧光素酶活性分析,作者团队发现-553/+435和-240/+435片段具有显著高的活性(图3C)。此外,作者团队观察到,tunicamycin处理显著增强了hIAPP启动子的活性(图3D),并且tunicamycin处理的细胞中hIAPP mRNA的表达也显著升高(图3E)。这些结果表明,内质网应激在调控hIAPP的转录中发挥作用,从而影响其生物合成和分泌。
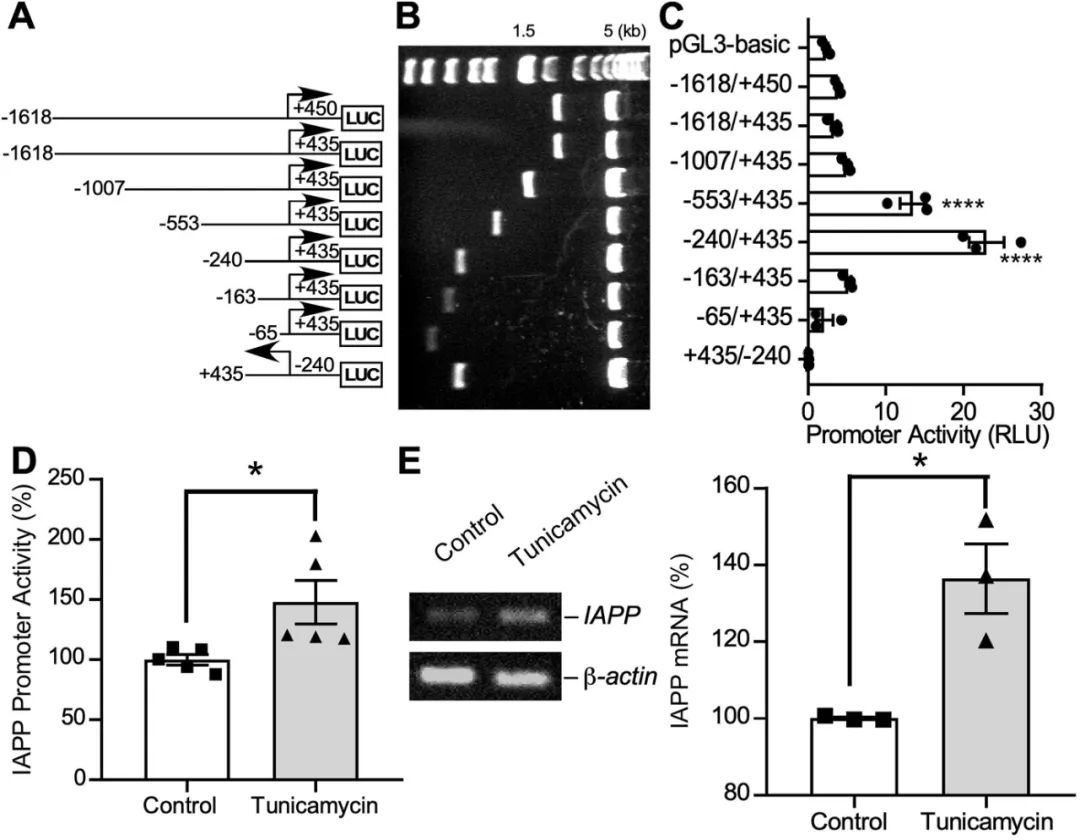
图3 Tunicamycin增加hIAPP启动子的活性和转录水平。
内质网应激会导致未折叠蛋白应答(UPR)的激活,涉及IRE1、PERK和ATF6等三个信号通路。在这些通路中,IRE1的激活是最为保守的,它会引发XBP1 mRNA的非传统剪接,生成剪接型XBP1(XBP1s)。通过对hIAPP-553/+435启动子区域进行计算机转录因子搜索(PROMO),作者团队发现可能存在XBP1s结合位点,分别位于-226到-221碱基对(ATGACAC)和-177到-171碱基对(GCTACGT)处(图4A)。为了研究XBP1亚型对hIAPP转录的影响,作者团队在人胰岛β细胞中共转染未剪接和剪接型XBP1(XBP1u和XBP1s)与hIAPP启动子。实验结果显示,与XBP1u相比,XBP1s显著增加了hIAPP启动子的活性和转录水平(图4B-D)。为了进一步验证XBP1在hIAPP启动子激活中的作用,作者团队构建了突变和缺失的hIAPP-240/+435启动子片段(图4E)。作者团队观察到,在XBP1结合位点内突变或缺失三个核苷酸(ACG)导致启动子活性显著下降(图4F)。此外,删除XBP1结合位点中的核苷酸明显减弱了内质网应激对hIAPP启动子活性的影响(图4G)。这些发现证明XBP1剪接在内质网应激条件下调节hIAPP启动子活性和转录表达中起关键作用。
作者团队还发现,内质网应激导致人胰岛β细胞中hIAPP蛋白表达上调,并伴随着细胞功能的受损(图4H、I)。为了进一步研究,作者团队应用了MKC3946来抑制XBP1 mRNA的剪接。结果显示,MKC3946成功恢复了由内质网应激诱导的hIAPP的高表达。这种hIAPP表达的恢复伴随着细胞功能的明显改善,表现为对升高的葡萄糖水平更敏感的胰岛素分泌(图4H、I)。这些发现提示,以XBP1通路为靶点的治疗方法在改善胰岛β细胞功能方面具有巨大潜力,通过减轻内质网应激对hIAPP表达的不良影响来实现。
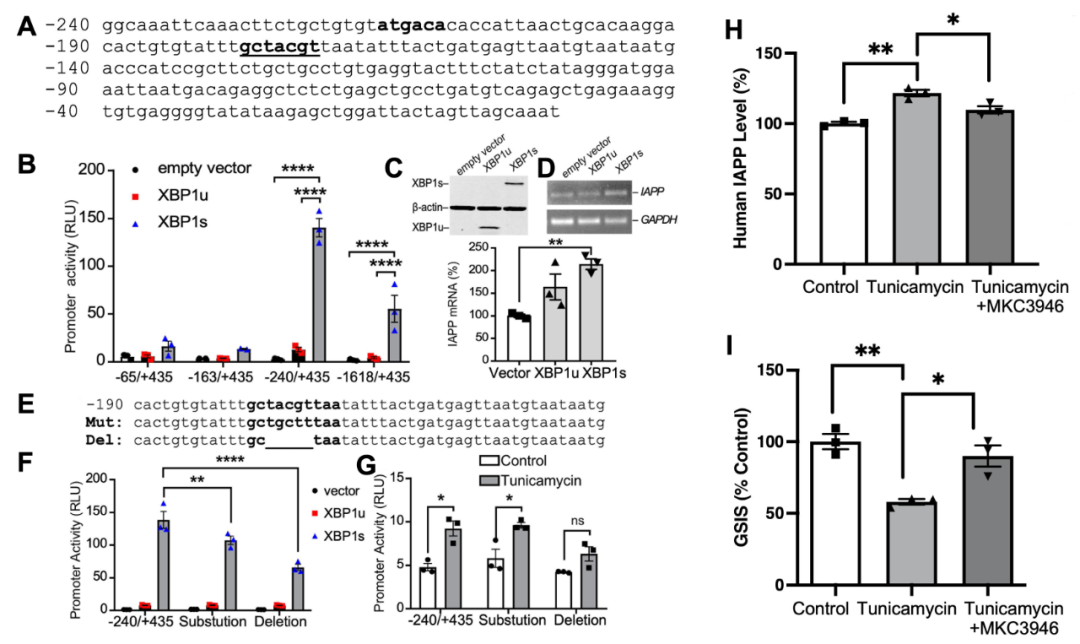
图4 剪接型XBP1增加hIAPP启动子的活性和转录水平;抑制XBP1剪切恢复内质网应激诱导的hIAPP的高表达,显著改善胰岛β细胞功能。
作者团队的研究在2型糖尿病的背景下揭示了内质网应激与hIAPP生成、聚集之间的重要关系。内质网应激导致hIAPP的高表达及错误折叠、聚集,而hIAPP的沉积又进一步加重了内质网应激,形成了一个恶性的自我循环过程,严重损害了胰岛β细胞的功能(图5)。这些新发现有助于作者团队深入了解内质网应激在T2DM发病机制中的病理作用。通过理解内质网应激和hIAPP聚集之间错综复杂的相互作用,作者团队可以更深入地了解T2DM的病理进程。此外,作者团队的研究明确了IRE1α-XBP1途径在介导内质网应激诱导的hIAPP上调和聚集中的关键作用。基于这一发现,靶向调节这一途径可能成为2型糖尿病治疗的新途径,并具有重要的应用前景。
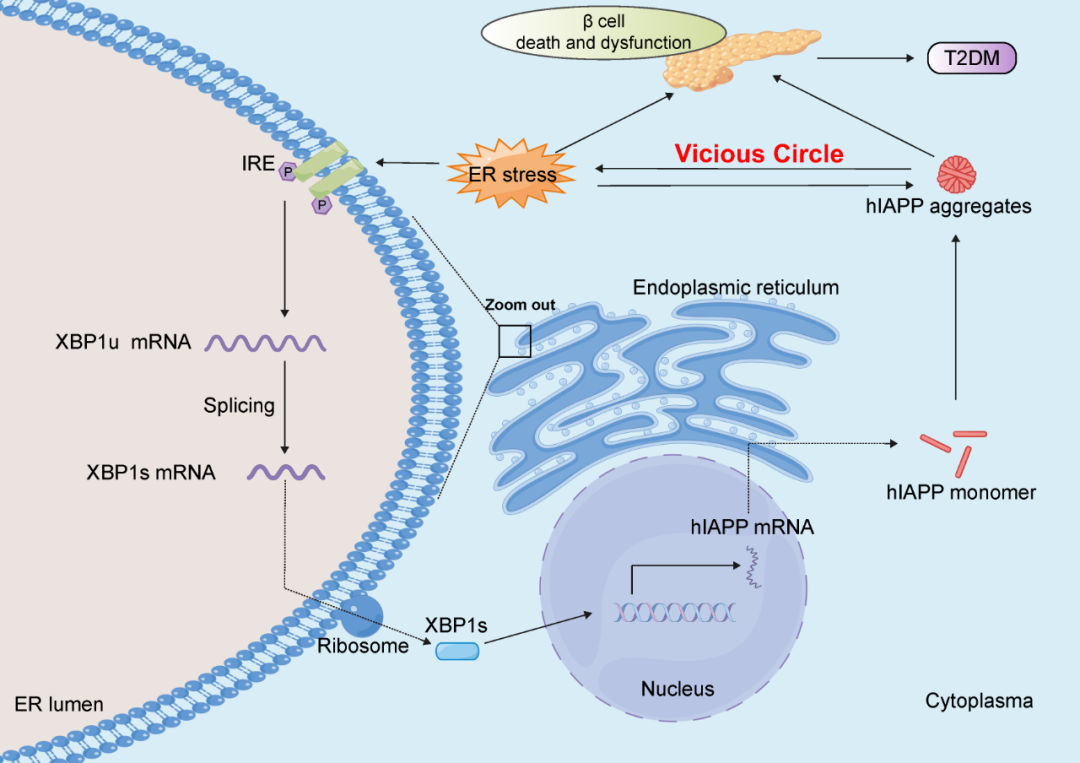
图5 2型糖尿病病程中,内质网应激与hIAPP生成、聚集之间关系示意图。
作者介绍:
张韵博士,首都医科大学宣武医院副教授。加拿大不列颠哥伦比亚大学博士, 博士后。目前主持和参与4项国家自然科学基金委、科技部及省部级科研项目,入选北京市青年海外高层次人才及北京市“青苗”计划。聚焦阿尔茨海默病与糖尿病相关认知功能损伤机制的研究,其研究成果为相关疾病的防治提供了理论基础,并推进了药物的研发。
宋伟宏教授,加拿大健康科学院院士。现任温州医科大学学术副校长,瓯江实验室(浙江省实验室)主任,浙江省阿尔茨海默病重点实验室主任。加拿大阿尔茨海默病首席研究员, 不列颠哥伦比亚大学终身讲座教授、Townsend阿尔茨海默病研究中心主任。长期从事阿尔茨海默病的研究,取得了一系列国际领先的成果。任多个国际杂志的副主编、编委。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304223004312
引用这篇文章:
Zhang Y, Lin S, Yao J, et al. XBP1 splicing contributes to endoplasmic reticulum stress-induced human islet amyloid polypeptide up-regulation. Genes Dis. 2024;11(5):101148.


