Lancet Haematol | iadademstat联合阿扎胞苷治疗初诊急性髓系白血病:2a 期剂量探索研究结果
时间:2024-07-31 19:01:17 热度:37.1℃ 作者:网络
急性髓系白血病(AML)是一种异质性血液癌症,主要影响老年人,死亡率很高,随着人口老龄化,AML的发病率不断上升,而患者的生存率却一直较低,目前,对于不适合接受高强度化疗的AML患者,治疗选择有限,疗效不佳,传统的治疗方法,如去甲基化药物(如阿扎胞苷)和低强度化疗,在老年AML患者中的反应率通常低于30%,近年来,靶向治疗药物的出现为AML治疗带来了新的希望,例如IDH1/IDH2抑制剂和FLT3抑制剂,但这些药物仅对特定基因突变的AML患者有效,因此,针对AML的异质性和遗传多样性,迫切需要开发新的治疗策略。Iadademstat(ORY-1001)是一种口服的、高选择性的LSD1抑制剂,能够有效抑制LSD1的酶活性和支架活性,LSD1是一种表观遗传调控因子,在维持白血病干细胞的干性方面发挥着重要作用,Iadademstat在AML细胞系中表现出良好的抗白血病活性,并且在临床前研究中与阿扎胞苷表现出协同作用。因此,研究者开展了ALICE研究,旨在评估Iadademstat联合阿扎胞苷治疗新诊断AML患者的安全性和有效性。

方法
ALICE研究是一项开放标签、IIa期剂量探索研究,旨在评估Iadademstat联合阿扎胞苷治疗新诊断AML患者的安全性和有效性,纳入患者年龄≥18岁,为新诊断的AML,不适合接受高强度化疗,ECOG体能状态为0-2。剂量递增阶段:患者接受Iadademstat 90 µg/m²/天(可降至60 µg/m²/天,最高可达140 µg/m²/天)口服,每周5天,停药2天,联合阿扎胞苷75 mg/m²/天皮下注射,每28天为1个周期,共7天;扩展阶段:在剂量递增阶段确定的最佳剂量下,扩大入组人数,进一步评估疗效和安全性。主要终点为安全性:评估剂量限制性毒性、不良事件以及生命体征、体重和实验室指标的变化以及确定II期推荐剂量;次要终点:疗效分析集(所有至少进行过一次疗效评估的患者)中的缓解率。
研究结果
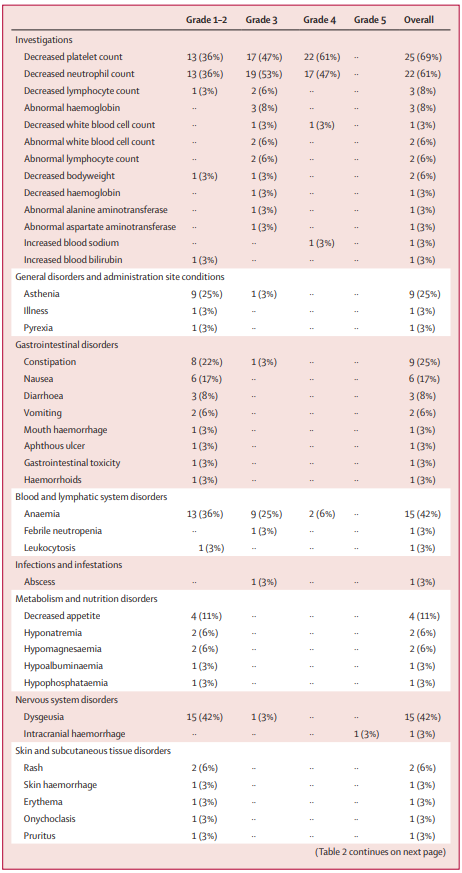
安全性:研究中未观察到剂量限制性毒性,最常见的不良事件为血液系统毒性,包括血小板减少(69%)、中性粒细胞减少(61%)和贫血(42%),大部分为3-4级,共报告3例严重不良事件,包括1例致命性颅内出血、1例分化综合征和1例发热性中性粒细胞减少,根据安全性、药代动力学、药效学和疗效数据,确定Iadademstat联合阿扎胞苷的II期推荐剂量为90 µg/m²/天。
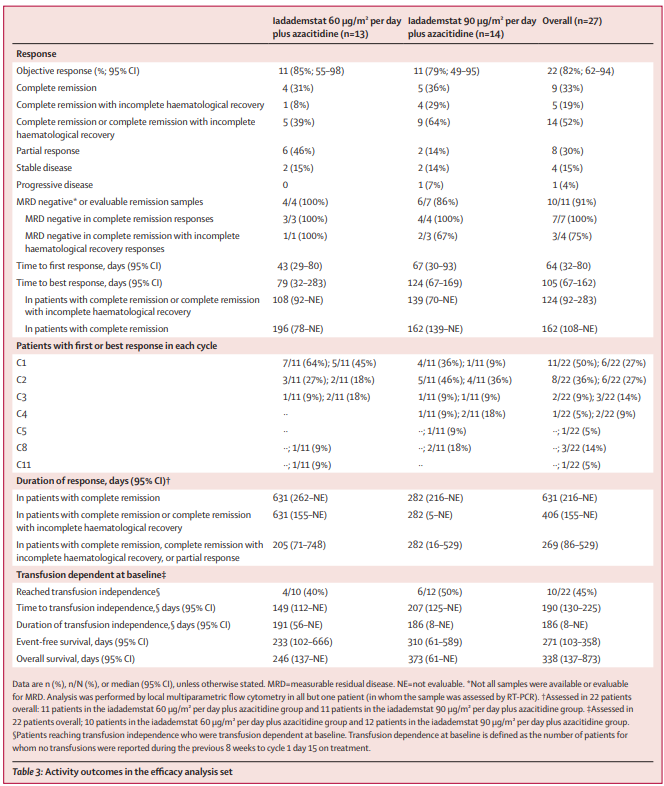
疗效:27 名疗效分析集中患者的 22 名 (82%; 95% CI 62-94) 出现了客观缓解,27 名患者中的 14 名 (52%) 达到完全缓解或完全缓解伴不完全血液学恢复;其中 11 名可评估微小残留疾病的患者中有 10 名达到阴性。

结论
Iadademstat联合阿扎胞苷治疗新诊断AML患者具有良好的安全性和有效性,包括高风险预后因素的患者,该联合方案可能为AML患者提供新的治疗选择。
原始出处
Salamero O, et al. 2024. Iadademstat in combination with azacitidine in patients with newly diagnosed acute myeloid leukaemia (ALICE): an open-label, phase 2a dose-finding study. The Lancet Haematology 11:e487-e498.


