STM:南方医科大学中山大学合力揭示PIAT/YBX1信号转导轴在肿瘤微环境中促进肿瘤细胞PNI的重要作用!
时间:2024-07-24 13:00:25 热度:37.1℃ 作者:网络
神经周围浸润(PNI)是胰腺癌中常见的生物学特征。尽管PNI在胰腺癌转移、复发和术后生存率低中起关键作用,但其机制在很大程度上尚不清楚。
2024年7月17日,南方医科大学Chen Rufu、Zhou Yu 、中山大学Chen Changhao共同通讯在Science Translational Medicine在线发表题为“Extracellular vesicle–packaged PIAT from cancer-associated fibroblasts drives neural remodeling by mediating m5C modification in pancreatic cancer mouse models”的研究论文,该研究表明来自癌症相关成纤维细胞的细胞外囊泡包装的PIAT通过介导胰腺癌小鼠模型中的m5C修饰来驱动神经重塑。
临床样本分析和内镜超声弹性评分表明,癌症相关成纤维细胞(CAFs)与PNI的发生密切相关。此外,CAF衍生的细胞外囊泡(EV)参与背根神经节共培养和小鼠坐骨神经模型中的PNI。CAF通过PNI相关转录本(PIAT)的细胞外囊泡传递促进PNI。从机制上讲,PIAT特异性结合YBX1并阻断YBX1-Nedd4l相互作用,抑制YBX1泛素化和降解。此外,PIAT 以5-甲基胞嘧啶(m5C)依赖性方式增强了YBX1和PNI相关mRNA 的结合。下游靶基因中YBX1或m5C位点的m5C识别基序突变逆转了PIAT 介导的PNI。与这些发现一致,使用KPC小鼠模型的分析表明,PIAT/YBX1轴通过m5C修饰增强了PNI。临床数据表明,胰腺癌患者血清EVs中PIAT的表达与神经侵袭程度和预后相关。该研究揭示了PIAT/YBX1信号转导轴在肿瘤微环境(TME)中促进肿瘤细胞PNI的重要作用,并为精确干扰TME中的CAFs和RNA甲基化抑制胰腺癌中的PNI提供了新的靶点。

胰腺癌TME的特征是由间质细胞和ECM组成的致密的间质。癌相关成纤维细胞(cancer associated fibroblasts, CAFs)是胰腺癌微环境中最丰富的基质细胞类型之一,它通过合成ECM和分泌各种信号分子来刺激癌细胞转移,从而影响其他基质细胞,包括免疫细胞、内皮细胞和神经细胞。先前的研究表明,CAF-胰导管腺癌(PDAC)细胞信号通过诱导PDAC细胞的上皮-间质转化(EMT)来增强PNI。此外,超音hedgehog基因信号刺激胰腺星状细胞(PSCs)通过大量分泌PNI相关分子来促进胰腺癌的PNI。然而,目前对CAFs在PDAC中介导PNI的机制知之甚少。
细胞外囊泡(EVs)的平均直径约为100纳米,是携带多种货物(RNA、DNA、蛋白质、脂质、氨基酸和代谢物)的生物成分。几种表面蛋白和代谢物被包裹在源自CAFs的EVs中,影响TME中的其他细胞群,重塑ECM,并最终影响癌症进展。先前的研究表明,CAFs衍生的EVs通过传递ANXA6/LRP1/TSP1复合物促进胰腺癌细胞的侵袭和转移,血清中高浓度的ANXA6+ EVs可能被用作胰腺癌患者预后不良的生物标志物。越来越多的证据表明,长链非编码RNAs (lncRNAs)通过EVs运送的货物介导CAFs与肿瘤细胞之间的相互作用。CAFs分泌的EVs携带lncRNA H19,可促进结直肠癌(CRC)细胞对奥沙利铂的耐药,增强结直肠癌干细胞的干细胞样特性。然而,包装在CAFs衍生EVs中的lncRNAs介导胰腺癌PNI的机制尚不清楚。
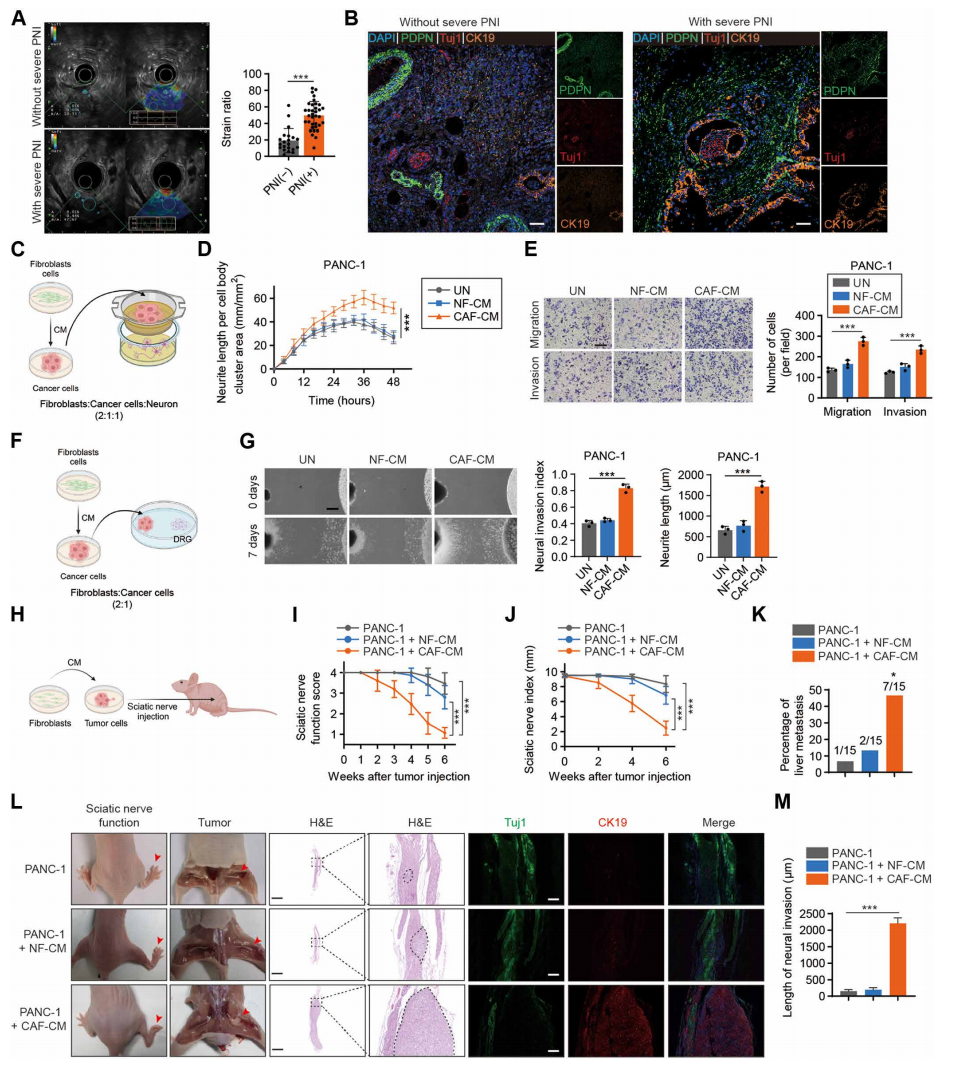
CAFs增强胰腺癌的PNI(图源自Science Translational Medicine)
5-甲基胞嘧啶(m5C)是参与表观遗传调控的一种重要的RNA甲基化形式,广泛存在于真核生物的核糖体RNA、lncRNAs、转移RNA和mRNAs上,已被发现对肿瘤转移和复发至关重要。许多RNA相关的代谢和生物学过程,包括RNA的稳定性、输出、翻译和加工,都受到m5C修饰的调控。迄今为止,Aly/REF输出因子(ALYREF)和Y-box结合蛋白1 (YBX1)已被鉴定为m5C读取器,可增强RNA稳定性并介导RNA核输出。然而,关于m5C修饰在CAFs与癌细胞相互作用中的作用的信息很少。
在该研究中,研究人员发现CAFs增强了PDAC中的PNI,并且在CAFs衍生的EVs中特异性地发现了lncRNA-PIAT丰度的增加,这与PDAC患者的PNI和不良预后呈正相关。将PIAT包装成CAFs衍生的EVs,将其转移到胰腺癌细胞中,在体外和体内促进PNI。此外,EVs包装的PIAT以YBX1依赖的方式介导胰腺癌细胞中EGR1、NTRK1和SMAD7 mRNA的稳定性。在机制上,PIAT通过阻断Nedd4l-YBX1相互作用来稳定YBX1,随后以与YBX1依赖的m5C修饰相关的方式上调PNI相关转录本的表达。该研究结果阐明了CAFs通过EVs包装的PIAT转移诱导PNI的机制,该机制通过调节胰腺癌细胞中m5C介导的mRNA稳定性来发挥作用,突出了PDAC中靶向PIAT/YBX1轴的治疗原理。
参考信息:
https://www.science.org/doi/10.1126/scitranslmed.adi0178


