Nature Methods:革新癌症治疗:EpiChem技术揭示药物与染色质结合的单细胞层面机制
时间:2024-07-21 12:00:39 热度:37.1℃ 作者:网络
引言
在癌症治疗中,小分子抑制剂通过靶向基因组和表观基因组相关蛋白质来发挥作用,因此研究这些小分子抑制剂在分子和细胞层面的功能尤为重要。然而,目前对单细胞水平的药物靶点结合的测量仍存在技术挑战。7月18日Nature Methods的研究报道“Single-cell EpiChem jointly measures drug–chromatin binding and multimodal epigenome”介绍了一种新方法EpiChem,这是一种原位单细胞联合绘图技术,能够同时测量小分子药物与染色质的结合以及多模态的表观基因组特征。
EpiChem通过在单细胞水平上联合检测多种小分子药物与组蛋白修饰、染色质可及性或靶蛋白的共测实验,展示了其在研究人类结直肠癌(CRC)类器官中的多样化药物相互作用的能力。多模态综合分析揭示了在异质性CRC类器官中的染色质状态背景下的多种药物相互作用。进一步研究发现,在小分子药物处理后的CRC类器官中,不同细胞类型的药物基因组结合动态和适应性表观基因组特征。该方法为探索细胞类型特异性药物作用机制提供了独特的工具。
小分子药物在调节细胞过程、影响基因表达、染色质结构和信号通路中起着关键作用。这些相互作用构成了广泛的治疗干预的基础,涵盖了传统药物和先进的靶向治疗。尽管许多小分子药物在医学治疗中的疗效已被广泛认可,但其在基因组水平上的具体相互作用机制往往尚不清楚。迄今为止,仅有少数技术能够在整体样本中测量小分子与细胞DNA的相互作用,而且这些技术通常需要数百万个细胞。例如,Chem-seq和Click-Chem-seq技术通过使用亲和标签富集治疗药物结合的剪切染色质来检测小分子的基因组结合。Chem-map技术则通过目标标签结合的生化设计来实现这些相互作用的映射,但目前尚未实现单细胞水平的小分子靶点结合的测量。
通过EpiChem方法,研究人员能够在单细胞水平上进行高通量的小分子药物与基因组结合位点的联合分析。该技术采用裂池条形码(split-pool barcoding)和蛋白A-Tn5抗体定向标签的方法来获取单细胞的小分子结合位点,能够有效地处理从体内和体外实验中获得的数千个细胞的数据。这一方法的成功应用不仅展示了其在三种小分子抑制剂(JQ1、THZ1和多柔比星)与附加表观基因组特征联合分析中的有效性,还揭示了药物与其已知蛋白靶点之间的共享和特有结合位点的细微差异,为药物基因组结合的深入研究提供了新的工具和方法。
综上,EpiChem为在单细胞水平上解析小分子药物与基因组相互作用及其表观基因组状态提供了一种独特的方法。这一技术的潜在应用范围广泛,从药物开发到理解细胞异质性,都具有重要意义。通过不断优化和改进,EpiChem将进一步推动我们对药物基因组结合的认识,并为更有针对性和个性化的治疗干预铺平道路。

在癌症治疗中,小分子抑制剂通过靶向基因组和表观基因组相关蛋白质来发挥作用。然而,传统方法在单细胞水平上测量这些药物的靶点结合仍存在技术挑战。为此,研究人员开发了EpiChem技术,这是一种能够同时测量小分子药物与染色质结合以及多模态表观基因组特征的原位单细胞联合绘图技术。研究介绍了该技术在研究人类结直肠癌(CRC)类器官中的应用,揭示了异质性CRC类器官中不同药物相互作用的复杂性。
为了研究小分子药物在单细胞水平上的作用,EpiChem方法采用裂池条形码(split-pool barcoding)和蛋白A-Tn5抗体定向标签的方法来获取单细胞的小分子结合位点。具体步骤包括:
样品固定:将细胞固定后,重新悬浮在冷的1% BSA/PBS中,并加入冷的甲醇,储存在-80°C。
EpiChem实验:体内实验:细胞用10 µM JQ1-btn处理15分钟,然后固定。小分子与染色质的相互作用通过抗生物素抗体在4°C过夜捕获。
体外实验:固定后的细胞在25°C下用2.5 µM JQ1-btn和抗生物素抗体孵育1小时。洗涤后,细胞用次级抗体在4°C孵育30分钟,继续洗涤并孵育。
细胞和类器官培养:mES细胞、HGC27细胞系和K562细胞系在适当的培养基中培养,CRC类器官则根据相应的方法建立并培养。
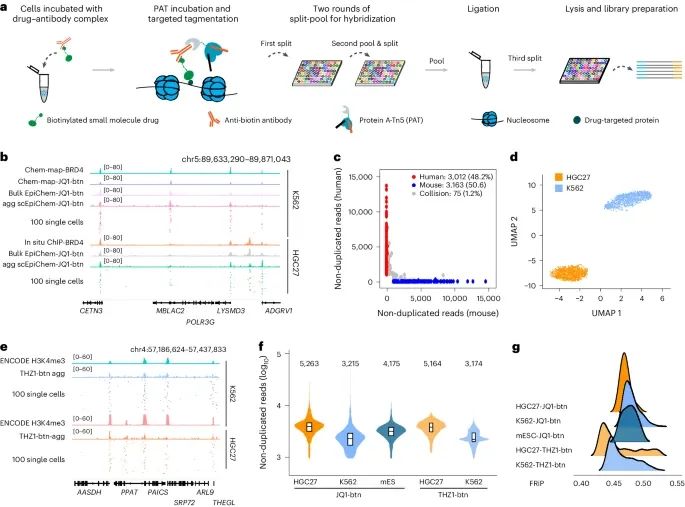
单细胞EpiChem在不同细胞系中的具体应用结果(Credit: Nature Methods)
实验设计示意图(a):展示了单细胞EpiChem设计的示意图,包括细胞裂解和文库制备、两轮裂池条形码杂交、配体PAT孵育和靶向标签。
轨迹视图(b):显示了在代表性基因座上K562和HGC27细胞中的JQ1-btn信号。基因组轨迹显示了大规模水平(JQ1-btn)、单细胞聚合(JQ1-btn agg)和随机选择的100个单细胞的JQ1-btn结合信号,以及相关蛋白的轨迹。
物种混合测试散点图(c):展示了人类和小鼠混合物种测试的JQ1-btn信号。根据细胞身份将点着色为人类(红色,>95%的读数映射到hg19)和小鼠(蓝色,)或混合(灰色)。
UMAP可视化(d):展示了基于JQ1-btn信号的K562和HGC27细胞的UMAP投影,显示了细胞类型的分布。
THZ1-btn信号轨迹视图(e):显示了在K562和HGC27细胞中代表性基因座上的THZ1-btn信号。轨迹显示了大规模水平(THZ1-btn)、单细胞聚合(THZ1-btn agg)和随机选择的100个单细胞的THZ1-btn结合信号,以及相关蛋白的轨迹。
小提琴图(f):显示了K562(n = 2,000)、HGC27(n = 2,000)和mES细胞(n = 2,000)中每个细胞的非重复读数。小提琴图顶部的数字表示中位值。
岭线图(g):展示了K562、HGC27和mES细胞中JQ1-btn和THZ1-btn的FRiP。
通过利用EpiChem方法,研究人员在CRC类器官中对多种小分子抑制剂(如JQ1、THZ1和多柔比星)进行了联合分析。结果表明,药物与其已知蛋白靶点之间存在共享和特有的结合位点。
单细胞EpiChem剖析:通过质量控制,保留了14,027个单细胞用于进一步分析。结果显示,Dox-btn和H3K27ac在代表性基因座上的特异和共享信号。Dox特异性特征参与了阳离子跨膜运输和细胞代谢过程的正调控。
多模态综合分析:研究揭示了异质性CRC类器官中药物相互作用的多样性。药物处理过程中,不同细胞类型的药物基因组结合动态和表观基因组特征的差异。在药物耐药细胞中,JQ1-btn结合位点主要集中在细胞周期相转换的调控区域,而在药物处理后的细胞中,THZ1-btn结合位点集中在多细胞有机体水平的稳态和酶联受体蛋白信号通路。
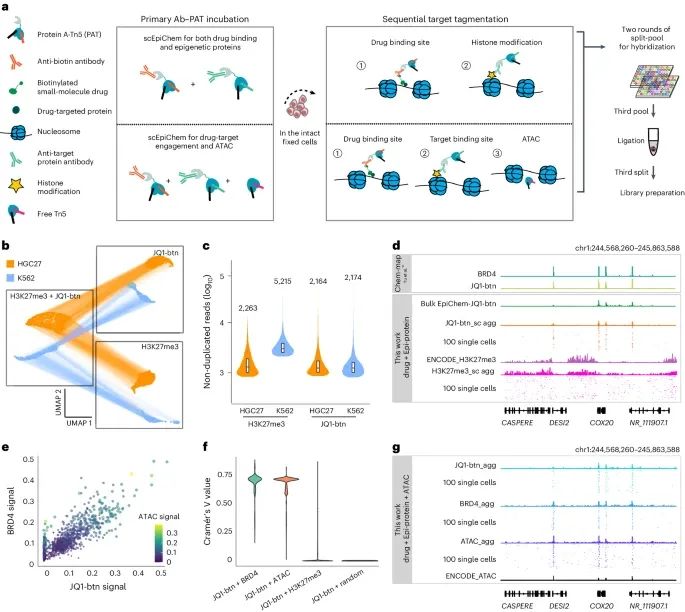
单细胞EpiChem实现小分子JQ1基因组结合与组蛋白修饰或染色质可及性的联合分析(Credit: Nature Methods)
实验设计示意图(a):展示了单细胞EpiChem的设计示意图,包括小分子JQ1与组蛋白修饰或染色质可及性的联合分析流程。该流程涉及将生物素化的小分子JQ1与抗生物素抗体结合,利用带有条形码的蛋白A-Tn5(Protein A-Tn5)进行目标片段化,并通过多轮条形码杂交进行细胞识别和信号读取。
UMAP嵌入图(b):展示了JQ1-btn和H3K27me3双模态scEpiChem数据的UMAP嵌入图。每个点代表一个细胞,连接线表示不同模态下的同一细胞(共3,619个细胞,来自两个生物重复实验)。该图显示了在双模态条件下细胞群体的分布和聚类情况。
小提琴图(c):展示了K562和HGC27细胞中JQ1-btn和H3K27me3的非重复读数(non-duplicated reads)的中位值。小提琴图的中心标记中位数,方框边界定义第25和第75百分位数。结果表明,在两种细胞类型中,JQ1-btn和H3K27me3的读数均有良好的分布和检测效果。
轨迹视图(d):展示了K562细胞中scEpiChem(双模态)数据的单细胞聚合视图和随机选择的100个单细胞的轨迹视图,参照bulk数据在DESI2基因座上的数据。轨迹视图显示了JQ1-btn和H3K27me3在特定基因区域的结合信号,验证了EpiChem方法在双模态分析中的有效性和准确性。
三模态数据可视化(e):通过计算JQ1-btn、BRD4和ATAC在BRD4峰上的标准化信号,展示了K562细胞中scEpiChem三模态数据的兼容性。结果显示,JQ1-btn的基因组结合信号与BRD4高度相关,验证了三模态数据的一致性。
关联分析(f):通过计算Cramér’s V值,量化了在相同单细胞中不同靶点(如JQ1-btn和BRD4、JQ1-btn和ATAC等)之间的共富集程度。结果显示,JQ1-btn和BRD4之间的共富集程度最高(71%),显著高于JQ1-btn与随机区域(2%)的共富集程度。
基因座轨迹视图(g):展示了代表性基因座上JQ1-btn、BRD4和ATAC的聚合单细胞信号与bulk参考数据的轨迹视图。结果显示,这些信号在相应基因区域的一致性和特异性,进一步验证了EpiChem方法的有效性。
为了更深入地了解药物与基因组结合的动态变化,研究人员进行了以下具体分析:
UMAP投影:通过UMAP投影展示了CRC类器官中VIM和CDH1的基因活性评分,以及JQ1-btn和H3K27ac在不同细胞类型中的动态变化。
热图分析:显示了在不同时间点JQ1-btn结合位点的动态变化,揭示了在治疗过程中不同细胞类型的基因组信号。
THZ1-btn和多柔比星分析:进一步分析了THZ1-btn和多柔比星(Dox-btn)在CRC类器官中的结合动态,展示了它们在不同细胞类型中的特异性结合位点。
EpiChem方法展示了其在多种小分子抑制剂与表观基因组特征联合分析中的有效性。该方法不仅揭示了药物与其已知蛋白靶点之间的共享和特有结合位点,还为药物基因组结合的深入研究提供了新的工具和方法。
未来,通过不断优化和改进,EpiChem将进一步推动我们对药物基因组结合的认识,并为更有针对性和个性化的治疗干预铺平道路。EpiChem不仅在药物开发中具有重要意义,还可以帮助我们理解细胞异质性及其在疾病中的作用,从而推动精准医疗的发展。
综上,EpiChem为在单细胞水平上解析小分子药物与基因组相互作用及其表观基因组状态提供了一种独特的方法。这一技术的潜在应用范围广泛,从药物开发到理解细胞异质性,都具有重要意义。通过不断优化和改进,EpiChem将进一步推动我们对药物基因组结合的认识,并为更有针对性和个性化的治疗干预铺平道路。
参考文献
Dong C, Meng X, Zhang T, Guo Z, Liu Y, Wu P, Chen S, Zhou F, Ma Y, Xiong H, Shu S, He A. Single-cell EpiChem jointly measures drug-chromatin binding and multimodal epigenome. Nat Methods. 2024 Jul 18. doi: 10.1038/s41592-024-02360-0. Epub ahead of print. PMID: 39025969.
https://www.nature.com/articles/s41592-024-02360-0


