【期刊导读】机制探索:干扰素α通过铁调素-铁转运蛋白轴诱导M1巨噬细胞极化,进而抑制HBV
时间:2024-07-16 14:00:17 热度:37.1℃ 作者:网络
编者按
铁调素 (Hepcidin) 是由肝脏产生的铁调节激素。既往安徽医科大学第二附属医院的王琴教授团队的一项研究已经证实,铁调素与聚乙二醇干扰素α(PEG IFNα)治疗慢乙肝患者的疗效有关,PEG IFNα治疗早期血清铁调素水平越高,患者HBsAg和HBV DNA下降的可能性越大(相关链接)。近期,王琴教授及周强教授团队对相关机制展开深入研究,证实IFNα是通过激活IL-6/JAK2/STAT3 信号通路,上调铁调素表达,并通过铁调素-铁转运蛋白轴诱导 M1 巨噬细胞极化,产生免疫应答,从而发挥抗HBV的作用。

研究方法
本研究通过水动力注射(HDI)HBV质粒建立HBV感染小鼠模型,并注射IFNα表达质粒(pIFNα),研究IFNα或铁调素对巨噬细胞的影响以及IFNα的抗病毒特性。小鼠随机分为3组:HBV + IFNα组(注射HBV质粒和pIFNα)、HBV组(注射HBV质粒)、对照组(注射生理盐水)。通过腹腔注射LMT-28(一种IL-6拮抗剂)进行IL-6阻断实验。采用细胞微球芯片技术分析细胞因子谱,流式细胞术分析巨噬细胞的极化情况,还分析了IL-6/JAK2/STAT3信号通路与铁调素-铁转运蛋白轴(hepcidin-ferroportin axis)的关系,进而探索巨噬细胞极化机制。
研究结果
01 经IFNα处理后小鼠的血清HBsAg、HBeAg和HBV DNA水平显著下降
与HBV组相比,HBV + IFNα组小鼠的血清HBsAg、HBeAg和HBV DNA水平均显著下降(图1A-C)。HBV + IFNα组小鼠的血清HBsAg和HBeAg分别在35 dpi(转染后的天数)和21 dpi时为阴性;而在60 dpi时HBV组的血清HBsAg和HBeAg仍呈阳性(图1D-E)。
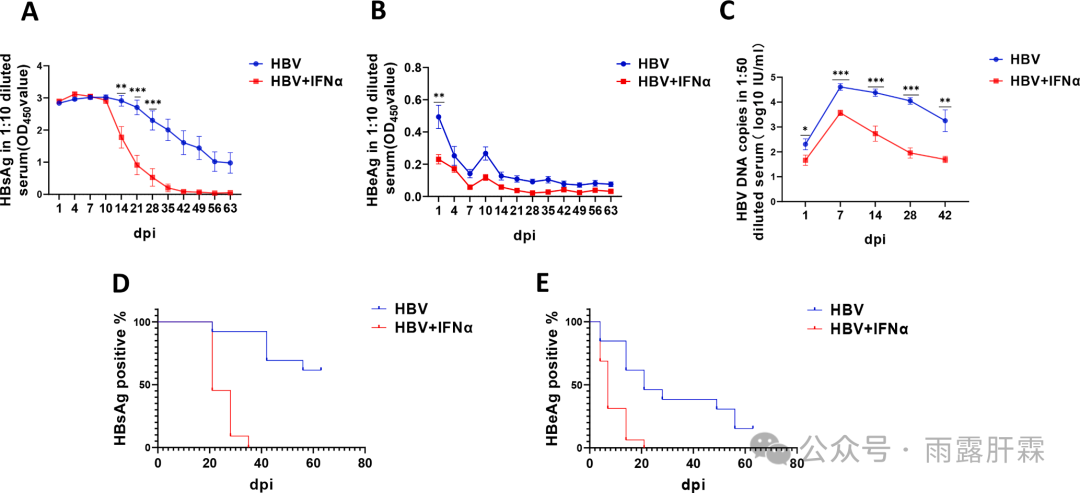
图1 HBV感染小鼠经IFNα处理后的血清学标志物变化情况
各时间点时小鼠的血清HBsAg (A)、HBeAg (B)和HBV DNA (C)水平,以及各时间点时HBsAg (D)、HBeAg (E)阳性率
02 IFNα激活IL-6/JAK2/STAT3信号通路,上调铁调素,增加肝内铁蓄积
既往研究表明IFNα显著上调铁调素的表达水平。本研究进一步发现HBV + IFNα组小鼠的血清IL-6(10和14 dpi)和铁调素(10 dpi)水平显著高于HBV组(图2A-B)。免疫荧光和qPCR也证实小鼠肝内铁调素表达增加,尤其是在第7天时(图2C)。
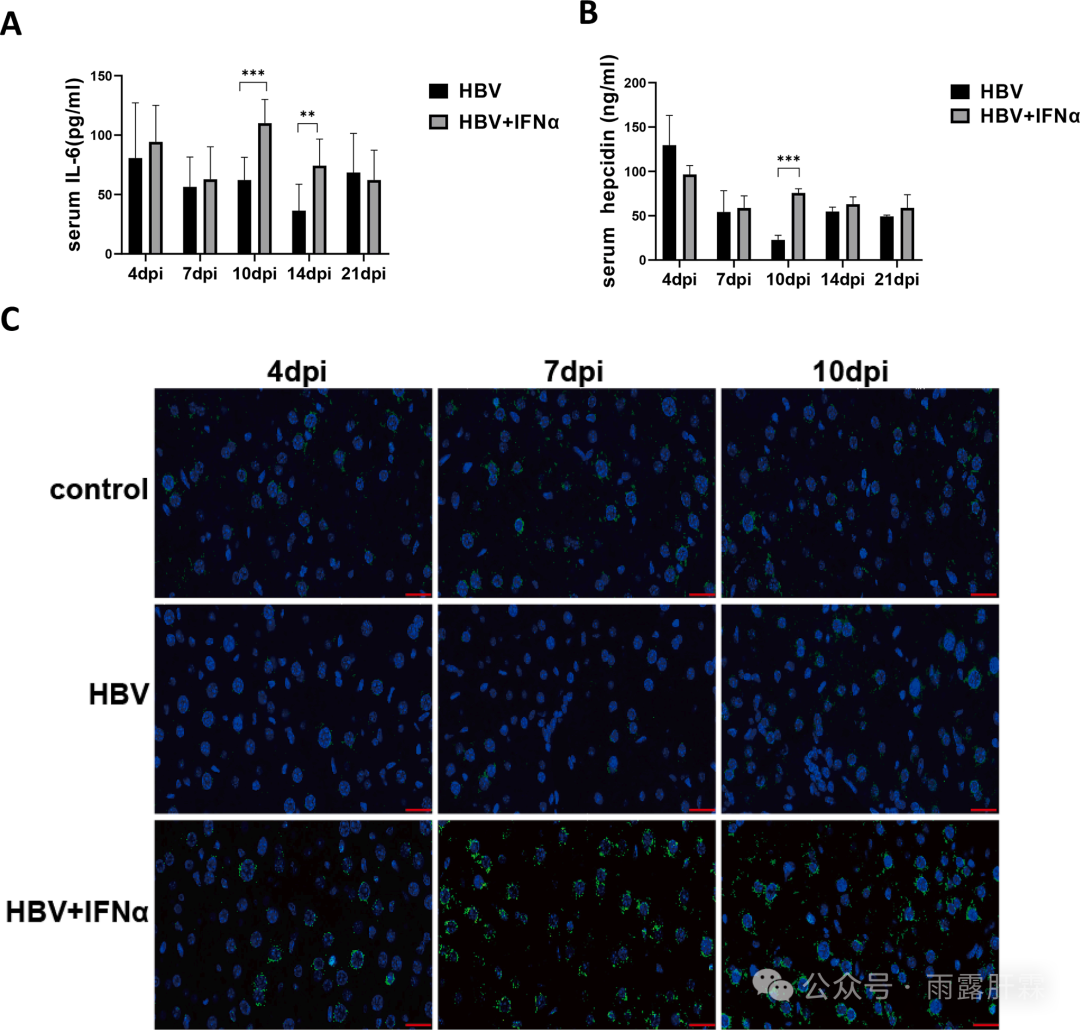
图2 IFNα上调IL-6和铁调素的表达
HBV组和HBV + IFNα组小鼠的血清IL-6 (A)和铁调素 (B)水平;(C)小鼠肝脏中铁调素蛋白表达的免疫荧光分析结果(绿光和蓝光分别代表铁调素和细胞核)
既往研究证实铁调素的上调是通过IL-6/ JAK2/STAT3信号通路来实现的,本研究在4、7、10 dpi时检测IL-6/JAK2/STAT3信号通路相关组分的表达,结果发现与HBV组或对照组小鼠相比,HBV + IFNα组小鼠肝组织中IL-6、pSTAT3和铁调素的表达均较高(图3A)。
铁调素-膜铁转运蛋白轴(hepcidin-ferroportin axis)可调节铁稳态。本研究发现,与HBV组或对照组相比,HBV+IFNα组小鼠肝脏中的铁调素高表达促使膜铁转运蛋白(FPN)下调,诱导铁蛋白上调(图3A)。普鲁士蓝染色实验证实,经IFNα处理10 dpi时肝组织产生明显的蓝色,表明肝脏内的铁蓄积(图3B)。
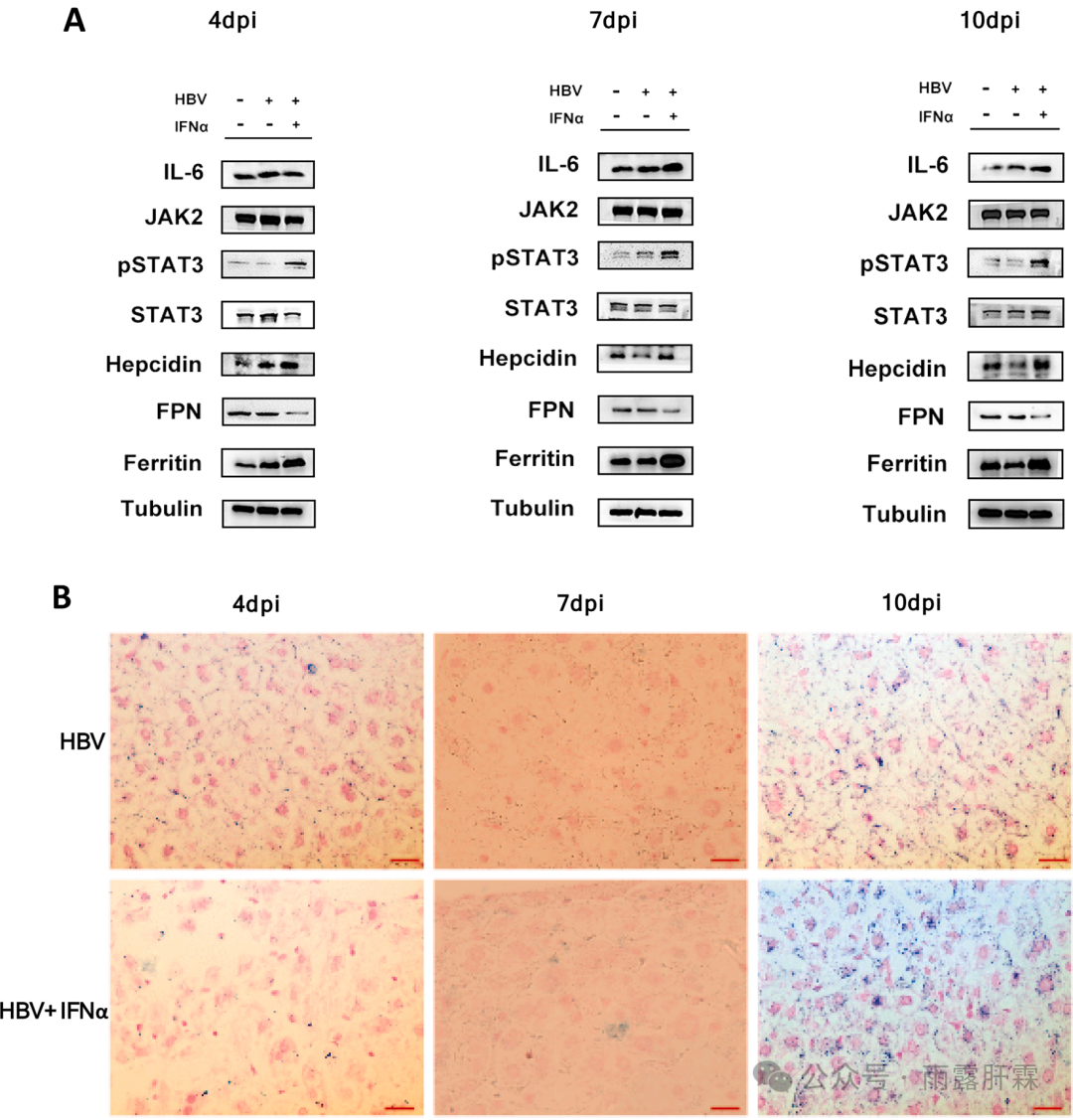
图3 IFNα激活IL-6/JAK2/STAT3信号通路,上调铁调素,增加肝内铁蓄积
(A)小鼠肝组织中IL-6/JAK2/STAT3信号通路和铁调素-铁转运蛋白轴相关的蛋白表达; (B)普鲁士染色分析肝内铁蓄积(蓝色代表铁含量)
03 铁调素的上调依赖于IL-6/JAK2/STAT3信号通路
细胞实验(HepG2-HBV1.3细胞)表明,经IFNα处理后细胞上清液中IL-6水平显著升高,铁调素和IL-6的mRNA表达量也上调,IL-6/JAK2/STAT3信号通路被激活,IL-6和pSTAT3表达增加(图4A-C)。当转染IL-6小干扰RNA(siRNA-IL-6)沉默IL-6的表达后,细胞中IL-6/JAK2/STAT3信号通路被抑制,提示siRNA-IL-6转染可下调铁调素的表达(图4D-E)。
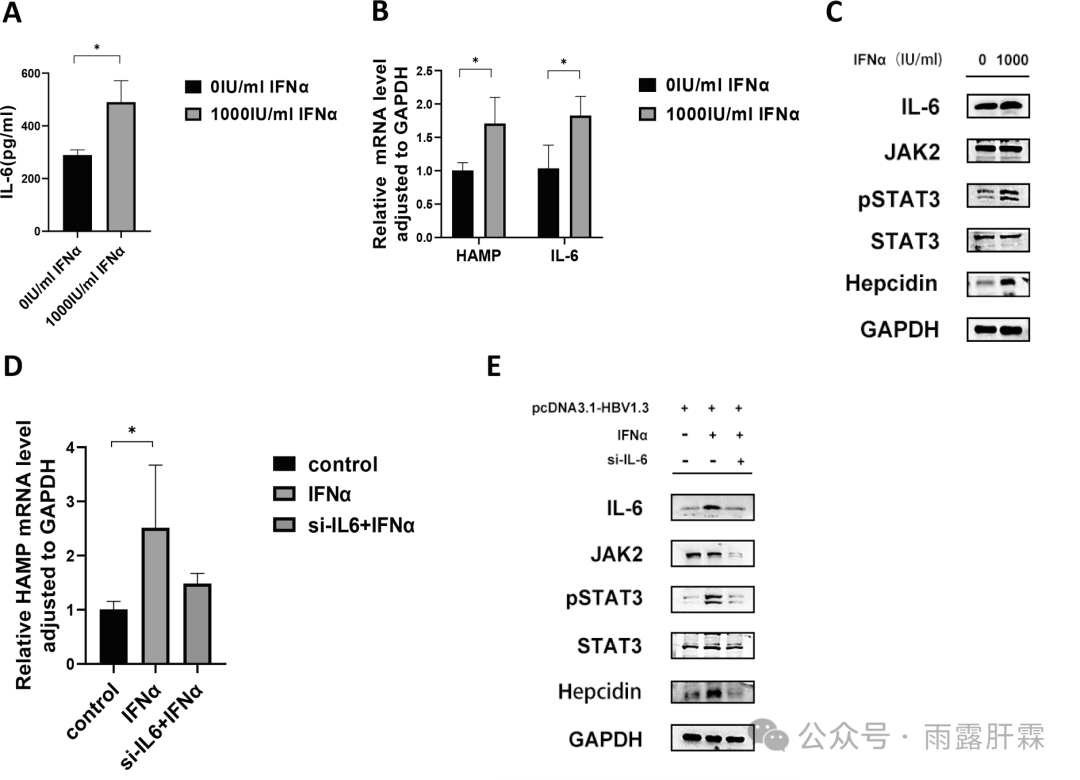
图4 IFNα诱导铁调素的表达依赖于IL-6/JAK2/STAT3信号通路
(A)细胞上清液中IL-6水平(6 h);
(B、D)不同处理条件下细胞中HAMP、IL-6 mRNA表达情况(24 h);
(C和E) siRNA-IL-6和IFNα处理细胞后(6 h) IL-6/JAK2/STAT3信号通路的蛋白分析结果
加入IL-6拮抗剂(LMT-28)阻断IL-6的表达,结果发现HBV+IFNα组小鼠肝组织中p-STAT3和铁调素的表达均下调,免疫荧光染色分析也证实阻断IL-6可下调HBV + IFNα组小鼠肝组织中铁调素的表达。
上述研究结果提示IFNα诱导的铁调素表达依赖于IL-6/JAK2/STAT3信号通路的激活。
04 IFNα诱导M1巨噬细胞的极化
检测HBV + IFNα组小鼠肝、脾中巨噬细胞的极化状态(检测CD86的表达来鉴定M1巨噬细胞;检测CD206的表达鉴定M2型巨噬细胞)。4、7、10 dpi时,HBV + IFNα组小鼠肝、脾中巨噬细胞表面CD86的表达显著高于对照组和HBV组。而在7 dpi时,HBV + IFNα组小鼠的肝和脾中巨噬细胞上的CD206表达均降低(图5A和B)。
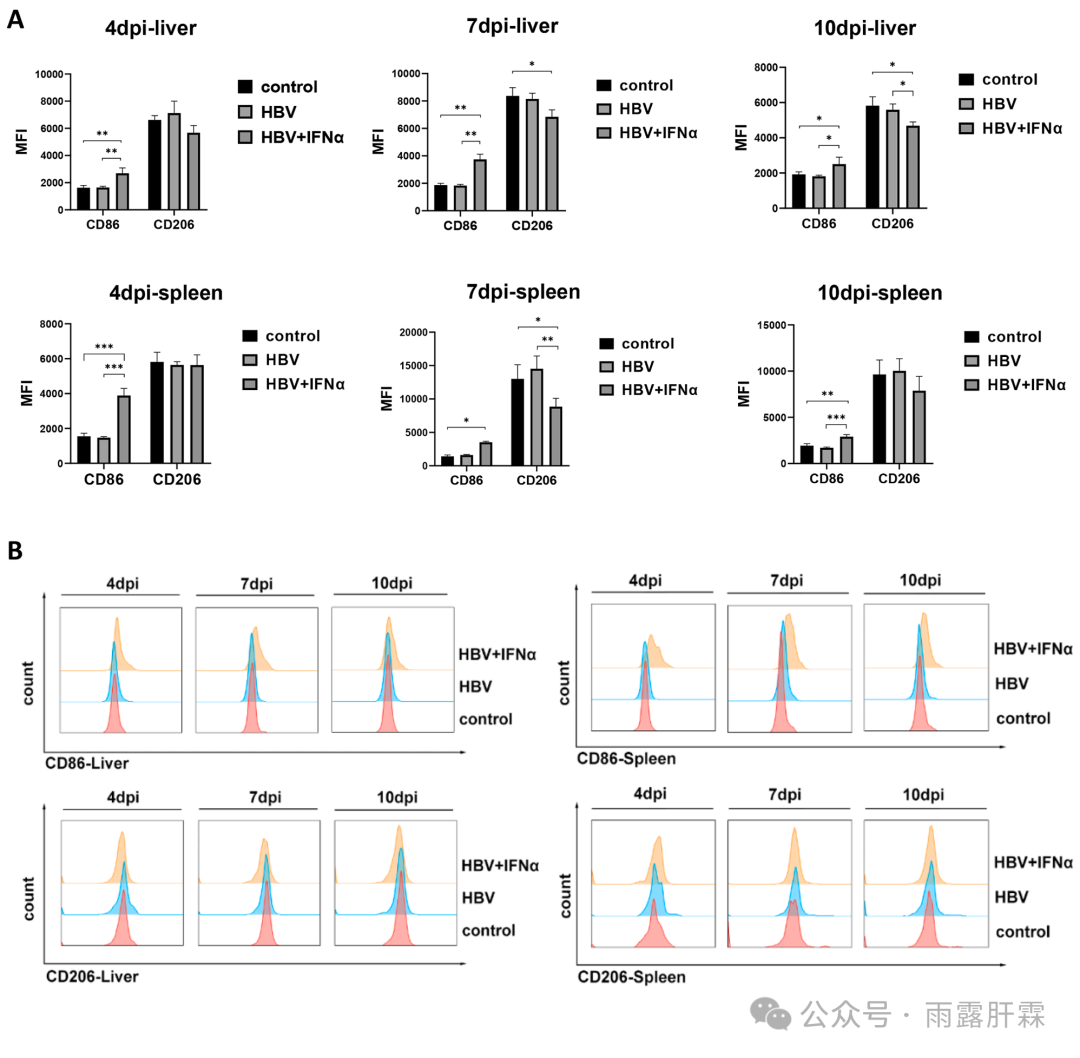
图5 IFNα处理可激活M1巨噬细胞的极化
(A)流式细胞术分析HBV组和HBV + IFNα组小鼠肝脏和脾脏CD11b + F4/80 +巨噬细胞CD86和CD206的表达情况;(B)小鼠肝脏和脾脏巨噬细胞CD86和CD206表达差异的直方图
进一步检测结果显示,经IFNα处理上调CD16的表达,下调CD206的表达(图6B和C);且上调铁调素表达,下调铁转运蛋白,诱导铁蓄积,增加铁蛋白水平(图6D和E)。值得注意的是,IL-6和pSTAT3也被上调(图6A和E)。提示IFNα通过IL-6/JAK2/STAT3信号通路调节铁调素-铁转运蛋白轴激活M1巨噬细胞的极化。
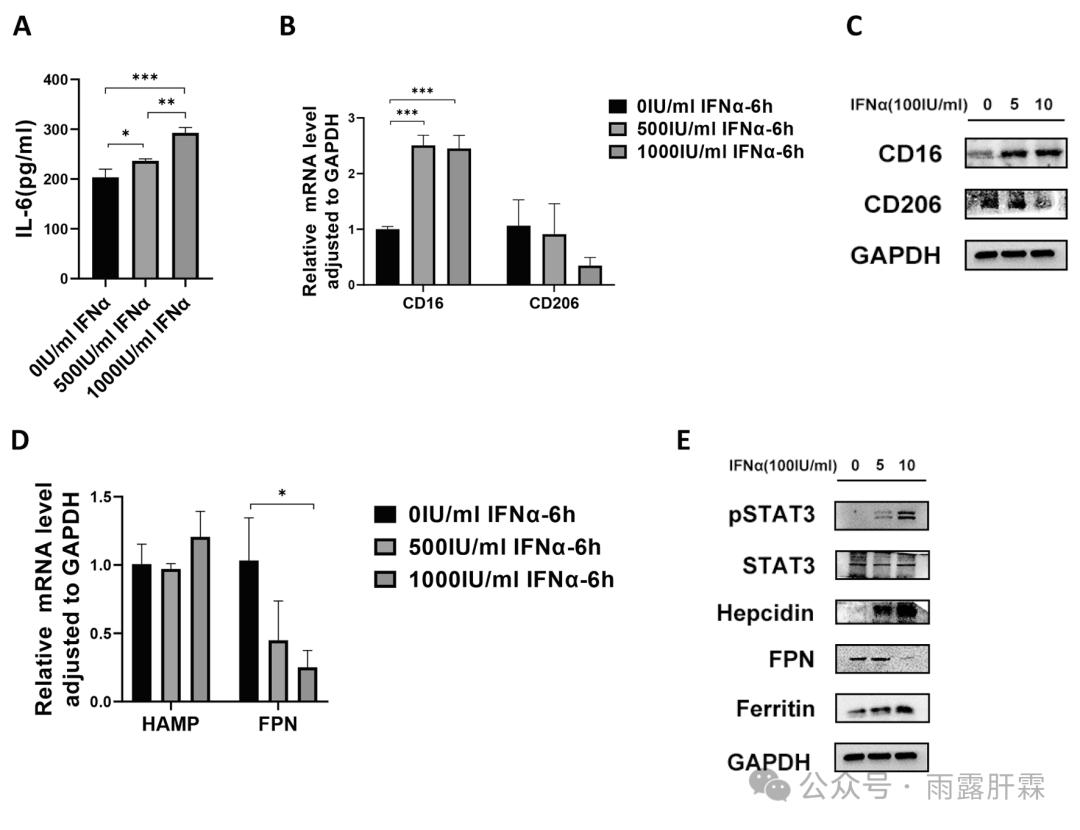
图6 IFNα处理诱导M1巨噬细胞的极化
IFNα处理后巨噬细胞中IL-6的水平(A);IFNα处理后巨噬细胞中CD16、CD206 mRNA水平(B)及蛋白表达水平(C);(D)采用qRT-PCR检测经IFNα处理的巨噬细胞中铁调素 (HAMP)和铁转运蛋白(FPN) 的mRNA水平;(E) 蛋白分析IFNα处理后pSATA3、STAT3、铁调素、FPN、铁蛋白的表达水平
05 IFNα诱导巨噬细胞极化释放IL-1β,从而抑制肝细胞内HBV的复制
经IFNα处理后,与M1巨噬细胞极化相关的细胞因子(IL-1β、IL-12、IL-6)的表达显著升高,而TNFα无明显变化(图7A、B)。且IL-1β mRNA在铁调素处理后显著上调(图7A和C)。进一步研究表明IFNα可能通过触发M1巨噬细胞极化来释放IL-1β,从而抑制HBV复制(图7D和E)。
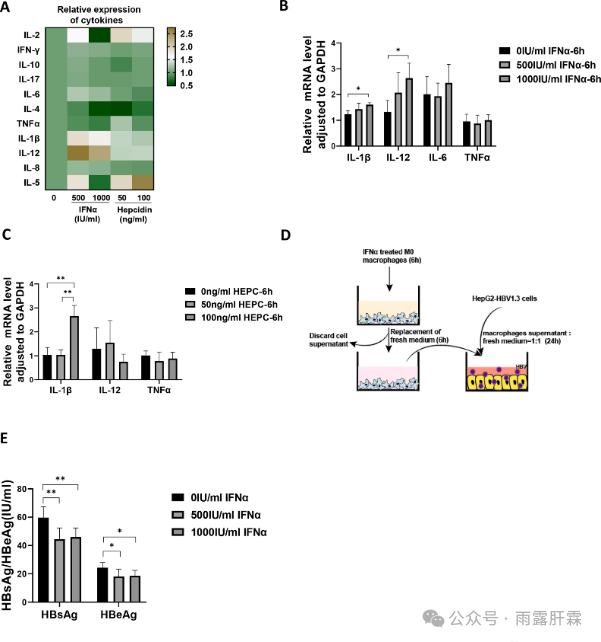
图7 M1巨噬细胞极化的抗病毒作用
M0巨噬细胞经IFNα或铁调素处理6小时后,(A)细胞因子浓度(热图分析结果);(B、C) RT-qPCR检测细胞因子的表达;(D)共培养实验方案示意图;(E)化学发光法检测共培养后上清液中HBsAg和HBeAg水平
肝霖君有话说
本研究表明IFNα通过激活IL-6/JAK2/STAT3信号通路,诱导铁调素的表达,并通过铁调素-铁转运蛋白轴诱导细胞内的铁蓄积,促进M1巨噬细胞极化,产生免疫应答,进而发挥抗HBV的作用(图7F)。
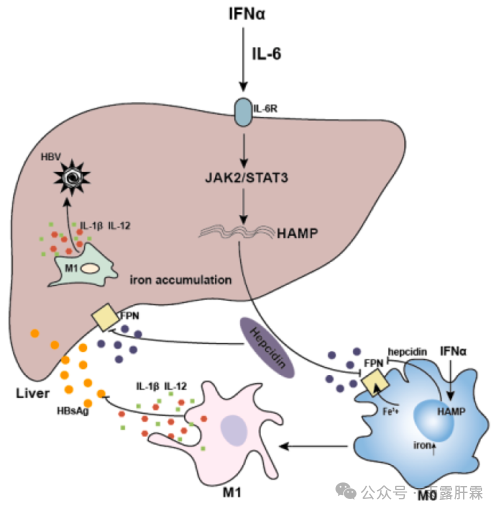
图7F IFNα介导的抑制HBV复制的简略图
近年来,学界对于IFNα/PEG IFNα抗HBV的作用机制研究正在不断深入,这也将有助于进一步优化治疗方案,提高临床治愈率,使更多患者获益。
参考文献:
Liu Q, Li J, Zong Q, et al. Interferon-induced polarization of M1 macrophages mediates antiviral activity against the hepatitis B virus via the hepcidin-ferroportin axis[J]. Int Immunopharmacol. 2024, 134: 112219.



