Adv Sci:山东大学杨其峰团队揭示了CircCFL1促进三阴性乳腺癌干性和免疫逃逸的作用机理
时间:2024-07-12 19:00:36 热度:37.1℃ 作者:网络
三阴性乳腺癌(TNBC)是乳腺癌中最恶性的亚型。TP53在TNBC患者中突变率约为70%-80%,发生突变时起致癌作用。然而,circRNAs是否能够通过调控突变体TP53对TNBC发挥作用还没有得到很好的评价。
2024年7月9日,山东大学杨其峰团队在Advanced Science 在线发表题为“CircCFL1 Promotes TNBC Stemness and Immunoescape via Deacetylation-Mediated c-Myc Deubiquitylation to Facilitate Mutant TP53 Transcription”的研究论文,该研究中发现,circCFL1在TNBC细胞和组织中高表达,具有预后潜力。
在功能上,circCFL1促进TNBC细胞的增殖、转移和干性。在机制上,circCFL1作为支架增强HDAC1与c-Myc之间的相互作用,通过去乙酰化介导的k48连锁泛素化抑制进一步促进c-Myc的稳定性。在TP53突变的TNBC细胞中,稳定表达的c-Myc通过直接结合TP53启动子进一步增强mutp53的表达,通过激活p-AKT/WIP/YAP/TAZ通路促进TNBC细胞的干性。此外,circCFL1可以通过促进PD-L1的表达,抑制CD8 T细胞的抗肿瘤免疫,促进TNBC细胞的免疫逃逸。综上所述,circCFL1通过促进HDAC1/c-Myc/mutp53轴发挥致瘤作用,可作为TP53突变TNBC患者的潜在诊断生物标志物和治疗靶点。

乳腺癌仍然是世界上最常见的女性恶性肿瘤,威胁着女性的健康。三阴性乳腺癌(TNBC)占所有乳腺肿瘤的15%-20%,是恶性程度最高的亚型。TNBC是一种免疫组织化学(IHC)定义的乳腺癌亚型,缺乏雌激素受体(ER)或孕激素受体(PR)的表达,具有人HER2扩增、增殖快、转移早等特点。由于上述受体的缺失,对于TNBC患者,传统的化疗(CT)和放疗(RT)内分泌治疗不能被内分泌治疗所替代。因此,迫切需要阐明分子机制并确定TNBC进展的新靶点。
癌症是一种复杂的、多因素和多阶段的疾病,由内源性和外源性因素引起,如环境刺激、代谢变化和基因突变。在几乎所有的癌症中,基因突变都会导致异常蛋白质的产生,而且越来越多的研究表明,不同基因的突变可能导致不同的功能。例如,BRCA突变细胞含有DNA修复缺陷,PIK3CA突变调节肿瘤的免疫原性。值得注意的是,TP53被认为是人类肿瘤中最常见的突变基因;尽管野生型TP53是一种众所周知的肿瘤抑制因子,但它的一些突变可以促进癌症的恶性行为。值得注意的是,TP53突变通常发生在约70% ~ 80%的TNBC中,导致转移增强、干细胞化、化疗耐药、免疫治疗反应差等。TNBC中TP53的几个热点突变已被发现并分型为接触突变(R248Q、R273H、R280K)和结构突变(Y220C、R249S、R282W),但TNBC中mutp53的功能和调控机制尚未明确。
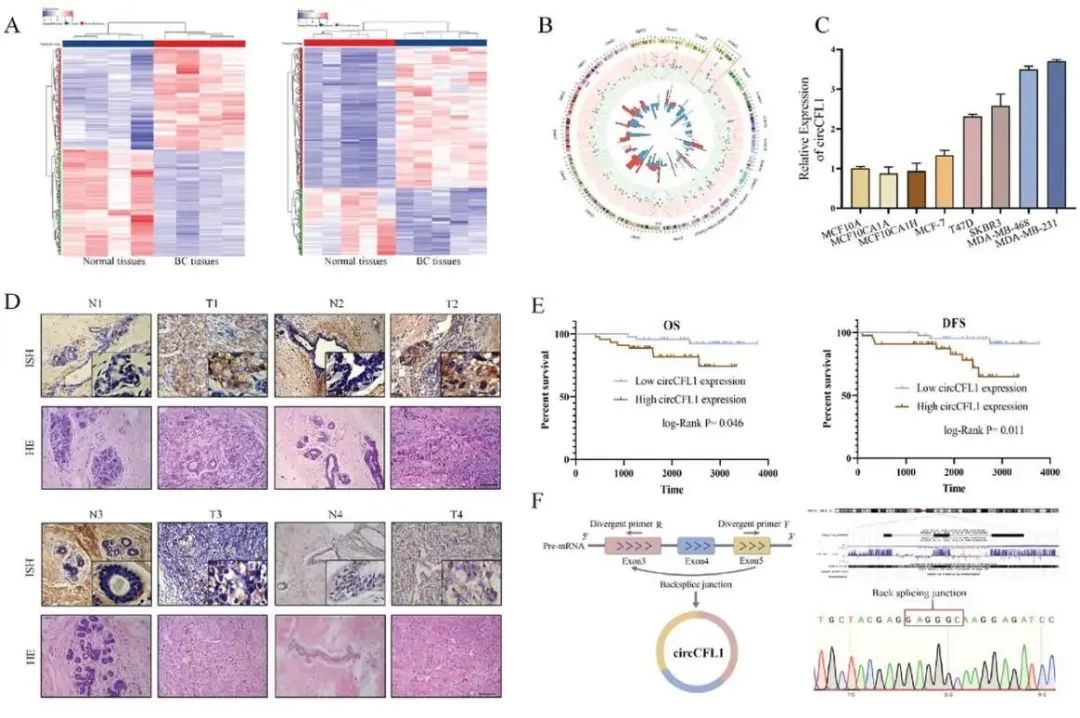
circCFL1 表达在 TNBC 患者中上调,与患者预后不良相关(图源自Advanced Science )
环状RNA(circRNA)是一类新兴的内源性RNA转录物,其特征是共价闭环结构。与它们的线性对应物相比,环状RNA是由缺乏5' m7G帽和3' poly(A)尾的前体mRNA反向剪接产生的。由于其特殊的圆形结构,circRNA具有较长的半衰期、较强的进化保守性和对RNAse R酶切的抵抗力。此外,circRNA在真核生物中非常丰富,有些circRNA甚至比线性circRNA更丰富,这为其生物学功能奠定了基础。已经证明circRNA通过不同的机制发挥作用,例如作为miRNA海绵和与蛋白质相互作用。越来越多的研究强调,环状RNA在致癌和癌症发展中发挥着不可或缺的作用。例如,circ-TRIO通过海绵化miR-432-5p促进TNBC的进展,circRNA-CREIT可以促进PKR和HACE1之间的相关性。然而,环状RNA对TP53突变TNBC的影响尚未得到很好的评估,鉴定在TP53突变TNBC患者中发挥调节作用的环状RNA并阐明其潜在机制可能为治疗TP53突变TNBC患者提供新的定制靶点。
在该研究中,发现circCFL1(hsa_circ_0000328)在TNBC细胞和组织中都有高表达,其表达与TNBC患者的临床病理特征和预后密切相关。体外和体内实验表明,circCFL1在促进TNBC细胞的增殖、转移和干细胞化中起着至关重要的作用。在机制上,circCFL1可以作为支架加强组蛋白去乙酰化酶1(HDAC1)与c-Myc之间的相互作用,从而增强去乙酰化介导的c-Myc去泛素化,从而稳定其表达。此外,c-Myc通过直接结合mutp53的启动子区来促进mutp53的表达。此外,circCFL1促进TNBC细胞中PD-L1的表达,抑制CD8 T细胞的抗肿瘤免疫,这可能是抗PD-L1治疗的协同靶点。综上所述,研究发现提示了TNBC中mutp53调控的新机制,并为TNBC患者提供了一种新的预后生物标志物和治疗靶点。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404628


