Molecular Cancer:揭示RNA甲基化如何影响肿瘤免疫:从机制到治疗(综述)
时间:2024-06-29 06:03:14 热度:37.1℃ 作者:网络
引言
RNA甲基化是一种常见的转录后修饰,在研究领域中引起了广泛关注。它通过调节RNA剪接、翻译、运输和稳定性,对多种生物功能进行调控。值得注意的是,研究表明,RNA甲基化对肿瘤免疫具有显著影响。主要的RNA甲基化类型包括N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺嘌呤(m1A)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C)。RNA甲基化参与了肿瘤微环境(TME)的调控。通过影响RNA翻译和稳定性,RNA甲基化通过“写入者”、“擦除者”和“读取者”调节免疫细胞和免疫因子的失调。因此,RNA甲基化在调节肿瘤免疫和介导多种生物行为(包括增殖、侵袭、转移等)中起着关键作用。
6月20日Molecular Cancer发表的综述“The role of RNA methylation in tumor immunity and its potential in immunotherapy”,讨论了几种RNA甲基化的机制和功能,全面概述了它们在肿瘤微环境和免疫细胞中的生物作用和基本机制。通过探讨这些RNA修饰如何介导肿瘤免疫逃逸,还分析了它们在免疫治疗中的潜在应用,为RNA甲基化新靶点的识别和提高癌症免疫治疗效果提供新的见解和策略。
RNA修饰通过对RNA碱基和核糖的化学变化,显著影响基因表达。到目前为止,研究人员已经在各种RNA类别(包括原核生物和真核生物)中鉴定出了超过170种化学修饰。其中,RNA甲基化占所有RNA修饰的60%以上,在转录后基因调控中起着重要作用。主要的RNA甲基化形式包括N1-甲基腺嘌呤(m1A)、N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C),这表明它在塑造基因调控的复杂景观中具有广泛存在和重要意义。RNA甲基化由三类蛋白质介导:“写入者”催化甲基基团的添加;“读取者”识别这些修饰;“擦除者”去除这些修饰,每种蛋白质通过独特的机制发挥作用。这些蛋白质调节多种RNA类型和信号通路,包括mRNA、tRNA、长链非编码RNA(lncRNA)、小RNA(sRNA)等。
作为一个动态且可逆的过程,RNA甲基化调节着关键的生物过程,如剪接、翻译、运输和RNA稳定性。大量研究表明,RNA甲基化在多种癌症的发生和进展中起着至关重要的作用,包括乳腺癌、肺癌、结直肠癌(CRC)、肝细胞癌(HCC)、胃癌(GC)、食道癌(EC)、前列腺癌(PCa)、膀胱癌、卵巢癌、急性髓性白血病(AML)、胰腺癌等,凸显了它在恶性肿瘤中的关键作用。
近年来,许多研究强调了RNA甲基化与各种免疫过程之间的密切关联,特别是在肿瘤免疫背景下。此外,调控蛋白的异常表达与致癌活动和增强的转移特性有关。RNA甲基化还在维持肿瘤微环境(TME)的稳态和代谢重编程中起着关键作用,影响免疫细胞的功能。TME由包括免疫细胞、基质细胞、细胞外基质、血管和其他可溶性因子在内的复杂多细胞基质组成。RNA甲基化通过影响癌基因和转移能力,破坏TME的和谐,损害免疫细胞功能,从而促进肿瘤免疫逃逸。例如,m6A写入者METTL3已知维持高水平的糖酵解,并在HCC中诱导代谢重编程。这种酶还影响巨噬细胞极化、树突状细胞的活化、效应T细胞的分化和增殖以及免疫检查点的表达。这些相互作用展示了RNA甲基化如何将TME和免疫细胞与肿瘤免疫逃逸的机制联系起来。目前,研究人员正在探索可能抑制METTL3和其他RNA甲基化调节因子的潜在抑制剂,希望这些化合物能用于免疫治疗。

RNA甲基化是一种常见的转录后修饰(post-transcriptional modification),在基因表达调控中扮演着关键角色。近年来,研究人员发现,RNA甲基化不仅在正常生理过程中重要,而且在肿瘤的发生和发展中也起到关键作用。尤其是它在调控肿瘤免疫和免疫逃逸方面的功能,引起了广泛关注。
RNA甲基化的类型与机制
目前已知的RNA甲基化类型超过170种,其中最主要的包括N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺嘌呤(m1A)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C)。这些修饰通过特定的蛋白质进行调控:
写入者(Writers):如METTL3和METTL14等,催化甲基基团的添加。
擦除者(Erasers):如FTO和ALKBH5等,去除甲基基团。
读取者(Readors):如YTHDF1和IGF2BP1等,识别并结合甲基化修饰,调控RNA的功能。
其中,m6A是最常见的RNA甲基化形式,广泛存在于mRNA、rRNA、tRNA、长链非编码RNA(lncRNA)和小RNA(sRNA)中。m6A甲基化调控着RNA的剪接、翻译、稳定性和运输等关键生物过程。
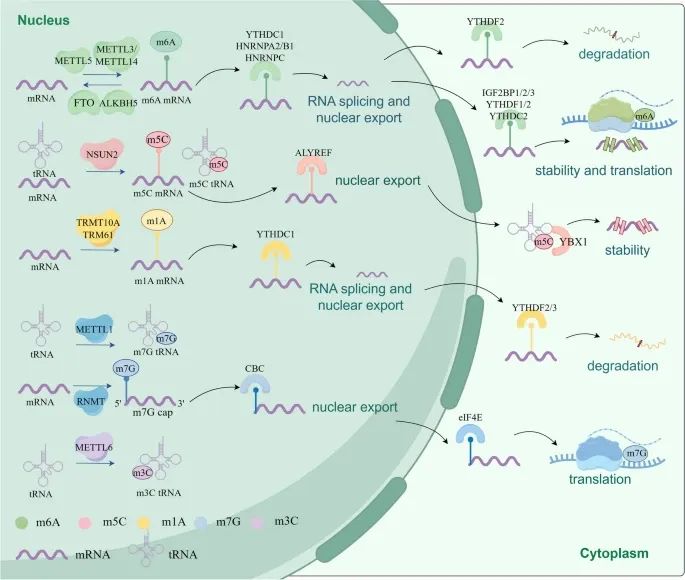
RNA甲基化的机制以及RNA甲基化如何调控RNA的命运和生物功能(Credit: Molecular Cancer)
RNA甲基化的写入者(Writers):m6A:METTL3和METTL14;m5C:NSUN2;m1A: TRMT10A;m7G:METTL1。
RNA甲基化的擦除者(Erasers):m6A:FTO和ALKBH5。
RNA甲基化的读取者(Readors):IGF2BP1/2/3、YTHDF1/2/3、YTHDC1/2/3、YBX1、ALYREF、CBC、eIF4E等蛋白质可以识别并结合RNA上的甲基化修饰。
RNA甲基化对RNA命运的调控:RNA甲基化可以调控mRNA的剪接、导出、稳定性、降解和翻译等生物功能。
关键蛋白:METTL3 (methyltransferase-like 3),FTO (obesity-associated protein),ALKBH5 (AlkB homolog 5),TET1/2/3 (ten-eleven translocation proteins 1/2/3),ALKBH1 (α-ketoglutarate-dependent dioxygenase ABH1)
RNA甲基化在肿瘤中的作用
大量研究表明,RNA甲基化在多种癌症的发生和进展中起着至关重要的作用。例如,m6A写入者METTL3在肝细胞癌(HCC)中维持高水平的糖酵解,并诱导代谢重编程。这种酶还影响巨噬细胞的极化、树突状细胞的活化、效应T细胞的分化和增殖以及免疫检查点的表达。
METTL3在HCC中的作用:研究表明,METTL3通过上调葡萄糖转运蛋白(GLUT1)的表达,促进糖酵解进程,从而为肿瘤细胞的增殖提供必要的能量条件。此外,METTL3还通过调控HIF-1α的表达,促进缺氧条件下肿瘤细胞的存活和增殖。
NSUN2在食道癌中的作用:NSUN2通过稳定GRB2的表达,增强癌细胞的增殖和迁移能力。另有研究表明,NSUN2能够通过调控CDKN1A的表达,抑制脂肪生成,表明NSUN2在肿瘤代谢重编程中也起到重要作用。
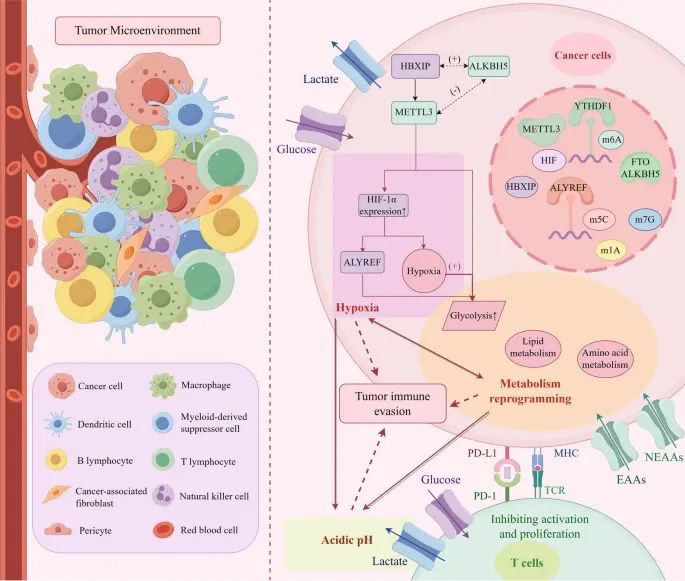
肿瘤微环境(TME)的组成以及RNA甲基化如何通过缺氧、代谢重编程和酸性环境来促进肿瘤免疫逃逸(Credit: Molecular Cancer)
肿瘤微环境的组成:肿瘤微环境包括免疫细胞、基质细胞、细胞外基质、血管和其他可溶性因子。
RNA甲基化在肿瘤免疫逃逸中的作用:缺氧诱导因子(HIF)通过m6A、m5C、m1A和m7G RNA甲基化来调控免疫抑制性TME的形成,并促进肿瘤免疫逃逸。RNA甲基化调控生物代谢,包括葡萄糖代谢、脂质代谢和氨基酸代谢,导致免疫细胞功能障碍和酸性环境的形成,从而促进肿瘤发生、血管生成和肿瘤细胞增殖。这些变化进一步加重组织缺氧,促进肿瘤进展。
代谢重编程与肿瘤进展:葡萄糖代谢:通过m6A、m5C、m1A和m7G RNA甲基化调控葡萄糖代谢途径,促进肿瘤细胞的糖酵解;脂质代谢:RNA甲基化调控脂质代谢,影响脂肪酸的合成、降解和储存,促进肿瘤细胞的膜结构和能量生成;氨基酸代谢:RNA甲基化调控非必需氨基酸(NEAAs)和必需氨基酸(EAAs)的代谢,影响肿瘤细胞的生长和免疫逃逸。
相互作用与协同作用:缺氧、代谢重编程和酸性环境相互作用,共同促进肿瘤免疫逃逸;缺氧环境激活HIF,进一步调控RNA甲基化,促进肿瘤进展;代谢重编程导致酸性环境的形成,影响免疫细胞功能,加剧肿瘤免疫逃逸。
RNA甲基化与肿瘤免疫
RNA甲基化在肿瘤免疫调控中发挥着重要作用。它通过影响肿瘤微环境(TME)中的免疫细胞和免疫因子的失调,调节肿瘤免疫逃逸机制。主要机制包括:
调控免疫细胞功能:RNA甲基化通过调控免疫细胞如巨噬细胞、树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的功能,影响肿瘤免疫逃逸。例如,m6A写入者METTL3促进巨噬细胞的M1极化,增强其抗肿瘤能力,而FTO则通过抑制NF-κB信号通路,抑制M1和M2巨噬细胞的极化。
调控TME稳态:RNA甲基化通过调控糖酵解、脂肪代谢和氨基酸代谢,影响TME的代谢重编程,进而影响肿瘤免疫。例如,METTL3通过上调GLUT1的表达,促进糖酵解进程,为肿瘤细胞的增殖提供条件。
调控免疫检查点:RNA甲基化通过调控免疫检查点如PD-1/PD-L1的表达,影响肿瘤免疫逃逸。研究表明,m6A读取者YTHDF1在DCs中上调MHC-II的表达,增强抗原呈递能力,从而增强免疫反应。
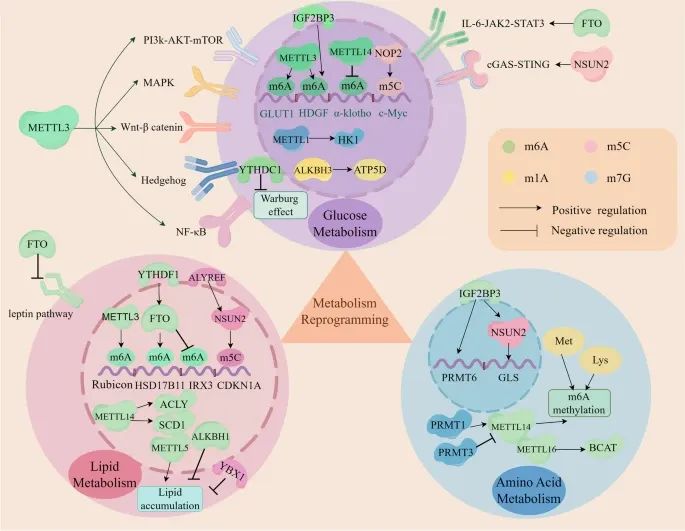
RNA甲基化如何参与肿瘤微环境(TME)的代谢重编程,包括葡萄糖代谢、脂质代谢和氨基酸代谢(Credit: Molecular Cancer)
RNA甲基化在代谢重编程中的作用:RNA甲基化调控与糖酵解相关基因(如GLUT1、Gys2、HDGF)和信号通路(如PI3K-AKT、mTORC1、MAPK、Wnt-β catenin、Hedgehog、NF-κB、IL-6/JAK2/STAT3、cGAS/STING)的表达,通过这些调节因子(如METTL1、METTL3、METTL14、NOP2、NSUN2、FTO、ALKBH3、IGF2BP3、YTHDC1)增强Warburg效应。
葡萄糖代谢:m6A、m5C和m7G甲基化通过调控糖酵解相关基因和信号通路,促进葡萄糖代谢。例如,METTL3通过上调GLUT1的表达,增强糖酵解进程。
脂质代谢:m6A和m5C甲基化加速脂质积累。具体而言,m6A和m5C甲基化调控脂质代谢相关基因(如ACLY和SCD1)的表达,促进脂肪酸的合成和储存。
氨基酸代谢:m6A、m5C和m7G甲基化调控谷氨酰胺、精氨酸、蛋氨酸和赖氨酸的代谢。例如,BCAT1(支链氨基酸转氨酶1)在AML中通过重编程BCAA代谢促进癌症发生。
代谢重编程的影响:这些甲基化修饰影响肿瘤细胞的免疫原性、增殖、免疫逃逸以及肿瘤进展。例如,m6A读取者IGF2BP3通过稳定PRMT1 mRNA,调控蛋白精氨酸甲基转移酶1(PRMT1)的表达,从而影响肿瘤细胞的功能。
YTHDF1在DCs中的作用:通过敲除YTHDF1基因,研究人员发现DCs中的MHC-II表达显著增加,IL-12的分泌也有所增强,从而提升了适应性免疫反应。
METTL3在MDSCs中的作用:研究发现,敲除METTL3基因能够显著减少MDSCs的积累,从而增强CD8+ T细胞的活化和增殖。
FTO在肿瘤中的作用:FTO抑制剂能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+ T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。
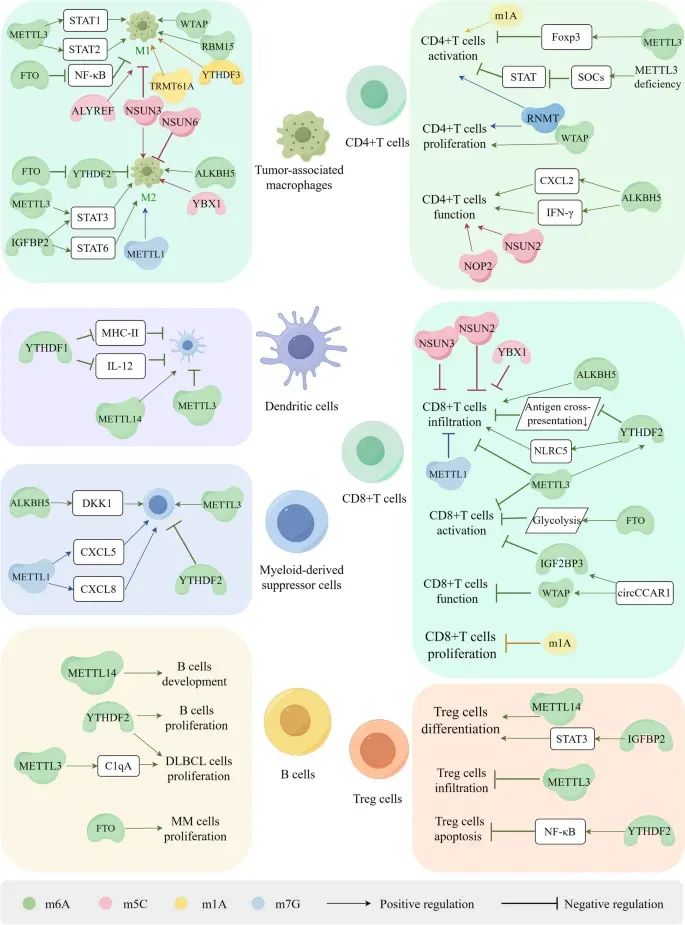
RNA甲基化如何在肿瘤微环境(TME)中调控免疫细胞的生物功能,包括免疫细胞的分化、发育、浸润、活化、增殖和凋亡(Credit: Molecular Cancer)
免疫细胞的分化和发育:RNA甲基化在免疫细胞的分化和发育中起重要作用。例如,m6A和m5C甲基化调控CD8+ T细胞的浸润和活化,并介导其功能障碍。
肿瘤相关巨噬细胞(TAMs)的极化:RNA甲基化促进肿瘤相关巨噬细胞(TAMs)向M1型或M2型巨噬细胞的极化;TAMs的M1型巨噬细胞具有抗肿瘤作用,而M2型巨噬细胞则具有促肿瘤作用。
树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的增殖和浸润:RNA甲基化调控树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的增殖和浸润。例如,m6A甲基化通过调控DCs的抗原呈递能力,影响免疫反应。
T细胞的分化和发育:RNA甲基化在T细胞的分化和发育中起重要作用。m1A和m7G甲基化参与CD4+ T细胞和CD8+ T细胞的活化、浸润和增殖,但这些过程中m1A和m7G的具体调控机制尚需进一步研究。
RNA甲基化在肿瘤免疫反应和逃逸中的作用:RNA甲基化通过影响免疫细胞的分化、发育、浸润、活化、增殖和凋亡,调控肿瘤免疫反应和逃逸。例如,m6A和m5C甲基化通过抑制CD8+ T细胞的浸润和活化,介导其功能障碍,从而促进肿瘤免疫逃逸。
RNA甲基化在免疫治疗中的潜力
随着对RNA甲基化在肿瘤免疫调控中作用的深入研究,研究人员开始探索其在免疫治疗中的应用潜力。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。
靶向METTL3:研究发现,抑制METTL3的表达能够显著减少MDSCs的积累,从而增强CD8+ T细胞的活化和增殖。靶向METTL3的抑制剂有望成为一种新的免疫治疗手段。
靶向FTO:FTO作为一种去甲基酶,其抑制剂已被证明能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+ T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。
靶向YTHDF1:抑制YTHDF1的表达能够增强树突状细胞的抗原呈递能力,从而增强免疫反应。研究表明,YTHDF1抑制剂有望提高癌症患者对免疫治疗的响应率。
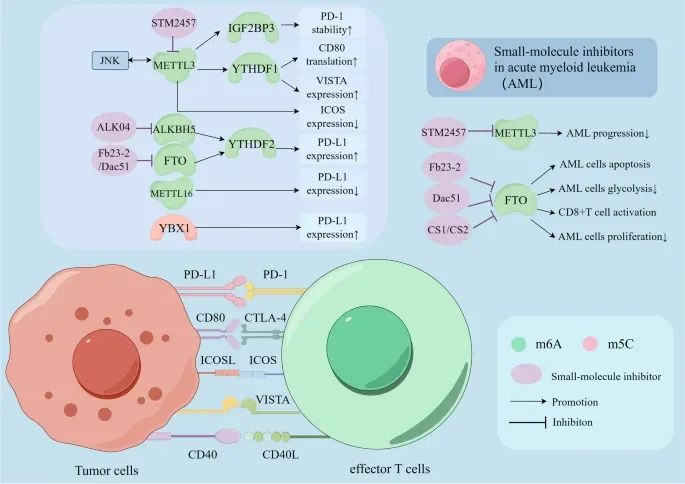
RNA甲基化如何通过其调控因子调节免疫检查点的表达,并且在急性髓性白血病(AML)中,几种小分子抑制剂联合免疫检查点阻断疗法的应用(Credit: Molecular Cancer)
共抑制性受体-配体复合物:包括PD-1/PD-L1、CTLA-4/CD80、VISTA等。这些复合物通过与肿瘤细胞上的相应配体结合,向T细胞传递负性信号,从而抑制T细胞的抗肿瘤反应。
共刺激性受体-配体复合物:包括CD40/CD40L、ICOS/ICOSL等。这些复合物通过与肿瘤细胞上的相应配体结合,向T细胞传递正性信号,从而增强T细胞的抗肿瘤反应。
RNA甲基化调控免疫检查点的机制:m6A和m5C甲基化通过调控免疫检查点的表达、翻译和稳定性,影响其对免疫治疗的敏感性。例如,免疫检查点PD-1、CTLA-4、ICOS、VISTA和CD40L通过与肿瘤细胞上的相应配体结合,触发T细胞反应的负性或正性信号。
RNA甲基化的调控因子:参与调控免疫检查点的RNA甲基化调控因子包括METTL3、ALKBH5、FTO和METTL16等。这些调控因子通过调节m6A和m5C甲基化,影响免疫检查点的功能。
小分子抑制剂的应用:针对METTL3和FTO的几种小分子抑制剂,包括STM2457、Alk-04、FB23-2和Dac51等,可以抑制m6A甲基化过程,并应用于AML的治疗。这些小分子抑制剂联合免疫检查点阻断疗法,有望提高AML患者的治疗效果。
RNA甲基化在肿瘤免疫中的作用及其在免疫治疗中的潜力正逐渐被揭示。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。未来的研究需要进一步探索RNA甲基化在肿瘤免疫中的具体机制,并开发更多的RNA甲基化调控剂,以期在临床上取得突破。
参考文献
Li Y, Jin H, Li Q, Shi L, Mao Y, Zhao L. The role of RNA methylation in tumor immunity and its potential in immunotherapy. Mol Cancer. 2024 Jun 20;23(1):130. doi: 10.1186/s12943-024-02041-8. PMID: 38902779; PMCID: PMC11188252.
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02041-8


