高参数流式方案引争议,光谱流式标准需统一
时间:2024-06-27 14:03:29 热度:37.1℃ 作者:网络
近日,国际著名期刊Cytometry Part A杂志针对发表于2020年12月的一篇43色光谱流式文章发布了关注表达(Expression of Concern)(原文地址:https://doi.org/10.1002/cyto.a.24850)。关注表达中提到,业内组织对该文章数据的正确性和再现性方面提出了质疑,然而在调查过程中作者未对这些质疑进行有效答复,因此发布该关注表达,提醒读者谨慎看待这篇文章。
受到质疑的文章题为“Development of a 43 color panel for the characterization of conventional and unconventional T-cell subsets, B cells, NK cells, monocytes, dendritic cells, and innate lymphoid cells using spectral flow cytometry”,文章通讯作者是Kodappully Sivaraman Siveen,为卡塔尔哈马德医疗集团流式中心负责人。该文章使用42种荧光标记单克隆抗体和1种能区分死细胞和活细胞的荧光染料对人PBMC细胞进行染色,使用光谱流式细胞仪进行细胞亚群检测,以求在一个样本中能检测人外周血中的大部分免疫细胞群体,包括T细胞、B细胞、NK细胞、DC细胞等。该方案是国际上首个超过40色的方案,因此发表之初受到广泛关注。然而,从本次发布的关注表达来看,该文章受到了业内的质疑,主要在以下5个方面:
一、 对于Panel设计和分析优化,作者没有提供足够的信息,涉及荧光染料选择、溢出扩散特征、解析对照的优化、解析准确度以及单色对照与多色管中相应标记物之间的分辨率差异的标准。
二、 文中提到方案设计算法但并没有解释其意义和相关性。
三、 某些情况下,圈门策略不标准,圈门的位置随意。
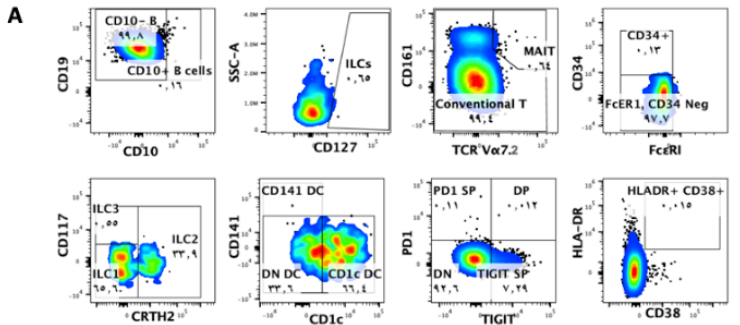
补充图1(局部):CD10、CD127、TCR Vα7.2、CD34、CD117、CD141、PD1和CD38的FMO对照
四、 正常供体数据的某些群体异常,可能是由于对群体标记不准确、数据质量差或不熟悉分析工具导致的。例如,文章中说明样本来源为健康人群,但标注为MAIT细胞的群体比例过高,以及单核细胞和树突细胞的群体过于靠近。

补充图2(局部):opt-SNE和UMAP降维图上叠加手动圈门的主要免疫细胞亚群
五、 对结果图片和补充数据的讨论不准确或解释过度,特别是关于在将全染样品与单染样品进行比较时,“使用高度重叠的染料获得令人满意的分辨率”的说法。例如,单染对照和全染样本的叠加图,很多通道上两种信号的重合度并不能令人满意。
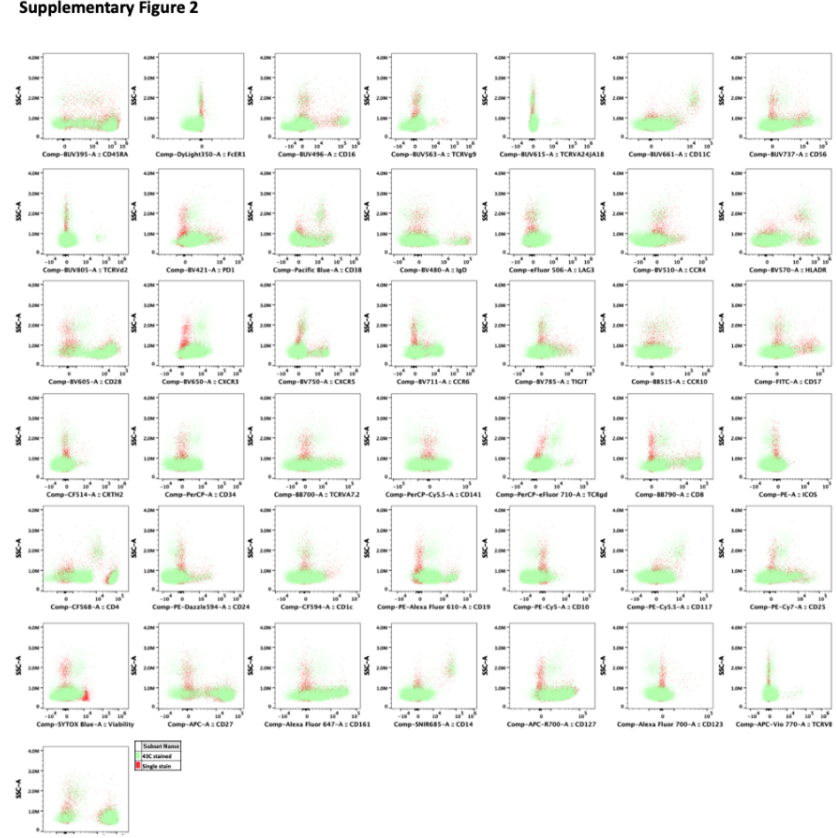
补充图3:42个表面标记物和SYTOX Blue Dead Cell Stain的单染对照与43色全染样本的叠加图
近年来,光谱流式成为免疫研究中的热门技术,高维多色流式实验受到广泛关注。在光谱流式推广之初,很多光谱厂商宣传的“设置简单、无需补偿”等概念给科研界带来深刻印象,似乎有了光谱流式仪器后,高维多色实验将会变得很简单。然而事实并非如此。从Cytometry Part A的OMIP多色专栏对光谱数据的要求中可以看到,一个优秀的、可行的高维流式方案在前期搭建、中期优化、后期分析及解读上对操作人员提出了非常高的要求,科研工作者需要付出巨大的努力。很多科研工作者对笔者透露,光谱流式实验并非想象中的那样容易,在高维实验中存在比较高的门槛。如果实验室工作人员经验不足或者光谱流式厂家、试剂厂家的支持不到位,则获得一个优质的高维流式实验结果困难重重。
同时,市面上存在多个品牌的光谱型流式细胞仪,每个仪器型号的光谱算法均存在差异。例如,BD公司的图像光谱流式采用系统感知式加权最小二乘法解析,Sony公司的光谱流式采用加权最小二乘法解析,Cytek公司的光谱流式采用简单最小二乘法解析。由于光谱流式的算法缺乏统一标准,加之配色、优化、数据分析等过程影响因素众多,致使业内很多科学家对光谱流式数据的准确度和再现性存疑。所以统一光谱流式实验及数据解读标准势在必行。
注:关注表达(Expression of Concern)是SCI在处理存在问题、疑点或争议的论文时采取的一种中立的表达方式,旨在对外传达对论文内容的关注,确保学术的诚信度和准确性。


