Nature Medicine:前列腺癌治疗新篇章:PSCA-CAR T细胞疗法1期临床试验揭示初步成效
时间:2024-06-18 18:02:58 热度:37.1℃ 作者:网络
引言
转移性去势抵抗性前列腺癌(mCRPC)是一种致命性疾病,每年导致超过3万名美国男性死亡。尽管近年来在治疗方面取得了一些进展,免疫治疗在该领域的应用仍然受到限制。传统的免疫治疗方法,如疫苗策略(GVAX和Prost-VAC)和免疫检查点抑制剂(CTLA-4和PD-1抑制剂)均显示出有限的疗效。唯一被证实可以延长mCRPC患者生存期的免疫治疗是sipuleucel-T,这是一种自体细胞免疫疗法,通过体外培养的树突状细胞激活前列腺酸性磷酸酶。然而,现有的免疫疗法仍需显著改进,以更有效地针对mCRPC。
前列腺癌对免疫治疗反应不佳的原因是多方面的,包括在晚期前列腺癌中存在强烈的免疫抑制,这限制了效应T细胞在局部肿瘤微环境中的运输和功能。然而,mCRPC中存在一些独特的肿瘤相关抗原,如前列腺干细胞抗原(PSCA)和前列腺特异性膜抗原(PSMA),这些抗原在肿瘤中普遍且强烈表达,可以作为细胞免疫疗法的有力靶点。嵌合抗原受体(CAR)T细胞疗法在血液恶性肿瘤中已经展示了持久的缓解效果,这激发了针对mCRPC的CAR T细胞疗法的临床开发。
PSCA在前列腺癌中的高表达,特别是在骨转移的情况下,使其成为一个有吸引力的治疗靶点。在异种移植和同系肿瘤模型中,第二代PSCA-CAR T细胞与4-1BB共刺激的组合被证明在根除骨转移前列腺癌方面具有安全性和有效性。6月12日 Nature Medicine的报道“PSCA-CAR T cell therapy in metastatic castration-resistant prostate cancer: a phase 1 trial”,报告了首次在人类中进行的1期临床试验结果,评估了PSCA-CAR T细胞在mCRPC患者中的安全性和生物活性。
该研究的主要终点是安全性和剂量限制性毒性(DLTs),次要终点包括CAR T细胞在外周血中的扩展和持久性(定义为外周血中总CD3+细胞中CAR T细胞的比例,或通过qPCR检测的DNA中至少7.5个拷贝),疾病反应(前列腺特异性抗原(PSA)下降和实体瘤的RECIST评估)以及生存率(定义为治疗6个月后仍存活的参与者比例)。探索性终点包括治疗前后外周血中免疫细胞亚群的表型和频率、血清细胞因子谱和肿瘤浸润淋巴细胞的表型变化等。
该研究结果支持未来的临床研究,以优化剂量和组合策略,进一步改善mCRPC患者的持久治疗效果。

该研究是一项由City of Hope进行的单中心、首次在人类中进行的1期临床试验,旨在评估PSCA-CAR T细胞在mCRPC患者中的安全性和生物活性。
在该研究中,共有58名参与者接受了PSCA表达的免疫组化(IHC)筛查,筛查标准为肿瘤细胞中PSCA表达比例至少为30%。其中,22名参与者进行了白细胞去除术(leukapheresis)并接受了CAR T细胞制造。最终,有14名参与者接受了CAR T细胞输注。这些参与者的中位年龄为62岁(DL1),70岁(DL2),和69岁(DL3),所有参与者之前均接受过雄激素受体信号抑制剂治疗,如enzalutamide和abiraterone。
临床试验设计包括三个剂量水平(DL):
DL1:100百万(M)PSCA-CAR T细胞,无淋巴清除(LD)。
DL2:加入LD后的100M PSCA-CAR T细胞。
DL3:减少LD后的100M PSCA-CAR T细胞。
在试验中,参与者被分为三个剂量水平进行治疗。每个剂量水平的治疗和监测过程包括CAR T细胞制造、输注前后的生物样本采集、成像检查和长期随访。
PSCA-CAR构建包括抗PSCA人源化单链抗体(scFv)、ΔCH2细胞外间隔区、CD4跨膜区、4-1BB胞内共刺激区和CD3ζ胞内区。CAR T细胞制造过程包括CD14+和CD25+细胞的去除、CD3/28珠刺激、使用慢病毒进行转导、珠移除和细胞扩展。最终产品中CAR细胞的中位比例为86.8%。
CAR T细胞产品经过解冻后,通过流式细胞术表征CD4/CD8、CD19(转导标记物)和Fc(PSCA-CAR)表达,以及T细胞亚群的表型。
所有参与者在接受CAR T细胞输注后需要住院至少7天,并在输注后的28天内需要一名全职护理人员随时照顾,并需在癌症中心附近40分钟内居住。
治疗过程中,通过流式细胞术和定量PCR检测外周血中的CAR T细胞扩展和持久性。每两周测量一次PSA水平,并在输注后的28天、60天和90天,以及每12周进行成像检查(CT和骨扫描)和随访。
毒性按照《不良事件常见毒性标准》(CTCAE)4.0版进行分级。DLT定义为与CAR T细胞相关的3级或更高级别的毒性。主要关注的毒性包括器官毒性、自身免疫毒性和3级或更高级别的血液学毒性。研究期间未观察到3级或以上的细胞因子释放综合征(CRS)事件。
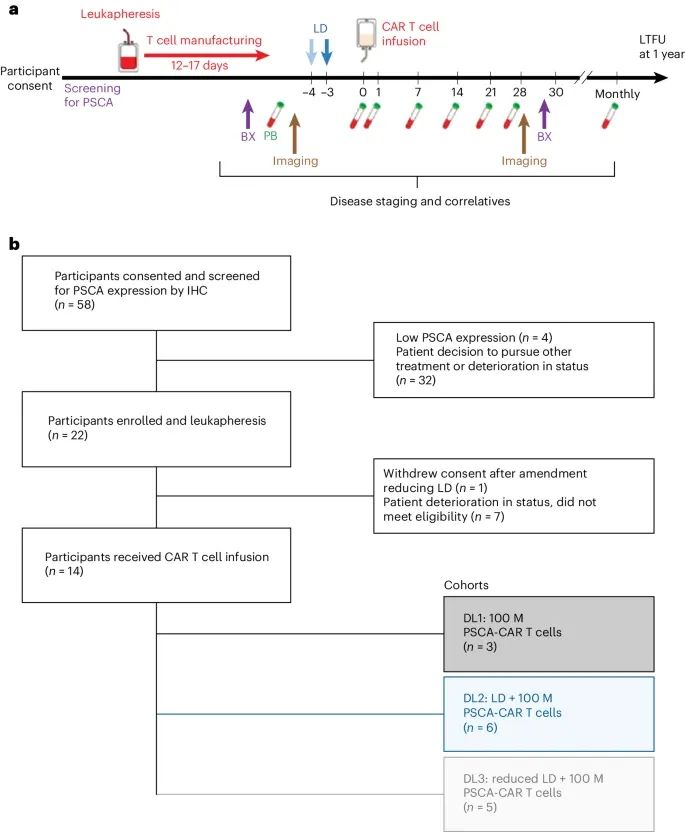
临床试验设计和CONSORT图(Credit: Nature Medicine)
临床试验设计
包括参与者筛选、白细胞去除术(leukapheresis)、PSCA-CAR T细胞制造、输注前后的生物样本采集、成像检查和长期随访。这些步骤确保了每个参与者在不同治疗阶段的严格监测。
参与者筛选和登记
筛选过程:58名参与者接受了PSCA表达的免疫组化(IHC)筛查,其中22名参与者符合条件进行了白细胞去除术,并最终有14名参与者接受了CAR T细胞输注。
登记过程:参与者在进行白细胞去除术和CAR T细胞制造之前,先进行PSCA表达的筛选。登记完成后,这些参与者被分配到不同的剂量水平(DL)进行治疗。
剂量水平和队列划分
DL1:100M PSCA-CAR T细胞,无淋巴清除(LD):共有3名参与者接受了DL1剂量水平的治疗。
DL2:加入LD后的100M PSCA-CAR T细胞:共有6名参与者接受了DL2剂量水平的治疗。
DL3:减少LD后的100M PSCA-CAR T细胞:共有5名参与者接受了DL3剂量水平的治疗。
患者特征和治疗方案
参与者的中位年龄分别为DL1组62岁,DL2组70岁,DL3组69岁。
所有参与者之前均接受过雄激素受体信号抑制剂治疗,包括enzalutamide(71%)和abiraterone(79%)。
大多数患者在CAR T细胞输注前接受过化疗药物cabazitaxel(57%)和docetaxel(86%)。
基线PSA中位值从16.5到235.3不等。
剂量限制性毒性(DLTs)
在DL1组(100M PSCA-CAR T细胞无LD),未观察到任何DLTs。
在DL2组(加入LD后的100M PSCA-CAR T细胞),观察到一例3级膀胱炎的DLT,导致研究设计加入了使用减少LD方案的DL3组。
在DL3组(减少LD后的100M PSCA-CAR T细胞),未观察到任何DLTs。
细胞因子释放综合征(CRS)
14名接受治疗的患者中,有5名患者出现了1或2级的CRS。
CRS的中位发生时间为输注后4天(范围为3-8天),未出现3级或以上的严重CRS事件。
前列腺特异性抗原(PSA)反应
14名患者中有4名患者的PSA水平下降超过30%。
在DL2组的一名患者在PSCA-CAR T细胞输注后的28天内PSA水平下降超过90%,其软组织转移病灶也出现了显著的影像学改善。
CAR T细胞持久性和扩展
在有LD的剂量水平(DL2和DL3)中,CAR T细胞扩展较DL1(无LD)显著增加。
DL3组的减少LD方案在扩展CAR T细胞的同时,降低了CRS相关和非肿瘤相关的毒性。
该研究的结果表明,PSCA-CAR T细胞疗法在mCRPC患者中表现出了一定的生物活性和初步的临床有效性,尽管存在一些靶向毒性问题。减少LD剂量在降低毒性的同时,仍能增强CAR T细胞在外周血中的扩展。未来的研究可探讨多剂量和联合策略,以提高CAR T细胞的持久性,从而提高患者的临床反应。
尽管该研究的参与者数量较少,但结果验证了PSCA作为CAR T细胞治疗的可行靶点,并提供了鼓舞人心的早期临床数据,支持进一步的研究。随着研究的深入,新的剂量和联合策略的应用,有望显著改善mCRPC患者的治疗效果。
此外,CAR T细胞疗法在固体肿瘤中的应用与在血液恶性肿瘤中的应用有所不同,前处理方案(LD)的作用在固体肿瘤中可能更为复杂。未来的研究可进一步探讨不同的LD方案,以及CAR T细胞持久性的增强策略,以期实现更长久的抗癌疗效。
原文链接
Dorff TB, Blanchard MS, Adkins LN, Luebbert L, Leggett N, Shishido SN, Macias A, Del Real MM, Dhapola G, Egelston C, Murad JP, Rosa R, Paul J, Chaudhry A, Martirosyan H, Gerdts E, Wagner JR, Stiller T, Tilakawardane D, Pal S, Martinez C, Reiter RE, Budde LE, D'Apuzzo M, Kuhn P, Pachter L, Forman SJ, Priceman SJ. PSCA-CAR T cell therapy in metastatic castration-resistant prostate cancer: a phase 1 trial. Nat Med. 2024 Jun 12. doi: 10.1038/s41591-024-02979-8. Epub ahead of print. PMID: 38867077.
https://www.nature.com/articles/s41591-024-02979-8


