癌症中的蛋白质脂质化:从机制到药物靶点
时间:2024-06-14 19:00:36 热度:37.1℃ 作者:网络
前言
蛋白质脂质化是一类不同的翻译后修饰(PTM),由40多种酶调节,靶向3000多个位点的1000多种底物。脂质蛋白包括150多种癌蛋白,涉及癌症起始、进展和免疫的介质、受体激酶、转录因子、G蛋白偶联受体和细胞外信号蛋白。脂质化调节其蛋白质底物与细胞膜的物理相互作用,调节蛋白质信号传导和运输,并在代谢和免疫中发挥关键作用。
蛋白质脂质化可大致分为两种类型:组成型脂质化,其中脂质作为蛋白质合成或成熟的组成部分附着;以及动态脂质化,例如在信号级联过程中,从成熟蛋白质中动态添加或去除脂质。对复杂和动态的蛋白质脂质化景观进行分析具有相当大的挑战,癌症中的脂质PTM及其失调为癌症药物发现提供了目前尚未开发的潜在靶点来源。因此,我们需要加强对癌症靶向蛋白脂质化途径的理解,推动靶向蛋白脂质化癌症药物的临床研究,提供靶向蛋白质脂质化的新型肿瘤疗法。
癌症中的S-丙烯酰化
S-丙烯酰化在蛋白质合成后迅速发生,并且是不可逆的,在蛋白质的一生中持续存在。这一过程是由四种蛋白质丙炔基转移酶,法尼基转移酶(FTase)和香叶基-香叶基转移酶I、II和III(GGTase I–III),在C末端或附近的半胱氨酸残基上添加类异戊二烯脂质引发的。
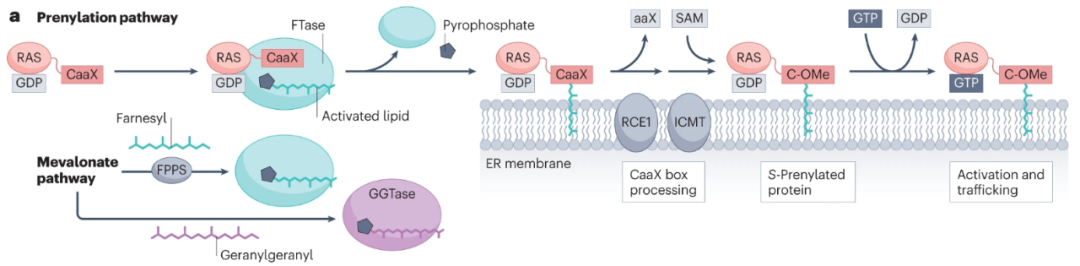
最突出的丙酰化癌蛋白是四种RAS亚型(KRAS4A、KRAS4B、NRAS和HRAS),约占19%的突变癌症患者,尤其是那些对治疗最具耐药性的患者。有证据表明,在健康人和疾病患者中,异戊二烯化参与了这些癌蛋白的调节。RAS激活突变普遍保留了膜定位和致癌信号传导所需的CaaX盒预酰化位点,以及KRAS4A、NRAS和HRAS的二次棕榈酰化所需的位点。异丙基半胱氨酸羧甲基转移酶(ICMT)对丙酰化修饰的进一步处理影响RAS蛋白定位和RAS-驱动的恶性转化。最近的研究表明,ICMT还可能有助于癌症细胞增殖和存活、DNA损伤修复、干性和自我更新。
通过靶向脂质化破坏RAS定位和下游信号传导已被广泛研究作为靶向RAS突变体的一种方法。2020年,FTase抑制剂(FTI) lonafarnib成为首个获批的抗蛋白质-脂质转移酶的药物,靶向罕见病早衰亚型中层粘连蛋白a法尼酰化的异常保留。此外,FTI tipifarnib已被授予针对携带HRAS突变的HNSCC的突破性疗法。不幸的是,由于剂量限制、靶向血液毒性和耐药性,II期临床试验中最初表现出的高反应率很短暂。为了降低耐药性,目前正在研究联合疗法。此外,一种GGTase I抑制剂(GGTI-2418,也称为PTX-100)已进入T细胞淋巴瘤(NCT03900442)的Ib期临床试验。
癌症中N-肉豆蔻酰化
N-肉豆蔻酰化是一种不可逆的C14:0脂质PTM,由N-肉豆蔻基转移酶(NMT)催化,从肉豆蔻基CoA(Myr-CoA)转移到人类蛋白质组中200多种底物蛋白的N-末端甘氨酸。肉豆蔻酰化可以介导动态膜结合,触发次级PTM(如S-酰化)和蛋白质相互作用,调节蛋白质复合物的酶活性,或变构调节可溶性蛋白质。
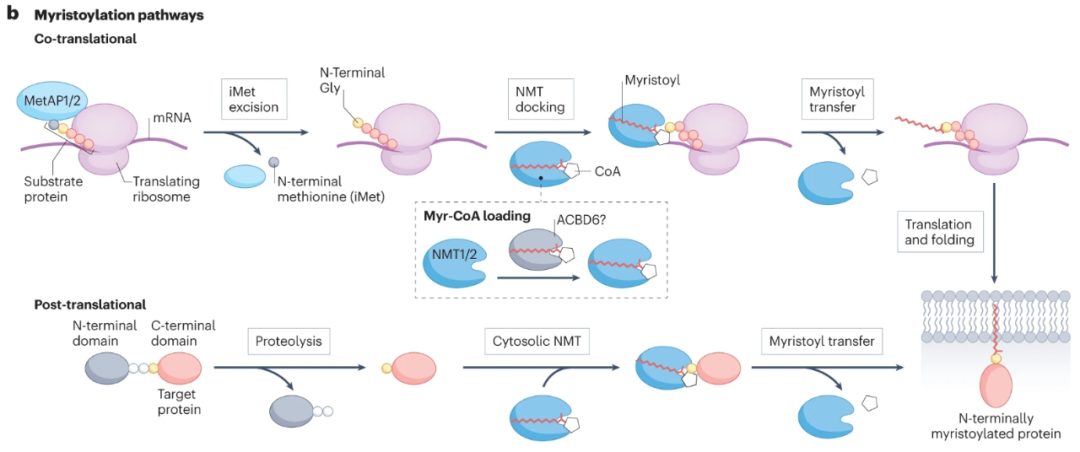
SRC家族激酶是NMT的首批鉴定底物之一,随后的研究表明,NMT通过多种致癌途径调节底物。例如,肉豆蔻酰化将脱铁抑制蛋白1(FSP1)靶向膜,在膜中它防止氧化脂质物质的积累。NMT底物包括传统方法无法治疗的致癌蛋白家族,包括ADP核糖基化因子蛋白(ARFs)、ARF样蛋白(ARLs)和高尔基体重组堆叠蛋白(GOASP),它们调节ER–高尔基体运输,参与线粒体复合体I组装等。
asciminib是一种口服给药的小分子选择性变构抑制剂,靶向BCR-ABL1酪氨酸激酶的肉豆蔻酰口袋,由诺华制药研发,主要用于费城染色体阳性(Ph+)慢性粒细胞白血病(CML)。于2021年获得FDA批准,在激酶抑制剂耐药性癌症中显示出疗效,并在临床试验中显示出持久的反应(NCT02081378,NCT03106779)。
NMT活性也可以直接靶向,为对抗多种其他不可治疗的癌蛋白提供了一个独特的干预点,这些癌蛋白汇聚在调节蛋白质合成的途径上。来自几项体外和体内研究的证据,包括膀胱癌和B细胞淋巴瘤的异种移植物模型,以及肺癌的同基因小鼠模型中,抑制NMT通过LAMTOR1的功能丧失诱导肿瘤细胞中的蛋白质合成阻断。
最后,NMT抑制剂偶联的抗体偶联药物(ADC)显示出显著的提高疗效和耐受性的潜力,最近在乳腺癌、胃癌和前列腺癌的异种移植物模型中报道了肿瘤的完全消退。这些数据表明,NMT抑制剂的靶向递送可能扩大靶向癌症范围。
癌症中的S-棕榈酰化
在人类中,S-棕榈酰化由ZDHHC家族中的23种蛋白质催化,其去除可由丝氨酸水解酶超家族的多种APT催化,包括APT1、APT2和含有α/β水解酶结构域(ABHD)的蛋白质ABHD17A、ABHD17B、ABHD17 C和ABHD10,使S-棕榈酰化成为一类独特的可逆和动态的蛋白质脂质化。
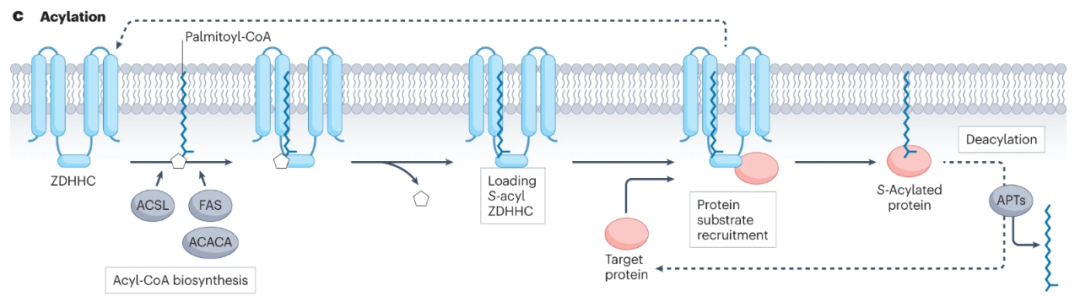
在超过100项蛋白质组学和生物化学研究中,超过2400种哺乳动物蛋白质发生棕榈酰化。这些蛋白质包括整合膜蛋白、外周膜蛋白、细胞质信号蛋白和转录因子。包括NRAS、KRAS4A、HRAS、EGFR和p53在内的癌蛋白依赖于S-棕榈酰化循环来调节其定位、活性或相互作用因子,已知大于150种癌蛋白是S-棕榈酰酸化的。
棕榈酰化是致癌激酶的重要调节因子,包括肝细胞生长因子受体酪氨酸激酶MET,其中ER中的棕榈酰化对运输、稳定性和表达是很重要的。此外,有证据表明,EGFR信号传导对其棕榈酰化有促进和抑制作用,这可能是由于存在多个棕榈酰化位点,这些位点由不同的ZDHHC蛋白调节,并具有不同的功能效应。棕榈酰化还调节G蛋白偶联受体的活性,包括黑素皮质素-1受体(MC1R)的活性,后者在紫外线照射后驱动黑色素的产生和DNA修复。因此,棕榈酰化受损的MC1R会增加黑色素瘤的风险。
S-棕榈酰化与癌症治疗的耐药性也有关。例如,ZDHHC2介导的线粒体酰甘油激酶(AGK)的棕榈酰化通过激活AKT–mTOR信号增加肾细胞癌中舒尼替尼的耐药性,而ZDHHC16介导的PCSK9的棕榈酰基化通过激活PI3K–AKT途径诱导癌症中索拉非尼的耐药性。
转录增强相关结构域(TEAD)蛋白在Hippo信号传导下游调节细胞生长和增殖。GNE-7883是最近报道的一种优化的TEAD棕榈酰化抑制剂,它强烈抑制YAP/TAZ与所有四个TEAD家族成员(TEAD1–4)的结合,并在NSCLC的患者衍生异种移植物模型中逆转Hippo驱动的对KRAS-G12C抑制剂的内在和获得性耐药。第一批进入间皮瘤I期临床试验的TEAD自棕榈酰化抑制剂显示出良好的耐受性和抗肿瘤活性(NCT05228015和NCT04665206)。
小结
调节蛋白质脂质化为我们提供一种独特的方法,通过控制其膜结合、运输、蛋白质稳定性和蛋白质-蛋白质相互作用,靶向其他难以治疗的癌蛋白。随着我们对癌症中蛋白质脂质化相关性认识的发展,新的治疗机会可能会出现。
参考文献:
1.Protein lipidation in cancer: mechanisms, dysregulation and emerging drug targets. Nat Rev Cancer.2024 Feb 29


