Sci Adv:许川/卞修武团队合作发现HMMR通过灭活吞噬细胞触发肝癌的免疫逃避
时间:2024-06-11 06:00:23 热度:37.1℃ 作者:网络
肝细胞癌(HCC)获得免疫抑制微环境,导致不利的治疗结果。透明质酸介导的运动受体(HMMR)在肿瘤进展中起着至关重要的作用。HMMR的异常表达可能是HCC免疫抑制微环境的预测性生物标志物,但其机制尚不清楚。
2024年6月5日,电子科技大学许川及陆军军医大学卞修武共同通讯在Science Advances 在线发表题为“HMMR triggers immune evasion of hepatocellular carcinoma by inactivation of phagocyte killing”的研究论文,该研究建立了一个HMMR-/-肝癌小鼠模型来阐明HMMR介导的失调“不要吃我”信号的机制。敲除HMMR抑制肝癌生长并诱导吞噬。
HMMRhigh肝癌细胞通过维持CD47信号从吞噬中逃脱。HMMRhighCD47high表达患者预后较HMMRlowCD47low表达患者差。HMMR在细胞质中与FAK/SRC形成复合物,激活NF-κB信号,该信号可能不依赖于膜与CD44的相互作用。值得注意的是,靶向HMMR可以通过募集CD8+ T细胞来提高抗PD-1的治疗效率。总的来说,该研究揭示了“不要吃我”信号的调控机制和HMMR的下调,以增强抗PD-1治疗。

肝细胞癌(HCC)是一种由肝细胞转化而来的原发性肝癌,是全球癌症相关死亡的第三大原因,占原发性肝脏恶性肿瘤的80%。一线治疗反应差,死亡率高,5年生存率低于12%。大量肿瘤相关巨噬细胞(TAM)浸润的免疫抑制微环境被认为是治疗失败的主要因素;因此,减少TAM以增强抗肿瘤活性是HCC治疗的重要治疗策略。迄今为止,一系列证据表明,细胞表面分子向先天免疫系统传递抗吞噬信号,即“不要吃我”信号,如CD47、SIRPG(5)、程序性细胞死亡蛋白1 (PD-1)、初级组织相容性I类复合体(B2M)的β -2微球蛋白亚基和CD24。然而,肿瘤细胞的复杂性和抗吞噬作用的治疗效果不佳表明存在额外的,目前尚不清楚的“不要吃我”信号。
透明质酸介导的运动受体(也被称为RHAMM)是一种致癌基因,与肺癌、乳腺癌和前列腺癌等多种癌症类型的侵袭性肿瘤生长和较差的患者生存率相关。尽管先前的研究描述了HMMR在透明质酸结合中的进化保守作用,但在缺乏透明质酸的多种物种中普遍存在的HMMR强烈表明,它也可能在生理病理调节中发挥多功能作用。例如,HMMR作为纺锤体组装因子(如TPX2、DYNLL1和CHICA/FAM83D)的结合伙伴,在有丝分裂和减数分裂过程中调节纺锤体微管的组装、稳定性和定位。
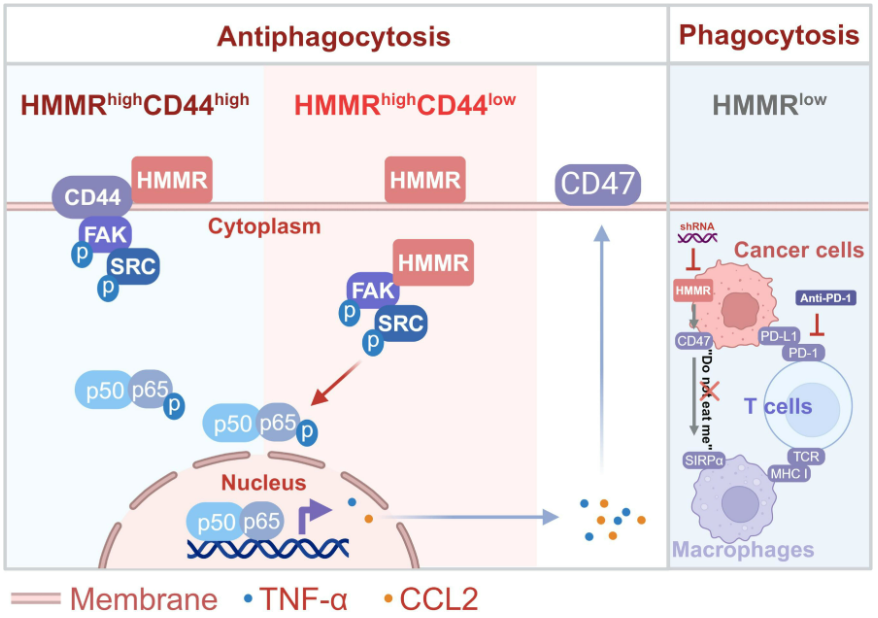
文章模式图(图源自Science Advances )
这些蛋白复合物在有丝分裂纺锤体的正确定向和建立调节癌细胞转移的细胞分裂轴方面是至关重要的。最近的研究也表明,HMMR在肺腺癌(LUAD)中的表达水平与中性粒细胞、CD8+ T细胞和CD4+ T细胞的浸润有显著的联系。然而,HMMR在巨噬细胞抗吞噬中的免疫调节作用及其潜在机制尚不清楚,需要深入了解。
该研究发现HMMR通过肝癌细胞的HMMR-CD47轴促进了抗吞噬效率。HMMR可以在细胞质中与FAK/SRC形成复合物,而不依赖于膜表达CD44,从而帮助免疫逃避吞噬细胞的杀伤。HMMR的缺失可能会阻断“不要吃我”信号,并使免疫检查点阻断抑制在HCC患者的癌症免疫治疗中变得敏感。
参考消息:
https://www.science.org/doi/10.1126/sciadv.adl6083


