4331份实体瘤样本揭示:除了胶质母细胞瘤,乳腺肉瘤样肿瘤也可存在EGFRvIII
时间:2024-06-10 13:00:30 热度:37.1℃ 作者:网络
表皮生长因子受体变异体III(EGFRvIII)是一种基因内EGFR::EGFR.E1E8融合,由6个外显子缺失和外显子1-8融合引起的。EGFRvIII常发生于胶质母细胞瘤(一种高级别脑肿瘤)。然而,其在其他实体瘤中的存在特征尚不明确。研究者回顾了2021年至2022年通过杂交捕获610基因NGS检测平台检测的4331例实体瘤病例,其中17例检测到EGFRvIII,包括16/238例(7%)脑肿瘤和1/301例(0.3%)乳腺肿瘤。EGFRvIII阳性脑肿瘤均为IDH1/2野生型的胶质母细胞瘤,大多数同时存在TERT启动子突变(14/16例)、EGFR扩增(13/16例)和EGFR突变(8/16例)。唯一一例EGFRvIII阳性的乳腺病变发生在一位年轻女性患者。在非该机构接受检测的另一例乳腺病例中报告了EGFRvIII,发生于一名年轻女性患者。2例EGFRvIII阳性的乳腺肿瘤均表现为高级别肉瘤样形态。总之,EGFRvIII罕见,主要发生于胶质母细胞瘤,罕见发生于乳腺肉瘤样肿瘤。这部分患者可能从化疗和/或靶向抗EGFR治疗中获益。
研究背景
表皮生长因子受体(EGFR)是ERBB蛋白家族的一种跨膜受体酪氨酸激酶,该家族还包括其他三个密切相关的受体:ERBB2、ERBB3和ERBB4。EGFR配体包括表皮生长因子、转化生长因子-α以及其他生长因子和配体。EGFR与细胞外配体结合后,与其他ERBB家族成员形成同源二聚体或异源二聚体,并变构激活其胞内受体激酶结构域。EGFR的激活启动下游细胞内信号传导,导致一系列效应,包括受控的细胞增殖、分化、迁移、黏附和凋亡。
EGFR扩增和EGFR过表达见于多种癌症类型,包括胶质母细胞瘤、非小细胞肺癌和乳腺癌。约50%的原发性胶质母细胞瘤患者发生EGFR扩增,而继发性胶质母细胞瘤患者的这一比例为8%,非小细胞肺癌患者为5%。在胶质母细胞瘤中,EGFR扩增与肿瘤细胞中增加的EGFR表达和EGFR免疫组织化学染色密切相关。EGFR基因突变见于多种类型的癌症,然而,不同类型肿瘤中EGFR的突变区域不同。在非小细胞肺癌中,最常见的激活突变是外显子21的L858R和外显子19的框内缺失,这两个外显子都位于细胞内激酶结构域内。相比之下,EGFR细胞外区的点突变,如R108K、A289V/D/T、G598D和其他细胞外区突变,在胶质母细胞瘤中普遍存在。这些细胞外结构域突变使EGFR保持活跃构象,据报道在24%的胶质母细胞瘤中存在。
在胶质母细胞瘤中也经常观察到EGFR结构变异,即由EGFR外显子缺失引起的一组基因内EGFR融合。胶质母细胞瘤中的EGFR剪接变异体包括EGFRvI(N端缺失)、EGFRvII(外显子14-15缺失)、EGFRvIII(外显子2-7框内缺失)、EGFRvIV(外显子25-27缺失)和EGFRvV(外显子25-58缺失);其中,EGFRvII和EGFRvIII已被证实具有组成性活性和致癌性。在胶质母细胞瘤中,EGFRvIII最常发生且常与晚期事件相关,发生于野生型EGFR扩增之后。EGFRvIII缺乏外显子2-7;这些外显子内267个氨基酸的缺失产生了一个与新的甘氨酸残基的连接位点,导致外显子1和8以及肿瘤特异性表位的框内融合。EGFRvIII持续激活,导致细胞内EGFR信号失调,导致肿瘤细胞生长和增殖失控,并对野生型EGFR治疗药物产生耐药。在30-40%的胶质母细胞瘤病例中,EGFRvIII与EGFR扩增相关,并且EGFRvIII的表达是生存至少1年的胶质母细胞瘤患者总体生存的一个负预后标志物。在这种情况下,直接靶向EGFR通路或激活针对EGFRvIII的免疫反应的特异性治疗方法最近已经开发出来,并已作为单一疗法或与标准替莫唑胺联合应用于临床试验。
虽然EGFRvIII在胶质母细胞瘤中已得到充分认识,但在其他实体瘤中检测EGFRvIII尚未得到充分确定。明确EGFRvIII在不同类型肿瘤中的分布可能有助于选择更有效的靶向治疗。NGS技术使快速准确鉴定EGFRvIII成为可能。本文描述了不同类型癌症患者的4331个样本中EGFRvIII的分布。
研究结果
实体肿瘤中的EGFRvIII:
在经NGS测序的4331例癌症中,观察到17例(0.4%)携带EGFRvIII:238例脑肿瘤中16例(7%);301例乳腺肿瘤中1例(0.3%);3792例其他类型恶性肿瘤中0例(0%),这些恶性肿瘤源自胃肠道、泌尿生殖系统、妇科、胸部、皮肤、头颈部和骨骼(图1)。在238例脑肿瘤中,有112例胶质母细胞瘤,其他126例脑肿瘤主要由IDH突变型星形细胞瘤和少突胶质细胞瘤构成。112例胶质母细胞瘤中,49例(44%)EGFR扩增,63例(56%)EGFR未扩增。112例胶质母细胞瘤中16例(14%)检测到EGFRvIII,49例EGFR扩增的胶质母细胞瘤中13例(27%)检测到EGFRvIII,63例EGFR非扩增的胶质母细胞瘤中3例(5%)检测到EGFRvIII。在其他脑肿瘤中未检测到EGFRvIII。剪接位点位于内含子1和内含子7,其中9例每个内含子有1个剪接位点,其余8例每个内含子至少有2个剪接位点。8例同时存在EGFR突变,13例同时存在EGFR扩增。17例EGFRvIII阳性病例的肿瘤突变负荷均较低,并且微卫星状态稳定(图2)。
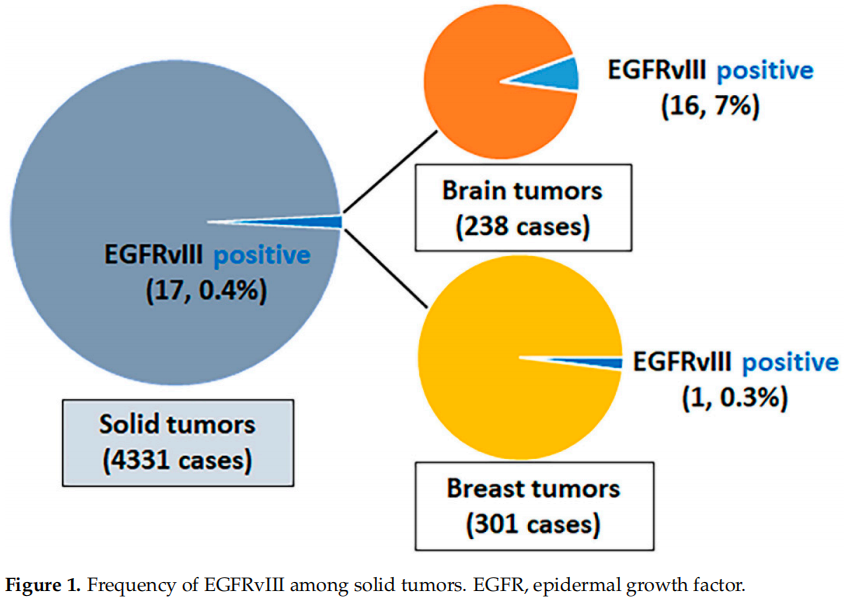
图1
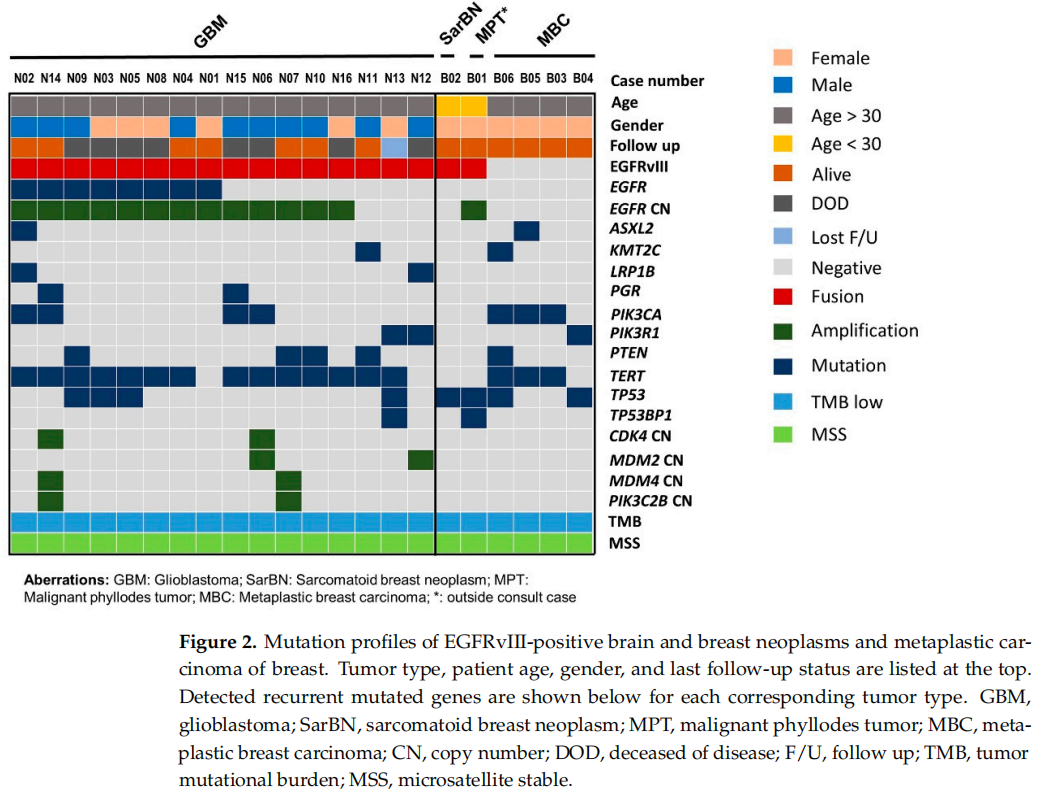
图2
EGFRvIII阳性胶质母细胞瘤:
16例EGFRvIII阳性胶质母细胞瘤患者中,女性6例,男性10例;患者初诊年龄为40-76岁,中位年龄为59岁。诊断后临床随访时间为3-22个月,中位随访时间为14个月。16例均为IDH野生型原发性胶质母细胞瘤,中枢神经系统WHO分级4级。镜下4例呈小细胞形态,其中3例同时存在EGFR扩增。2例进行了EGFR免疫组织化学染色,均显示EGFR弥漫性强表达(图3)。报告有小细胞形态的EGFRvIII阳性胶质母细胞瘤患者的总生存期比报告无小细胞形态的EGFRvIII阳性胶质母细胞瘤患者差(平均7.9个月 vs. 17个月)。
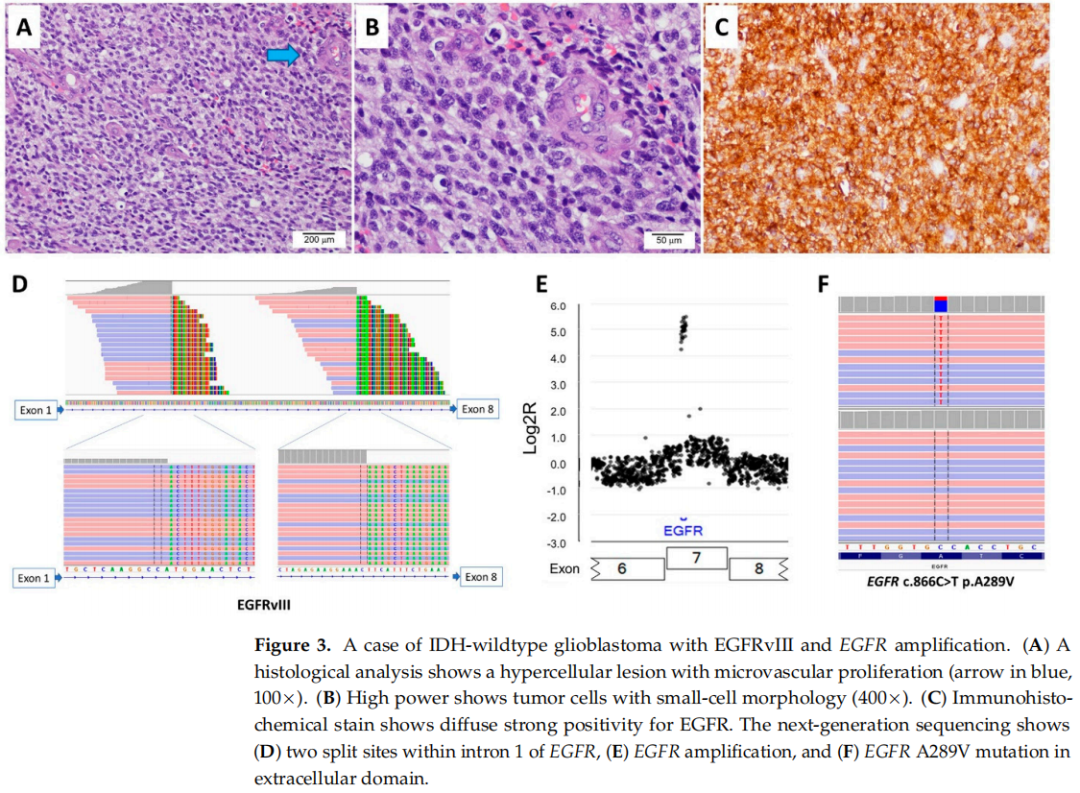
图3
分子谱分析显示所有16例患者为IDH野生型和组蛋白H3(H3)野生型,存在10号染色体拷贝数缺失。在所有16例患者中也观察到了7号染色体拷贝数变异,其中11例(69%)有EGFR扩增和7号染色体增加,2例(13%)有EGFR扩增但无7号染色体增加,3例(19%)无EGFR扩增但有7号染色体拷贝数增加。8例(50%)患者存在EGFR突变(图2)。16 例中14例存在最常见的共存突变TERT启动子突变:8 例为c.-124C>T突变,6 例为c.-146C>T突变。第二常见的共存突变基因包括PIK3CA、PTEN和TP53,这三种基因的突变各出现在4例中。其他常见共存突变基因为PIK3R1、LRP1B和PGR,各2例。
EGFRvIII阳性乳腺肿瘤:
在NGS检测的301例乳腺病变中,只有1例为EGFRvIII阳性(图4),并且该肿瘤未显示EGFR扩增(图2)。其余300例乳腺癌未检测到EGFRvIII。EGFRvIII阳性的乳腺病变发生在1例年轻女性(<30岁),患有恶性高级别肉瘤样肿瘤,具有梭形和上皮样细胞,异质性结构特征,局灶软骨黏液样间质。部分区域含有扩张的导管,伴有裂隙和大的鹿角形血管。大量有丝分裂象伴肿瘤坏死。免疫组织化学染色无法确定谱系。分子研究显示,EGFRvIII的肿瘤突变负荷为1 mut/Mb,并且具有稳定的微卫星稳定性(图4)。还检测到了TP53和PIK3CG的体细胞突变,以及MYC、PTK2、RAD21、RECQL4和RSPO2的扩增。患者接受了化疗和乳房切除术,在初次诊断后15个月随访时无病。
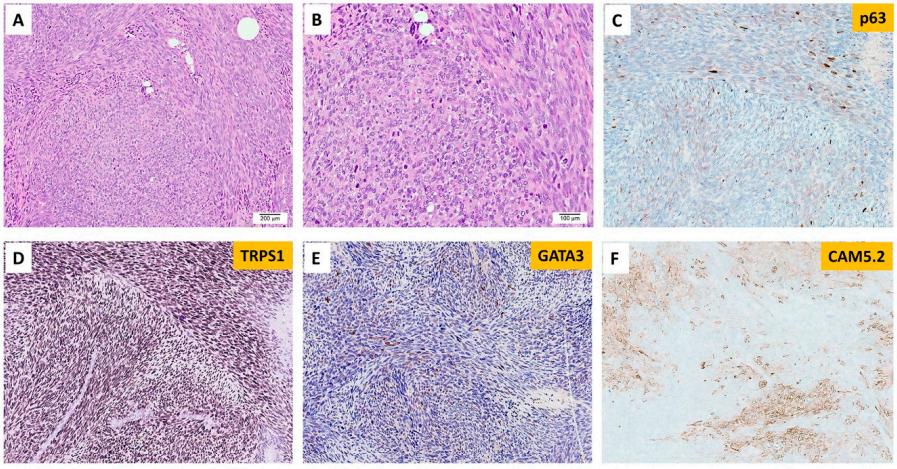
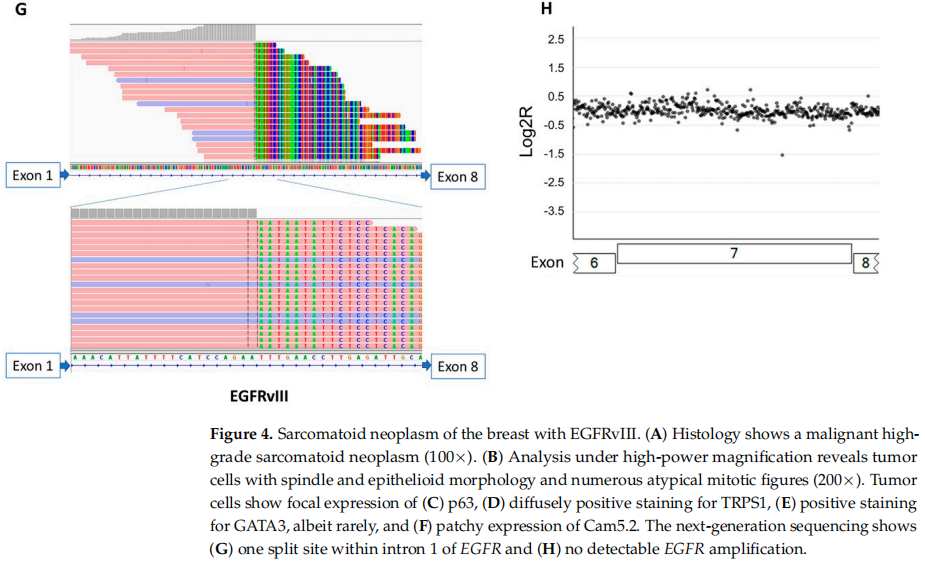
图4
另一例 EGFRvIII乳腺病变病例未纳入该队列,该患者为1例被诊断为恶性叶状肿瘤伴间质过度生长的年轻女性患者(图5)。其他机构分子检测报告显示EGFRvIII、FYN、TP53和TP53BP1体细胞突变以及EGFR扩增。患者接受了手术,在12个月随访时无病。
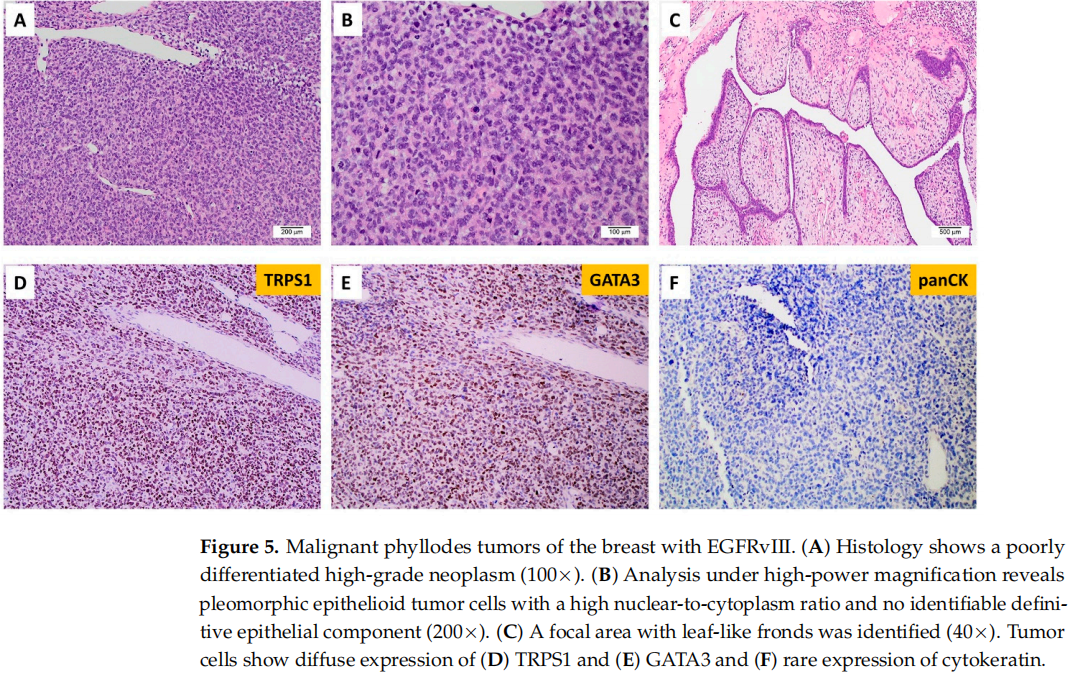
图5
研究者回顾了队列中诊断或鉴别诊断为乳腺恶性肉瘤样肿瘤的其余病例。4例伴化生性癌,2例伴肉瘤样/梭形,1例伴梭形/上皮样,1例伴腺鳞分化。年龄范围为50-69岁,平均年龄为64岁。所有患者均无EGFR变异(突变、扩增或融合)。在PIK3CA(3)、TERT(3)和TP53(2)中检测到常见的体细胞突变。2例患者的TERT突变发生在启动子(c.-124C>T)和1例患者的TERT突变发生在外显子2(c.581G>A p.R194Q)(图2)。
讨 论
原发性胶质母细胞瘤是一种高级别弥漫性星形细胞瘤,有丝分裂活性升高、微血管增殖、明显的血管内纤维蛋白微血栓和坏死。通常是典型的IDH野生型和H3野生型。在IDH野生型胶质母细胞瘤中,常见且与诊断相关的分子变异包括TERT启动子突变、EGFR基因扩增以及7号染色体拷贝数增加合并10号染色体拷贝数丢失(+7/-10基因型)。即使在没有微血管增生和/或坏死的形态学证据的情况下,在IDH和H3野生型弥漫性胶质瘤中至少存在一种这些变异就足以诊断为分子特征性的IDH野生型胶质母细胞瘤。TERT编码端粒酶,端粒酶在DNA复制过程中调节端粒长度,在正常体细胞衰老中发挥重要作用。TERT启动子区域的突变导致端粒酶上调,从而导致端粒维持和肿瘤发生,这见于许多类型的肿瘤,包括胶质母细胞瘤。靶向端粒酶活性的抑制剂正在进行1/2期临床试验。
EGFR在IDH野生型胶质母细胞瘤中经常发生变异,约60%的肿瘤显示EGFR扩增、突变、重排和/或剪接变异。在这些变异中,最常见的是EGFR扩增,大约40%的IDH野生型胶质母细胞瘤中观察到EGFR扩增。在大多数病例中,EGFR扩增与第二种EGFR变异相关,如EGFR::SEPT14基因间融合,在4-8%的胶质母细胞瘤中发现;基因内融合EGFRvIII,在20-30%的胶质母细胞瘤中发现;EGFR细胞外区域的点突变,在24%的胶质母细胞瘤中发现。在早期的研究中,EGFRvIII的检测主要通过单基因/位点RNA为基础的逆转录聚合酶链反应(PCR)和/或免疫组织化学进行。在本研究使用NGS的研究中,在44%的胶质母细胞瘤中观察到EGFR扩增,在14%的胶质母细胞瘤中观察到EGFRvIII,这与之前的研究相似。
在本队列研究中,胶质母细胞瘤PI3K通路中PIK3CA的激活突变或PTEN的失活突变可能与MAPK通路中的EGFRvIII共突变。小细胞形态是胶质母细胞瘤的一种亚型,主要表现为细胞具有高度单形性,小,圆形至微伸长,细胞核深染,细胞质极弱,细胞核非典型性很少,有丝分裂活性活跃。据报道,小细胞胶质母细胞瘤均为IDH野生型,在约70%的病例中显示EGFR扩增。
小细胞形态与EGFRvIII的相关性尚未见报道。EGFRvIII在肿瘤中的表达是否与不良预后相关仍存在争议。Shinojima等人在87例新诊断的胶质母细胞瘤患者中分析了EGFR基因扩增和突变的预后价值,并证明在EGFR基因扩增的情况下EGFRvIII表达是一个独立指标,是生存预后差的最强指标。然而,Felsberg等人的研究(包括106例EGFR扩增的胶质母细胞瘤)表明,EGFRvIII阳性与不同的无进展生存率或总生存率无关。在本研究中,研究者发现EGFRvIII阳性的脑肿瘤病例均为原发性胶质母细胞瘤,IDH野生型和H3野生型伴10号染色体拷贝数丢失。大多数病例还存在EGFR扩增、EGFR体细胞突变(主要位于细胞外区域的第6-9号外显子)和TERT启动子突变。半数病例存在EGFRvIII的多个剪接位点。此外,EGFRvIII阳性胶质母细胞瘤的一个亚群表现为小细胞形态,其中75%的小细胞病例同时显示EGFR扩增。与无小细胞形态的患者相比,小细胞形态组的总生存期较差。
值得注意的是,研究者还在该列中发现了1例无EGFR扩增或体细胞突变的EGFRvIII阳性乳腺病变,以及另1例在该机构外进行的检测中报告有EGFRvIII和EGFR扩增的恶性叶状肿瘤。2例患者均为青年女性,发病年龄均<30岁。镜下2例均表现为高级别肉瘤样肿瘤,1例表现为典型的叶状肿瘤区。相反,本研究中的4例化生性癌均无EGFR变异。
EGFRvIII在乳腺肿瘤中的表达历来存在争议。早期使用巢式PCR的研究报道,通过巢式反转录PCR,乳腺癌中EGFRvIII的存在频率可变。正常乳腺组织中未检测到EGFRvIII。然而,在这些早期研究中,由于相对较短/特异性较低的引物设计,以及在巢式PCR中包含第二个PCR,因此很难评估报告的乳腺癌EGFRvIII阳性率的准确性,以及临床无关/假阳性判定的可能性。相反,Rae等人的研究在55个乳腺癌细胞系和170个福尔马林固定石蜡包埋的原发性乳腺癌组织中使用了针对EGFR的特异性引物的逆转录PCR,但未检测到EGFRvIII mRNA。其他类型的EGFR基因内融合也极为罕见,其中只有1例乳腺癌病例(<0.1%)报告了EGFR基因内融合伴6个外显子的框外缺失。
总之,关于EGFRvIII表达水平和表达EGFRvIII的乳腺癌比例的结果可能取决于检测设计。EGFRvIII在乳腺恶性病变中的作用可能是肉瘤样形态的驱动因素,需要更大样本量的研究进一步证实。
EGFRvIII阳性的乳腺肉瘤样病例的鉴别诊断包括化生性癌、伴间质过度生长的恶性叶状肿瘤和原发性肉瘤。恶性叶状肿瘤和化生性癌在形态学上有相似之处,特别是当主要由梭形细胞组成,但形态学上没有可识别的上皮成分时,这给诊断带来了挑战。使用多个切片进行充分取样可能有助于识别诊断特征。然而,取样可能有限,尤其是小的活检标本。免疫组织化学染色有助于化生性癌的诊断,如恶性梭形细胞弥漫表达细胞角蛋白或p63/p40。然而,在恶性叶状肿瘤的基质成分中也有细胞角蛋白或p63/p40的斑片状染色的报道。近年来,分子生物学研究为乳腺恶性叶状肿瘤和化生性癌之间的基因差异提供了一些证据。Pareja等人研究了有或无纤维腺瘤样区域的叶状肿瘤的基因谱,发现在有纤维腺瘤样区域的肿瘤中,MED12外显子2突变的频率显著较高。然而,在没有纤维腺瘤样区域的肿瘤中,癌基因的富集更常见,尤其是EGFR突变和扩增。TERT基因变异的频率无显著差异。Gatalica等人对恶性叶状肿瘤进行了多重NGS,发现24例中有8例(33%)有血管生成增加相关基因的过表达,尤其是EGFR扩增。最常见的突变包括TP53(50%)和PIK3CA(15%)。此外,还发现了两种EGFR变异,包括EGFRvIII和EGFR V774M突变。到目前为止,本研究包括了第二例报道的携带EGFRvIII(基于NGS检出)的恶性叶状肿瘤。然而,化生性癌由一组具有独特形态和瘤内异质性的异质性肿瘤组成。许多研究已经阐明化生性癌的分子特征;然而,特异性的致病突变尚未确定。González-Martínez等人研究了化生性癌的分子谱,发现常见突变基因包括TP53(58.7%)、PIK3CA(32.8%)和TERT(29%),其中涉及PI3K通路的基因在梭形细胞癌中最常见。扩增频率最高的基因为MYC(17.3%)。最常见的基因缺失为CDKN2A/CDKN2B位点。肿瘤抑制因子TP53编码p53蛋白,而p53蛋白调节DNA修复、细胞凋亡和细胞周期。据报道,TP53突变在三阴性、HER2富集和转移性乳腺癌中显著高。在本队列肉瘤样乳腺肿瘤病例中,NGS显示除了EGFRvIII融合外,还发现了涉及TP53和PIK3CG的基因突变,以及MYC、PTK2、RAD21、RECQL4和RSPO2的扩增。在恶性叶状肿瘤中,除EGFRvIII融合外,还发现了TP53体细胞突变和EGFR扩增。此外,在本研究中,化生性癌病例中最常见的体细胞突变包括PIK3CA、TERT和TP53,没有病例显示EGFR变异。本研究病例显示的分子特征与González-Martínez等人报道的结果一致。
研究者回顾了一个大型的晚期恶性实体瘤病例队列,通过NGS确定脑胶质母细胞瘤和乳腺肉瘤样肿瘤中的EGFRvIII。治疗肿瘤科医师根据患者状态、肿瘤类型和肿瘤分期决定将病例纳入该队列,以寻找潜在的治疗干预措施。因此,每种癌症类型的样本量可能存在偏倚。此外,MAPP检测EGFRvIII可能受到其技术敏感性和分析前因素(包括但不限于福尔马林固定产生的DNA降解和低肿瘤分数)的潜在限制。受限于EGFRvIII阳性胶质母细胞瘤病例数量较少,研究者无法就小细胞形态的存在进行有统计学功效的有意义生存分析。由于乳腺肉瘤样肿瘤罕见,研究者无法进一步描述EGFRvIII在鉴别恶性叶状肿瘤与乳腺化生性癌和原发性肉瘤中的诊断效用,这两种肿瘤在组织学和免疫表型上有重叠。未来针对乳腺肉瘤样肿瘤的研究可能有助于阐明每个实体的不同分子特征。
总之,恶性肿瘤中的基因内EGFRvIII融合罕见,主要发生于胶质母细胞瘤,在乳腺肿瘤中很少发生,在本队列中的其他肿瘤类型中没有发现这种变异。值得注意的是,2例EGFRvIII阳性的乳腺病变均发生于年轻女性患者,表现为肉瘤样形态,与之前描述的1例EGFRvIII阳性的恶性叶状肿瘤相似。EGFRvIII在乳腺恶性病变中的作用可能是肉瘤样形态的驱动因素,需要更大样本量的研究进一步证实。鉴于针对EGFRvIII的泛HER抑制剂、多肽和嵌合抗原受体T免疫疗法等药物在临床试验中的出现,这一经过选择的患者群体可能从化疗或靶向抗EGFR治疗中获益。
参考文献:
Zheng L, Luthra R, Alvarez HA, et al. Intragenic EGFR::EGFR.E1E8 Fusion (EGFRvIII) in 4331 Solid Tumors. Cancers (Basel). 2023;16(1):6. Published 2023 Dec 19. doi:10.3390/cancers16010006



