Theranostics 四川大学李一飞/华益民/唐军团队开发新型单核细胞搭载红细胞微囊混合疗法靶向m6A治疗心脏纤维化的新策略
时间:2024-06-05 22:00:13 热度:37.1℃ 作者:网络
心血管疾病的发病率不断上升,尤其是随着人口老龄化和心脏装置植入手术的增加,心脏重构和纤维化成为亟待解决的医学难题。心脏装置植入后,单核细胞驱动的炎症反应常常导致心脏重构和纤维化,进而引发心律失常和心力衰竭等严重并发症。然而,具体的分子机制,特别是表观遗传修饰在这些过程中的作用,仍然缺乏深入研究。
近年来,m6A RNA甲基化作为一种重要的转录后调控机制,在多种细胞过程中被证实具有重要作用,包括细胞增殖、分化和免疫应答。在心血管疾病研究中,m6A RNA甲基化的调控作用也逐渐受到关注,成为潜在的治疗靶点。然而,关于m6A甲基化在单核细胞介导的心脏纤维化中的具体作用及其机制尚不明确。
在这个背景下,2024年6月1日,四川大学华西第二医院心血管科李一飞教授、唐军教授及华益民教授团队在Theranostics发表了题为“Deciphering m6A methylation in monocyte–mediated cardiac fibrosis and monocyte–hitchhiked erythrocyte microvesicle biohybrid therapy”的研究论文,该研究揭示了m6A甲基化在单核细胞介导的心脏纤维化中的重要作用,并探讨了一种新型的基于红细胞微囊的生物混合疗法。

研究团队从患有室间隔缺损(VSD)并接受封堵器植入的患者外周血单个核细胞(PBMCs)中提取RNA,检测了m6A甲基化修饰酶METTL3和METTL14的表达。通过使用METTL3抑制剂STM2457的红细胞微囊纳米药物递送系统,研究了抑制m6A修饰对心脏纤维化和功能的影响。研究结果显示,在VSD封堵器植入后出现持续性传导阻滞的患者中,PBMCs中的METTL3和METTL14显著上调。
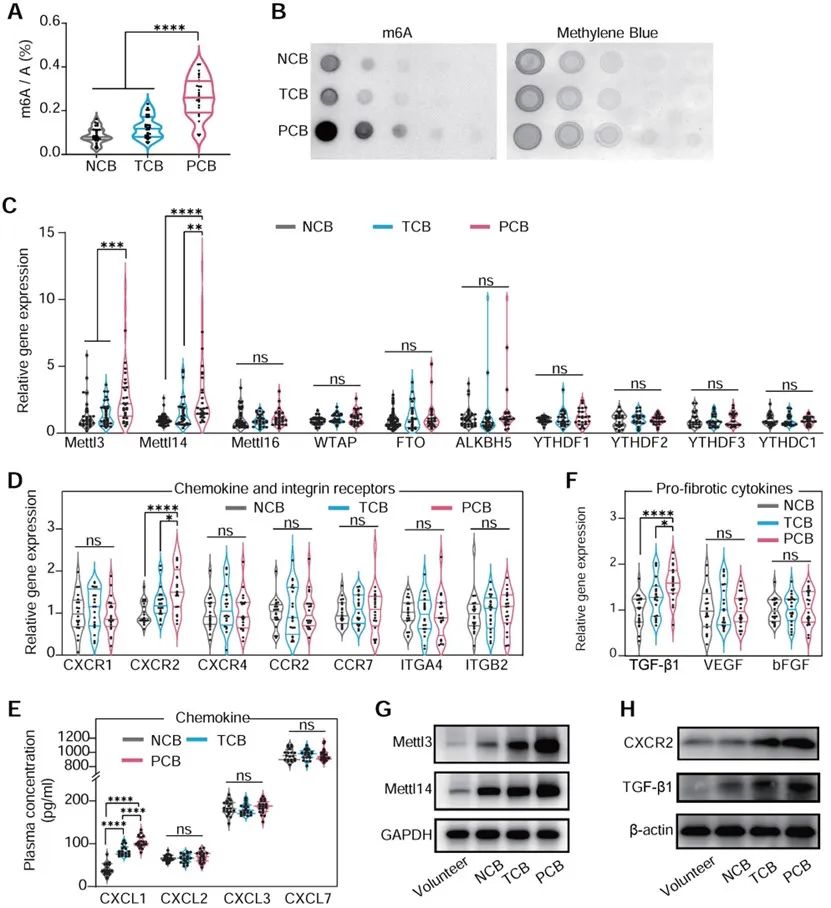
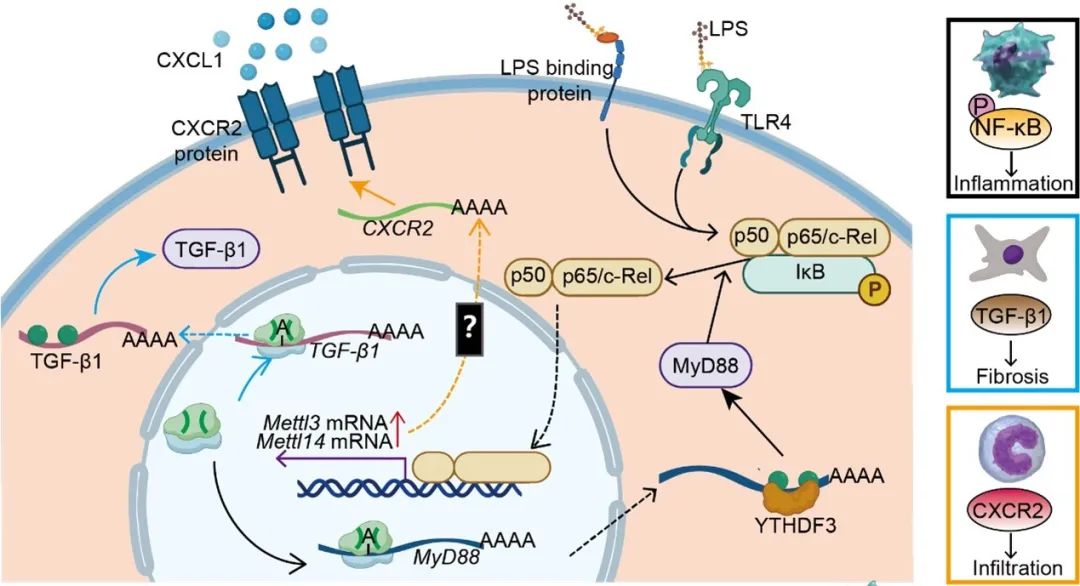
敲低单核细胞中的METTL3和METTL14后,血管紧张素Ⅱ诱导的心肌炎症和纤维化显著减少,同时MyD88和TGF-β1 mRNA上的m6A修饰水平降低,进而减弱了NF-κB通路的激活及其促纤维化作用。这一发现揭示了m6A甲基化在单核细胞炎症反应中的关键作用。通过抑制单核细胞中的m6A修饰,研究团队成功破坏了NF-κB反馈回路,减少了单核细胞的迁移和成纤维化能力,从而改善了心脏功能。
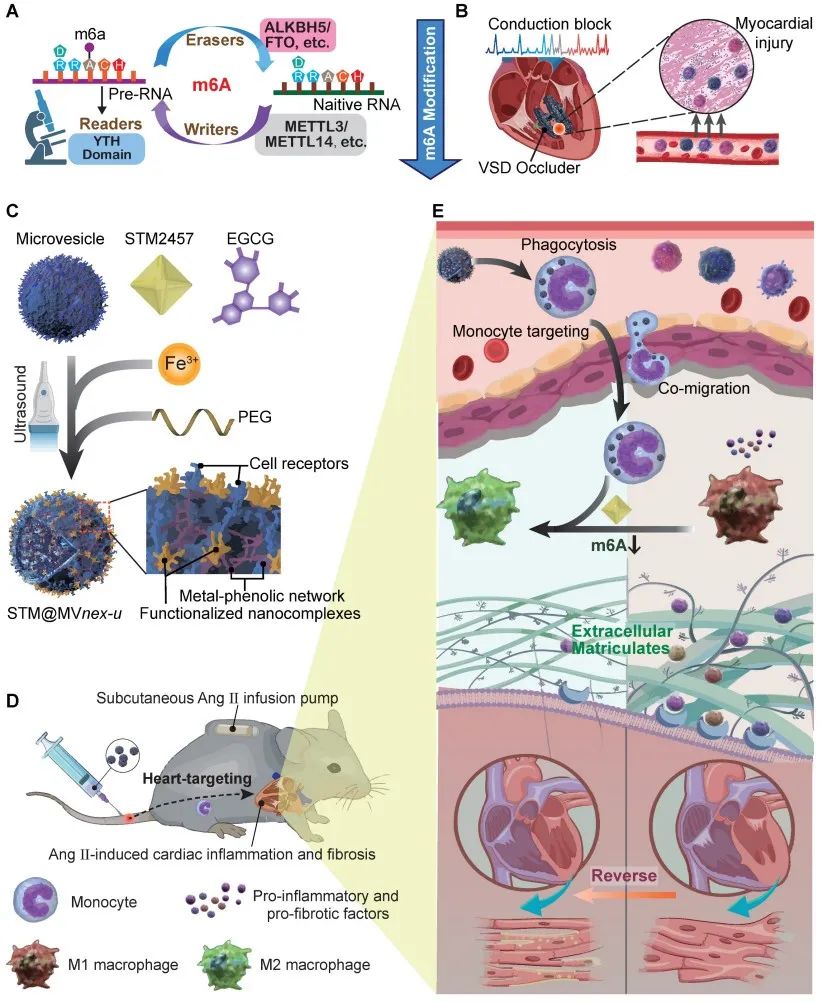
研究团队开发了一种基于红细胞微囊的纳米药物递送系统,将METTL3抑制剂STM2457通过金属多酚网络负载到这些微囊中。利用单核细胞天然吞噬红细胞微囊泡的能力,将STM2457有效递送至单核细胞中。实验结果表明,基于红细胞微囊的STM2457递送系统能够显著提高药物在心脏炎症部位的富集,增强了单核细胞和心脏巨噬细胞的靶向性。并且显著改善了血管紧张素Ⅱ诱导的小鼠心功能,减少了心脏纤维化和炎症反应。在治疗后,心脏巨噬细胞中的m6A修饰水平显著降低,MyD88、TGF-β1和CXCR2的表达显著减少,表明炎症和成纤维化反应得到了有效抑制。安全性评估显示,STM2457负载的红细胞微囊系统在长期使用后对主要器官没有明显的毒性作用。这一治疗策略为心脏重构相关并发症的治疗提供了新的策略。
四川大学华西第二医院儿童心血管科李一飞教授、华益民教授及新生儿科唐军教授为本文的共同通讯作者。本研究同时得到了四川大学轻工学院郭俊凌教授的大力支持。
四川大学华西第二医院儿童心血管科李一飞研究团队长期从事儿童心血管疾病及心脏发育相关的临床及转化医学研究,主要研究方向包括:1)胎儿及儿童心血管疾病介入诊疗技术;2)线粒体心肌病发病机制;3)遗传性心血管疾病基因治疗;4)心血管疾病相关高分子材料研发。近年来研究团队在Circulation、Signal Transduct Target Ther、Circulation Res、Theranostics、Redox Biol、JACC Cardiovasc Interv、Ultrasound Obstet Gynecol、Zoological Res、JACC Clin Electrophysiol等杂志发表学术论文100余篇;H因子23。目前实验室及研究团队已经搭建完备,具备成熟的发育生物学、基因编辑与基因治疗、新型材料合成与应用、多组学生物信息研究平台,欢迎感兴趣的同学加入研究团队(联系方式:liyfwcsh@scu.edu.cn)。
原文链接:
https://www.thno.org/v14p3486.pdf

