真实世界5年随访:PD-L1≥50%的晚期NSCLC患者长期获益于帕博利珠单抗单药一线治疗
时间:2024-05-31 18:00:37 热度:37.1℃ 作者:网络
在临床试验中,与化疗相比,帕博利珠单抗一线治疗晚期NSCLC显示出持久、有临床意义的长期生存获益。本研究旨在评估接受一线帕博利珠单抗单药治疗的晚期/转移性NSCLC患者在临床试验理想背景之外的5年生存率。研究者利用来自美国全国电子健康记录的去识别数据库,研究了在2016年11月1日至2020年3月31日期间开始帕博利珠单抗单药一线治疗,且PD-L1表达≥50%,未记录EGFR、ALK或ROS1基因变异,ECOG体力状态为0-1分的晚期/转移性NSCLC(不可切除的IIIB/IIIC期或IV期)成人患者,不包括临床试验中的患者。采用Kaplan-Meier法计算总生存期(OS)。数据截止日期为2023年5月31日。
共804例患者符合研究条件,其中女性404例(50%);中位年龄72岁(范围:38-85岁),其中≥75岁者310例(39%)。从帕博利珠单抗开始治疗至数据截止的中位随访时间为60.5个月(范围:38.0-78.7)。数据截止时,549例患者(68%)死亡。中位OS为19.2个月(95%CI,16.6-21.4),5年生存率为25.1%(95%CI,21.7-28.7)。总体而言,266例患者(33%)接受了一种或多种后续治疗方案,最常见的是抗PD-(L)1药物(单药治疗或联合治疗)或铂类化疗。
真实世界人群的5年随访显示,对于PD-L1表达≥50%且无EGFR、ALK或ROS1基因变异的晚期NSCLC患者,帕博利珠单抗单药一线治疗继续显示出长期疗效,25%的5年生存率与关键临床试验一致。
-
NSCLC的免疫治疗还需要在真实世界中进行长期研究;
-
真实世界的患者在年龄、性别和组织学方面与临床试验中的患者不同;
-
帕博利珠单抗一线用于治疗PD-L1表达≥50%的晚期NSCLC;
-
真实世界的5年OS与关键临床试验中的5年OS一致。
临床实践要点:
关键临床试验的长期随访表明,对于PD-L1 TPS≥50%且无致敏EGFR突变或ALK重排的晚期/转移性NSCLC患者,与化疗相比,帕博利珠单抗一线治疗有持久的、临床意义的长期生存获益,在KEYNOTE-024(IV期NSCLC)中5年OS率为31.9%,在KEYNOTE-042的PD-L1 TPS≥50%的亚组(不可切除III期或IV期)中5年OS率为21.9%。
然而,对在临床试验之外的真实世界环境中接受治疗的患者进行治疗研究对于评估试验结果的普遍适用性非常重要。
在这项回顾性队列研究中,研究者使用来自美国全国电子健康记录的纵向数据库评估了804例患者的长期结局,这些患者有以下情况:不可切除的IIIB、IIIC或IV期NSCLC,PD-L1表达≥50%,未记录EGFR、ALK或ROS1基因变异,并且ECOG PS为0或1。
与KEYNOTE试验中的患者相比,本研究中的804例真实世界患者年龄较大(中位年龄,72岁),女性(50%)和鳞状细胞癌(26%)的比例较大。
从帕博利珠单抗开始治疗至数据截止日期(2023年5月31日)的中位随访时间为60.5个月,中位OS为19.2个月(95%CI,16.6-21.4),1、3和5年生存率分别为61.4%(95%CI,57.8-64.7)、35.9%(95%CI,32.4-39.3)和25.1%(95%CI,21.7-28.7)。
≥75岁的310例患者中,中位OS为17.5个月(95%CI,14.2-20.2),1年和3年生存率分别为58.7%(95%CI,53.0-64.1)和28.7%(95%CI,23.6-34.1)。
研究结果与关键临床试验的5年结局一致,并且证明对于ECOG PS为0或1分的类似真实世界患者人群(包括在临床试验中代表性不足的≥75岁患者),帕博利珠单抗单药一线治疗有效。
研究背景
过去10年间非小细胞肺癌(NSCLC)生存率的改善可归因于靶向疗法和免疫疗法的批准和采用。历史上,不可切除的晚期NSCLC的生存率较差,截至2016年,美国IV期NSCLC的5年总生存(OS)率仅为6%。一项回顾性研究发现,在免疫疗法出现之前的数年中,对于无EGFR或ALK基因变异的IV期NSCLC,一线化疗的中位OS为9.7个月。
KEYNOTE-024临床试验评估了帕博利珠单抗用于治疗PD-L1肿瘤比例评分(TPS)≥50%且无增敏EGFR突变或ALK重排的转移性NSCLC,试验结果呈阳性,因此2016年10月批准了帕博利珠单抗一线治疗。在KEYNOTE-024中进行的后续随访分析表明,患者有持久的、有临床意义的长期生存获益,5年OS率为31.9%。KEYNOTE-042临床试验记录了局部晚期/转移性NSCLC的类似获益,在无EGFR或ALK基因变异的PD-L1 TPS≥50%的患者亚组中,5年OS率为21.9%。
然而,临床试验是在理想化的条件下进行的,与在真实世界环境中接受肿瘤医师治疗的患者相比,参加临床试验的患者往往更年轻、更健康,拥有更多的资源。对在临床试验之外的真实世界环境中接受治疗的患者进行治疗研究对于评估试验结果的普遍适用性很重要。在之前使用Flatiron Health数据库进行的两项中位随访时间为18个月和35个月的真实世界研究中,对于接受帕博利珠单抗单药一线治疗、PD-L1表达≥50%且无EGFR或ALK基因变异的转移性NSCLC患者,生存结局与临床试验结果一致。这些患者的美国东部肿瘤协作组体能状态(ECOG PS)评分为0或1分,与临床试验一致。
本研究的目的是,与之前发表的研究相比,通过帕博利珠单抗单药治疗开始后的5年随访来评估这一患者人群的生存结局,并将其扩展至未记录EGFR、ALK或ROS1基因变异的局部晚期不可切除NSCLC患者。此外,由于老年患者人群在临床试验中未得到充分代表,因此本研究试图探索≥75岁患者亚组的长期生存结局。
研究结果
患者特征:
在研究者进行分析时,数据库包括89062例晚期NSCLC患者,其中64402例(72%)接受了全身性治疗。在这64402例患者中,13612例(21%)无已知EGFR、ALK或ROS1基因变异(以及记录的EGFR和ALK野生型非鳞状NSCLC)的NSCLC从2016年11月1日至2020年3月31日启动了一线治疗。排除PD-L1表达<50%(或未知)的患者后,仍有3656/13612例患者(27%)。其中,804例患者的ECOG PS为0或1分,并接受了帕博利珠单抗一线单药治疗(图1)。
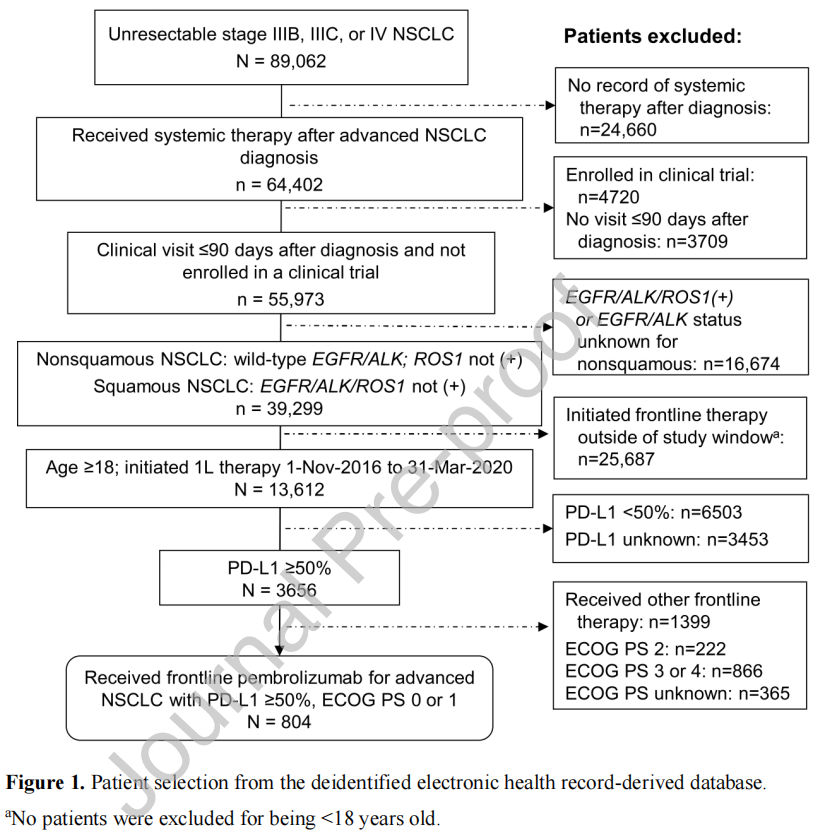
图1
患者的中位年龄为72岁,310例患者(39%)≥75岁(表1)。性别分布均匀(50%为女性,50%为男性),约3/4的患者为白种人(77%)。总体而言,749例(93%)为当前吸烟者或既往吸烟者。大多数患者(709例;88%)在社区肿瘤诊所接受治疗。
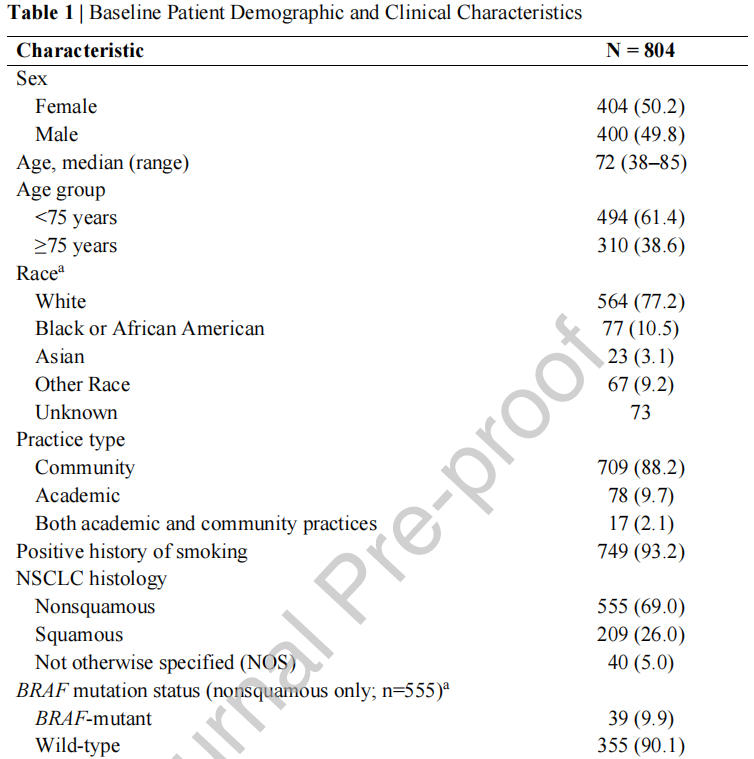

表1
在初诊时有NSCLC分期数据记录的患者中(除10例患者之外的所有患者),609例患者(77%)患晚期NSCLC,包括580例(73%)初诊为IV期NSCLC。1/4(26%)的肿瘤为鳞状组织学(表1)。
附录表A.1中列出了关键患者人口统计和临床特征,以及先前对PD-L1表达≥50%的 NSCLC 进行一线帕博利珠单抗单药治疗的研究,包括KEYNOTE-024和KEYNOTE-042临床试验。PD-L1表达检测的详细信息参见附录表A.2。
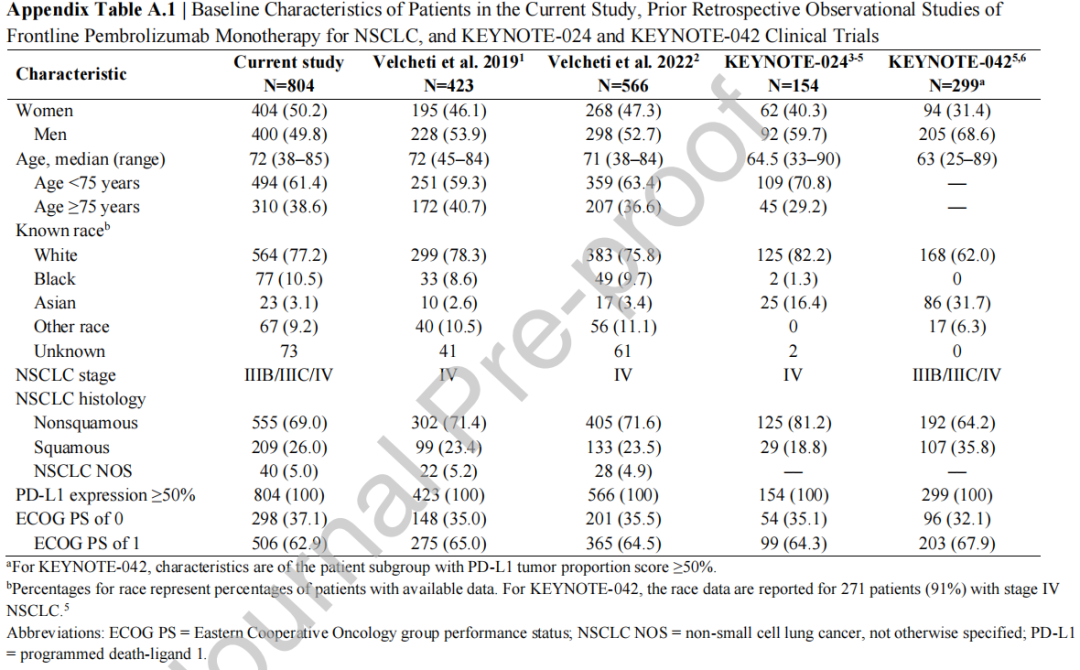
附录表A.1

附录表A.2
结果:
从帕博利珠单抗治疗开始至数据截止的中位研究随访时间为60.5个月(范围:38.0-78.7个月),而从帕博利珠单抗治疗开始至首例死亡或数据截止的中位患者随访时间为20.7个月(范围:<0.1-78.6个月)。
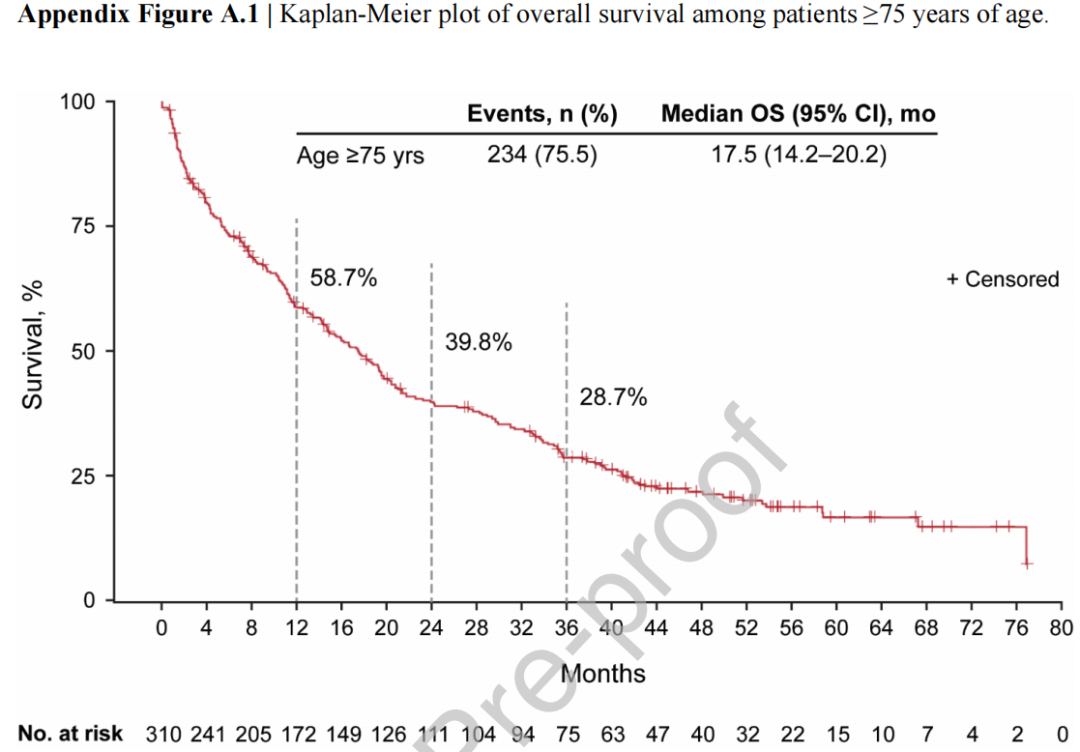
在数据截止时,549例患者(68%)死亡。中位OS为19.2个月(95%CI,16.6-21.4)。1、3和5年的生存率分别为61.4%(95%CI,57.8-64.7)、35.9%(95%CI,32.4-39.3)和25.1%(95%CI,21.7-28.7)(表2;图2)。在≥75岁的310例患者中,234例(75%)死亡,中位OS为17.5个月(95%CI,14.2-20.2),1年和3年的生存率分别为58.7%(95%CI,53.0-64.1)和28.7%(95%CI,23.6-34.1)(附录图A.1)。
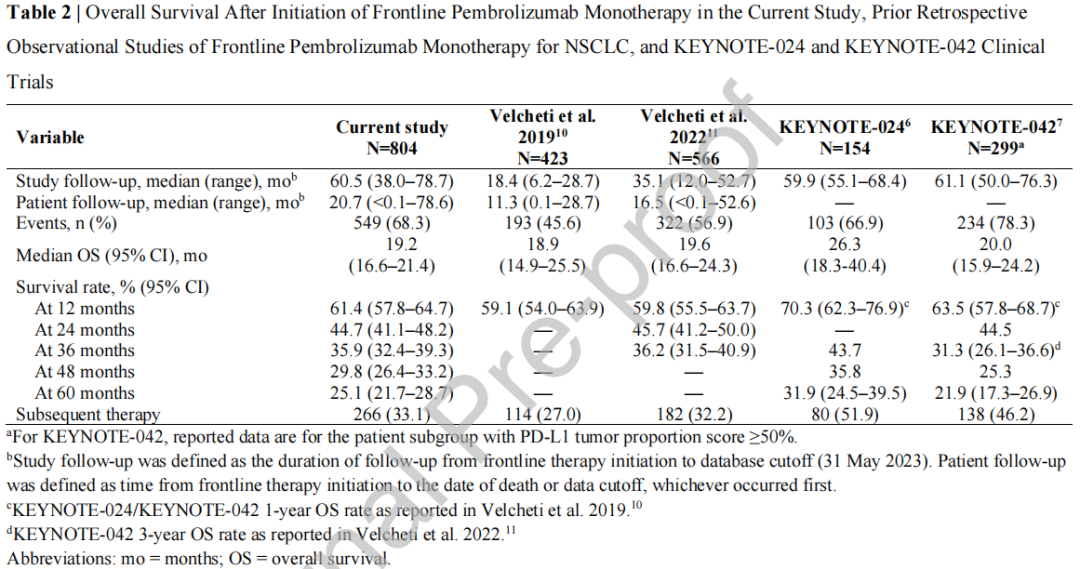
表2
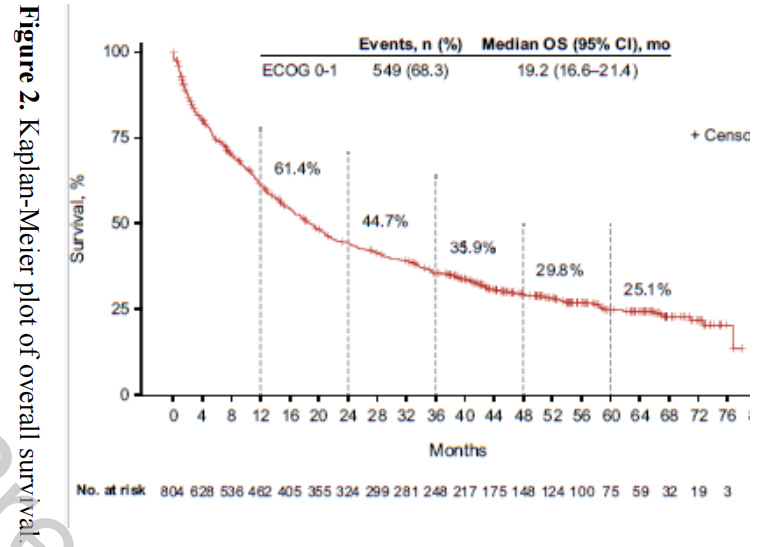
图2
附录图A.1
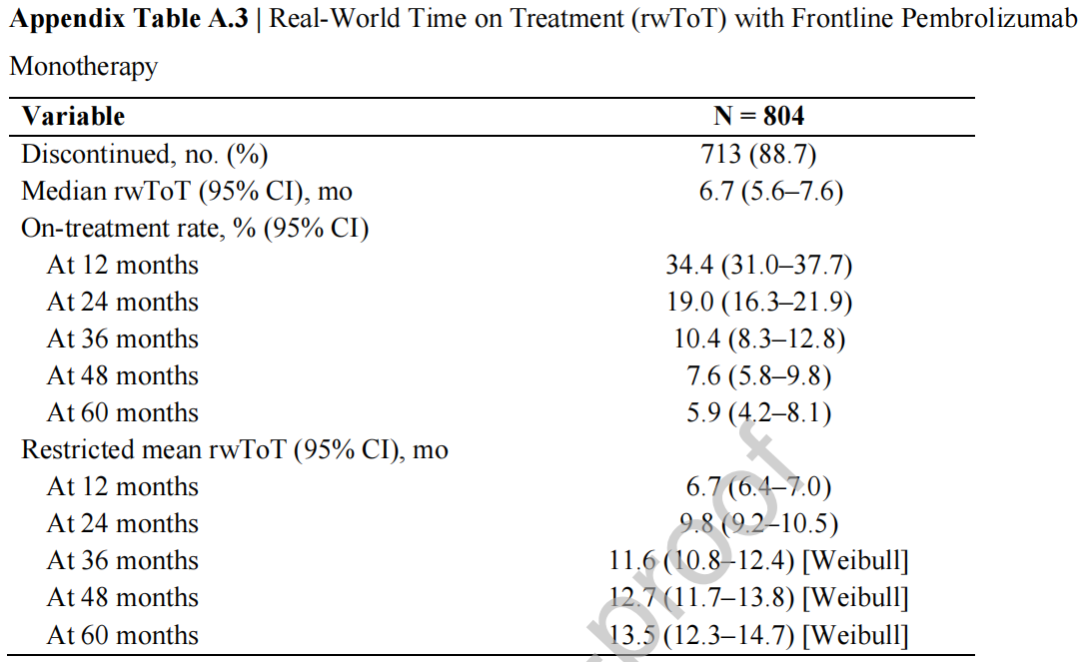
帕博利珠单抗组的中位rwToT(真实世界治疗时间)为6.7个月(95%CI,5.6-7.6);34%的患者在12个月时仍在接受帕博利珠单抗治疗,在2年时的为19%(详情参见附录表 A.3;附录图 A.2)。
附录表 A.3
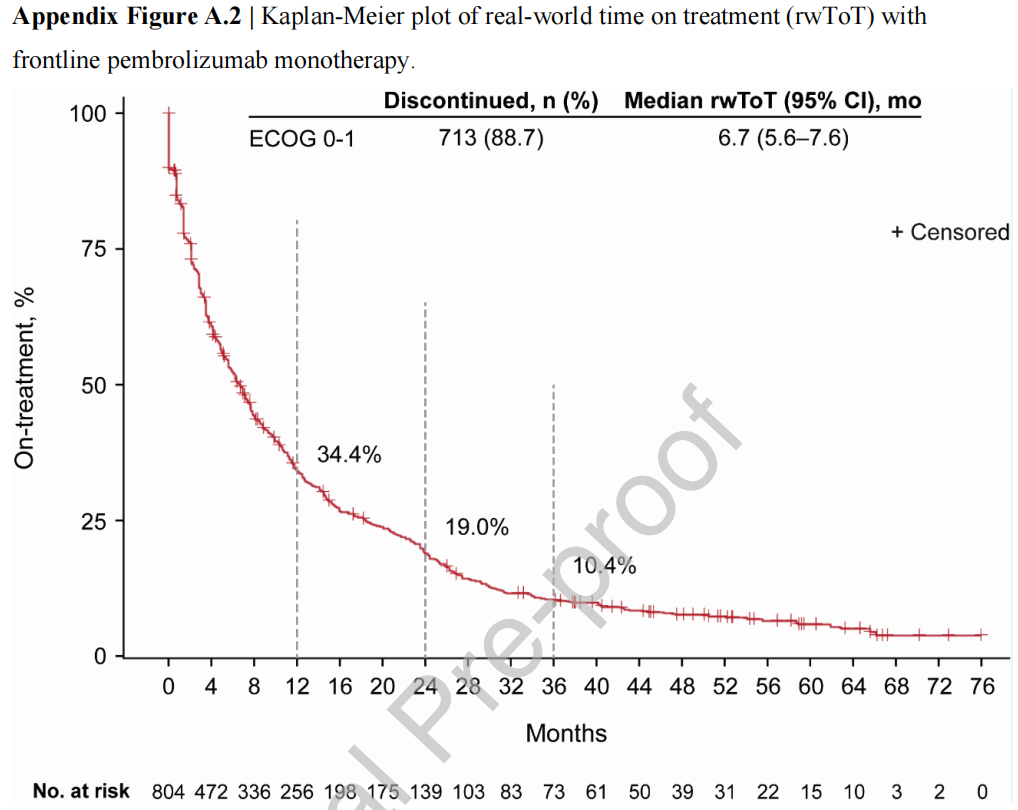
附录图 A.2
共有266例患者(33%)接受了一种或多种后续抗癌治疗方案,最常见的是抗PD-(L)1药物(单药治疗或联合治疗)或铂类化疗(表3)。107例患者还接受了帕博利珠单抗作为二线治疗,25例患者接受了帕博利珠单抗作为三线治疗。在二线治疗中,帕博利珠单抗组的中位rwToT为5.6个月(95%CI,2.9-7.4),24个月时的治疗率为14%;在三线治疗中,中位rwToT为3.7个月(95%CI,1.4-4.9), 24个月时的治疗率为10%(附录表 A.4)。


表3

附录表 A.4
讨 论
这项长期研究的结果表明,对于PD-L1表达≥50%且无EGFR、ALK或ROS1基因变异的晚期NSCLC,帕博利珠单抗单药一线治疗具有一致的OS获益。中位随访时间为5年,患者的生存结局与关键KEYNOTE临床试验中观察到的长期生存率相似。具体而言,本研究的中位OS为19.2个月(95%CI,16.6-21.4),与KEYNOTE-024(中位26.3个月;95%CI,18.3-40.4)和KEYNOTE-042 PD-L1 TPS≥50%亚组(20.0个月;95%CI,15.9-24.2)的中位OS一致。本研究的5年生存率(25.1%)也与KEYNOTE试验的5年生存率(分别为31.9%和21.9%)一致。
此外,与使用相同数据库的上一项研究(Velcheti等人,2022)相比,本研究的中位随访时间延长了25.4个月,本研究的长期临床结局支持帕博利珠单抗一线治疗PD-L1表达≥50%的晚期NSCLC有效的一致结果。本研究得益于Flatiron Health数据库的增长,与之前两项真实世界研究相比,符合条件的患者人群规模更大。需要注意的是,本研究在患者人群中可能与之前两项研究有重叠。然而,由于患者个人信息被取消身份识别,因此无法准确确定这一点。与之前研究的另一个不同之处在于,更大比例的患者至少部分在学术机构接受治疗,约为12%,而在之前的研究中,几乎所有患者(98%-99%)仅在社区机构接受治疗。
本研究旨在评估在真实世界环境中接受帕博利珠单抗单药治疗的患者,这些患者的体能状态和肿瘤特征与KEYNOTE-024中的患者和KEYNOTE-042中PD-L1 TPS≥50%的亚组相似。然而,真实世界患者人群的年龄和性别分布与临床试验人群不同。与KEYNOTE-024和KEYNOTE-042 PD-L1 TPS≥50%亚组相比,真实世界患者年龄较大(如研究者在之前的真实世界研究中所发现的),中位年龄为72岁65岁和63岁,女性比例较高(50% vs 40%和31%)。此外,虽然本研究中所有患者的体能状态良好(ECOG PS为0分或1分),但中位查尔森合并症指数评分为4分,提示这些患者的合并症负荷高于符合临床试验条件的患者。
本研究中39%的≥75岁患者的中位OS为17.5个月,与整个队列的观察结果一致。此外,本研究报告的12个月生存率为58.7%,与KEYNOTE-024和KEYNOTE-042中报告的PD-L1 TPS≥50%的≥75岁患者(n=49)接受帕博利珠单抗一线治疗的12个月生存率60.7%一致。其他纳入≥75岁PD-L1表达的晚期NSCLC患者的观察性研究报告了帕博利珠单抗单药一线治疗对这些患者的生存获益。这是第一项有足够数量的患者和随访报告长期生存结局的研究。36个月时的生存率为28.7%,进一步凸显了帕博利珠单抗对临床试验中未充分代表的老年患者的长期益处。
在肿瘤特征方面,研究了不可切除的IIIB和IIIC期以及IV期患者,正如KEYNOTE-042所示。在本研究中,鳞状细胞癌的比例为26%,在KEYNOTE-024和KEYNOTE-042中分别为19%和36%。
在本研究中,中位rwToT为6.7个月(95%CI,5.6-7.6),略短于之前的一项真实世界研究(7.4个月;95%CI,6.3- 8.1),而在KEYNOTE-024中,中位治疗持续时间几乎为8个月。值得注意的是,本研究中有19%的患者在2年时和10%的患者在3年时仍在接受帕博利珠单抗治疗。然而,只有1/3的患者继续接受后续治疗,这与之前的两项真实世界研究相似。相比之下,在两项KEYNOTE试验中,约有一半的患者继续接受后续治疗。
长期随访是本研究的优势。此外,研究者对患者的临床和肿瘤特征进行了详细描述。然而,研究者注意到,选择有完整信息记录的患者可能会增加发生选择偏倚的可能性。例如,在使用同一数据库的另一项研究中,接受PD-L1表达或基因变异检测的患者的OS比未接受检测的患者长。此外,研究结果可能无法推广到在学术中心或Flatiron Health网络之外接受治疗的患者。
本研究的其他局限性包括无法确定停用帕博利珠单抗或开始二线治疗的原因,以及无法识别不良事件。此外,对于这一人群,后续治疗对OS的影响无法评估。以抗PD-(L)1为基础的治疗是本研究中最常见的后续治疗,既往研究报道患者可能从以抗PD-(L)1为基础的再治疗中获益。最后,数据库中没有关于死亡原因的详细信息。
在本研究中,经过5年随访,帕博利珠单抗单药一线治疗对PD-L1表达≥50%且无EGFR、ALK或ROS1基因变异的晚期NSCLC继续显示出长期疗效。与临床试验相比,真实世界患者人群往往年龄较大,女性比例较高。研究结果与关键临床试验的5年结局一致,并且证明帕博利珠单抗单药一线治疗对类似的真实世界患者人群(包括在临床试验中代表性不足的≥75岁患者)有效。
参考文献:
Vamsidhar Velcheti , Pragya Rai , Yu-Han Kao , Diana Chirovsky , Ana Tablante Nunes , Stephen V. Liu , Five-Year Real-World Outcomes With Frontline Pembrolizumab Monotherapy in PD-L1 Expression ≥50% Advanced NSCLC, Clinical Lung Cancer (2024), doi: https://doi.org/10.1016/j.cllc.2024.05.002


