Nat. Med:塞纳帕利作为卵巢癌一线维持治疗的III期临床试验结果
时间:2024-05-22 12:00:16 热度:37.1℃ 作者:网络
卵巢癌是一种严重恶性肿瘤,每年导致约5%的女性癌症相关死亡,大多数患者初诊时已处于晚期,标准治疗方法为手术切除肿瘤并辅以铂类药物化疗,尽管化疗后大部分患者会进入缓解期,但大多数患者会在3年内复发,PARP抑制剂作为维持治疗,可以在一线化疗后延长患者的无进展生存期,虽然并非所有PARP抑制剂都对生物标志物未选择的人群有益,尼拉帕利是唯一获批用于这一适应症的PARP抑制剂,在BRCA突变和HRD亚组中显示出一致的疗效,文献报道,至少一半的晚期卵巢癌患者既没有BRCA1/2突变也没有HRD,因此需要其他维持治疗选择来延长一线化疗后的缓解期,塞纳帕利是一种新型PARP抑制剂,在早期研究中显示出良好的抗肿瘤活性和耐受性,该研究的目的是评估塞纳帕利相对于安慰剂作为一线维持治疗在中国晚期卵巢癌患者中的疗效和安全性。

方法
FLAMES是一项多中心、双盲、随机对照的3期临床试验,在中国41个中心进行,研究对象为18岁及以上女性,病理确诊为FIGO III-IV期高级别浆液性或子宫内膜样卵巢癌或其他上皮性卵巢癌、输卵管癌或原发性腹膜癌,存在BRCA1/2突变,除高级别浆液性或子宫内膜样癌外的其他病理类型,入选者已完成6-9周期一线铂类化疗,并取得完全或部分临床反应,患者按2:1的比例随机分配到塞纳帕利组(100mg QD)或安慰剂组,治疗周期为2年或直到疾病进展、不可接受的毒性或剂量中断超过28天,主要终点为无进展生存期,由盲态独立中心审查按RECIST v1.1评估,次要终点包括研究者评估的无进展生存期、化疗间隔期、首次后续治疗或死亡时间、治疗停止或死亡时间以及生活质量等。
研究结果
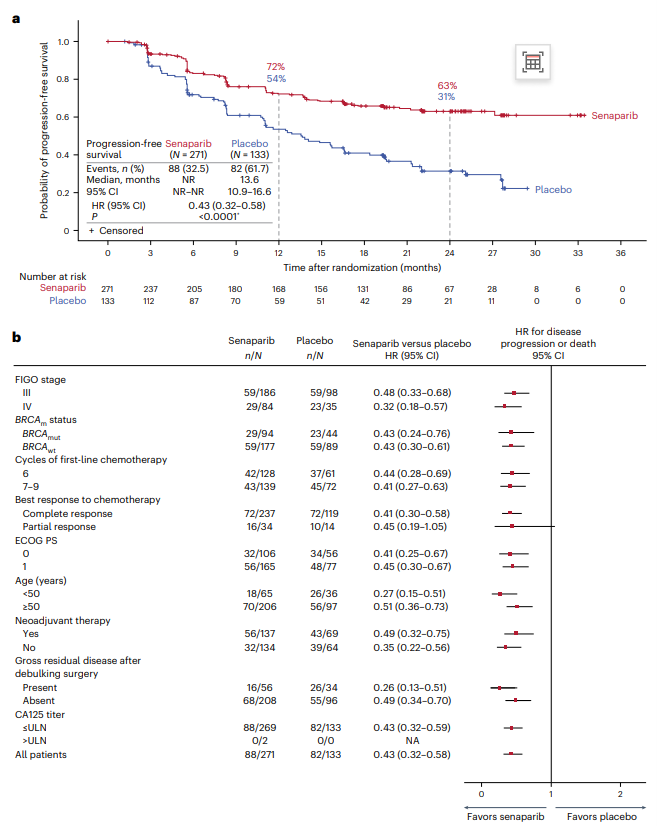
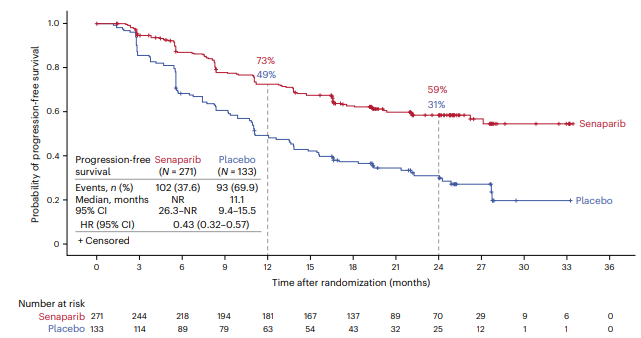
在主要终点分析中,塞纳帕利组的中位无进展生存期尚未达到,而安慰剂组的中位无进展生存期为13.6个月(HR 0.43, 95% CI 0.32-0.58, P<0.0001),塞纳帕利相对于安慰剂在BRCA突变和野生型患者中显示出一致获益,无论是否接受新辅助化疗、是否达到完全或部分反应,此外,塞纳帕利组的化疗间隔期显著长于安慰剂组(未达到vs 16.7个月,HR 0.41, 95% CI 0.30-0.55),塞纳帕利组的后续治疗或死亡时间也显著长于安慰剂组(未达到vs 14.4个月,HR 0.44, 95% CI 0.33-0.59)。

安全性分析
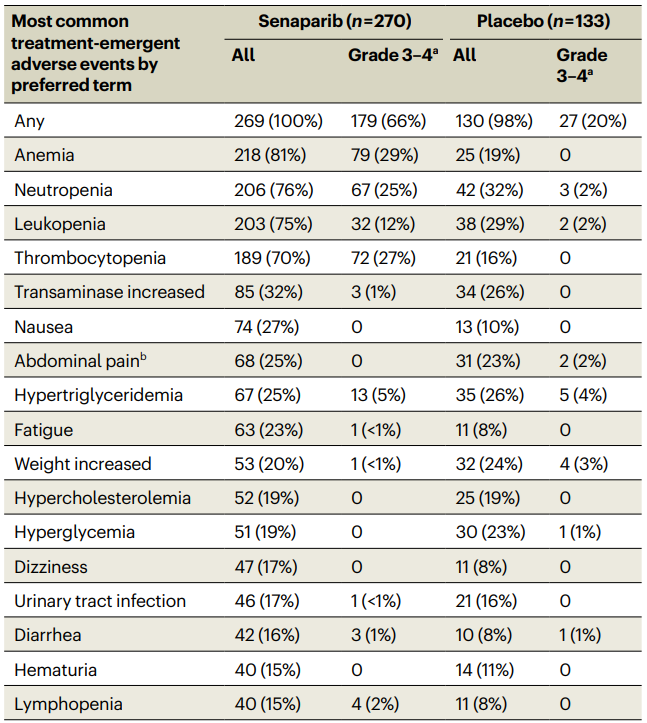
塞纳帕利组的不良事件发生率为100%,而安慰剂组为98%,其中,严重不良事件发生率在塞纳帕利组为28%,在安慰剂组为4%,塞纳帕利组的血液学毒性较为常见,包括贫血(81%)、中性粒细胞减少(76%)、白细胞减少(75%)和血小板减少(70%),其中≥3级的发生率分别为29%、25%、12%和27%,塞纳帕利组的非血液学毒性主要包括转氨酶升高(32%)、恶心(27%)、腹痛(25%)和高甘油三酯血症(25%),而安慰剂组主要为中性粒细胞减少(32%)、白细胞减少(29%)、高甘油三酯血症(26%)和转氨酶升高(26%),塞纳帕利组的严重不良事件主要为贫血(10%)和血小板减少(8%),而安慰剂组无事件发生率超过1%,因不良事件导致的治疗中断和剂量调整在塞纳帕利组更为常见,分别为77%和63%,而安慰剂组分别为20%和6%,塞纳帕利组因不良事件导致的永久性治疗中断率为4%,主要原因为血小板减少(3%)、贫血(2%)和转氨酶升高(<1%),而安慰剂组无因不良事件导致的永久性治疗中断,塞纳帕利组出现1例(<1%)急性髓细胞白血病,被认为与治疗相关,塞纳帕利显示出良好的安全性,血液学毒性是可管理且可逆的,未出现新的安全性问题。
结论
与安慰剂相比,塞纳帕利作为一线化疗后的维持治疗,能够显著延长晚期卵巢癌患者的无进展生存期,无论患者的BRCA突变状态如何,各亚组都观察到了一致的获益,塞纳帕利显示出良好的安全性,血液学毒性是可管理且可逆的,未出现新的安全性问题,其副作用发生率与已知的PARP抑制剂类似,塞纳帕利对生活质量的影响较小,与安慰剂组相比,塞纳帕利未显著影响患者的生活质量,塞纳帕利能够延长患者的化疗间隔期,使患者能够更长时间不进行化疗,与安慰剂相比,塞纳帕利能够显著延长患者后续治疗或死亡的时间,这些结果支持塞纳帕利作为晚期卵巢癌患者一线化疗后的维持治疗,为这一患者群体提供了新的治疗选择。
原始出处
Wu, X., Liu, J., Wang, J. et al. Senaparib as first-line maintenance therapy in advanced ovarian cancer: a randomized phase 3 trial. Nat Med (2024). https://doi.org/10.1038/s41591-024-03003-9.


