TRPV3在皮肤病发生及治疗中的研究进展
时间:2024-01-12 21:18:20 热度:37.1℃ 作者:网络
瞬时受体电位离子通道香草素3(transient receptor potential vanilloid3,TRPV3)是一种非选择性阳离子通道蛋白,在皮肤角质形成细胞中表达最为丰富,参与角质形成细胞增殖、皮肤屏障形成、感觉传导、毛发生长等生理过程,对维持皮肤稳态有着重要作用。研究发现TRPV3在特应性皮炎、Olmst-ed综合征、银屑病等皮肤病的发生发展中起重要作用。
TRPV3的发现及简介
TRPV3是位于细胞膜上的一种对温度敏感(31℃~39℃)且受多种化学刺激的非选择性阳离子 钙渗透通道蛋白,它于2002年首次克隆,与其他TRPV通道显示约30%~40%的序列同源性。TR-PV3在背根神经节、鼻腔和口腔上皮细胞、肠道上皮细胞和皮肤角质形成细胞中大量表达,在皮肤角质形成细胞中表达最为丰富。
TRPV3在人体正常生理过程中发挥多种作用,包括感知温度、维护皮肤屏障功能、促进毛发生长、影响神经信号的传递、调节血管张力等。环境温度升高时,TRPV3通道会打开,导致离子通量增加,从而触发神经信号传递,引起热感受。TRPV3可直接与谷氨酰胺转胺酶结合形成复合物,调节生长因子信号传导,影响角质细胞的增殖和分化,形成皮肤屏障。并且TRPV3参与皮肤脂质合成和分泌,对皮肤保湿和抵抗外界刺激具有重要作用。
TRPV3通道在毛囊的多个部位表达,可与毛囊细胞相互作用并参与毛发周期的调节,TRPV3过度激活可引起毛囊过早分化从而导致脱发。TRPV3通道的激活可以导致神经末梢释放神经递质,从而影响神经信号的传递和感知,这一机制对疼痛感知产生一定的调节作用。TRPV3通道在血管中的表达与血管张力调节有关,激活TRPV3通道可以导致血管舒张,促进血液循环。
越来越多的研究证明TRPV3功能突变与皮肤炎症和瘙痒密切相关,从而导致相关的皮肤疾病,如特应性皮炎,Olmsted综合征和银屑病等炎症性疾病。使用TRPV3的激动剂香芹酚可引起小鼠的抓挠行为,而敲除TRPV3或利用TRPV3抑制剂可缓解小鼠的皮肤瘙痒和炎症。TRPV3的功能突变会导致表皮金黄色葡萄球菌定植增加,血清中IgE和IL-4水平升高,CD4+T细胞浸润增加,干扰皮肤屏障的内稳态,抑制真皮中的毛发生长。TRPV3通道的激活可触发多种因子的释放,包括PGE2、ATP、NO和NGF,加重皮肤瘙痒和炎症反应。
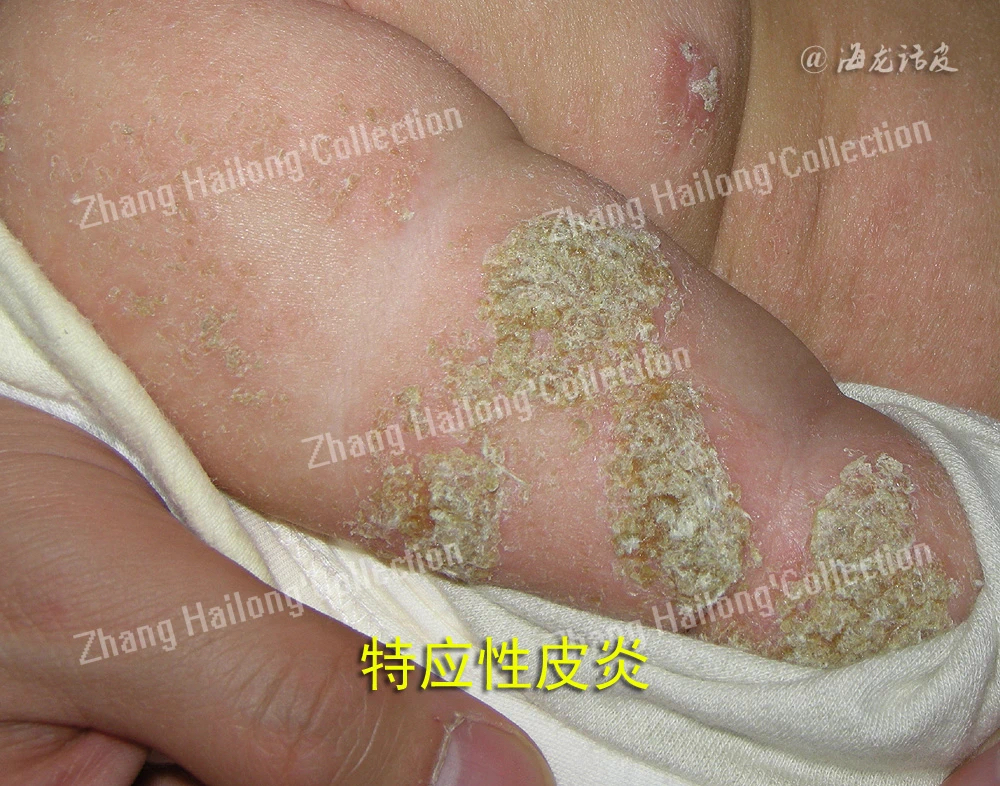
TRPV3与特应性皮炎
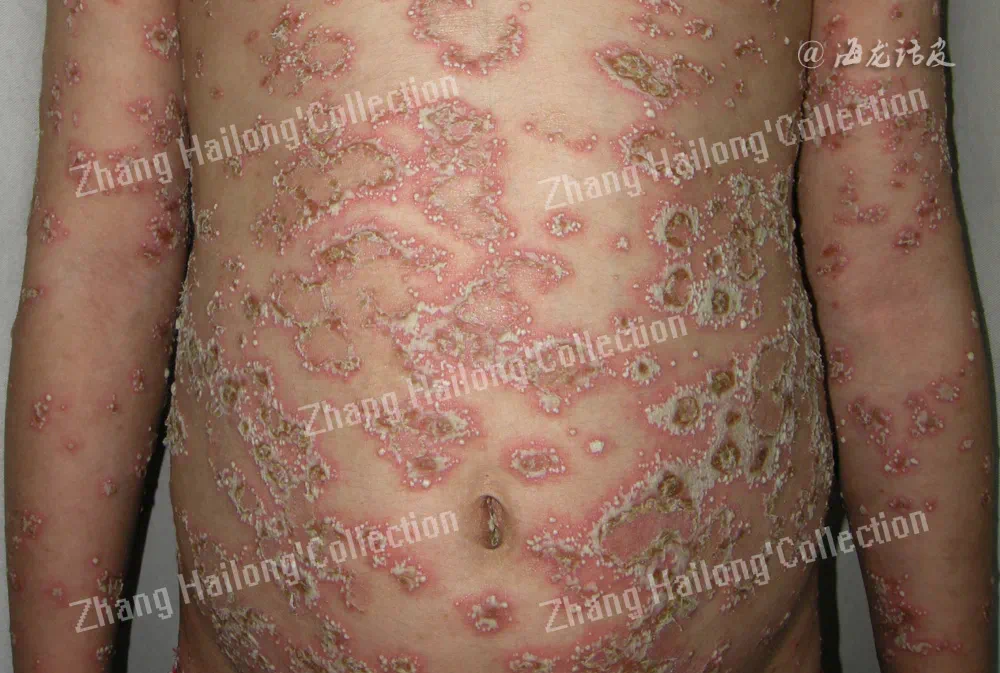
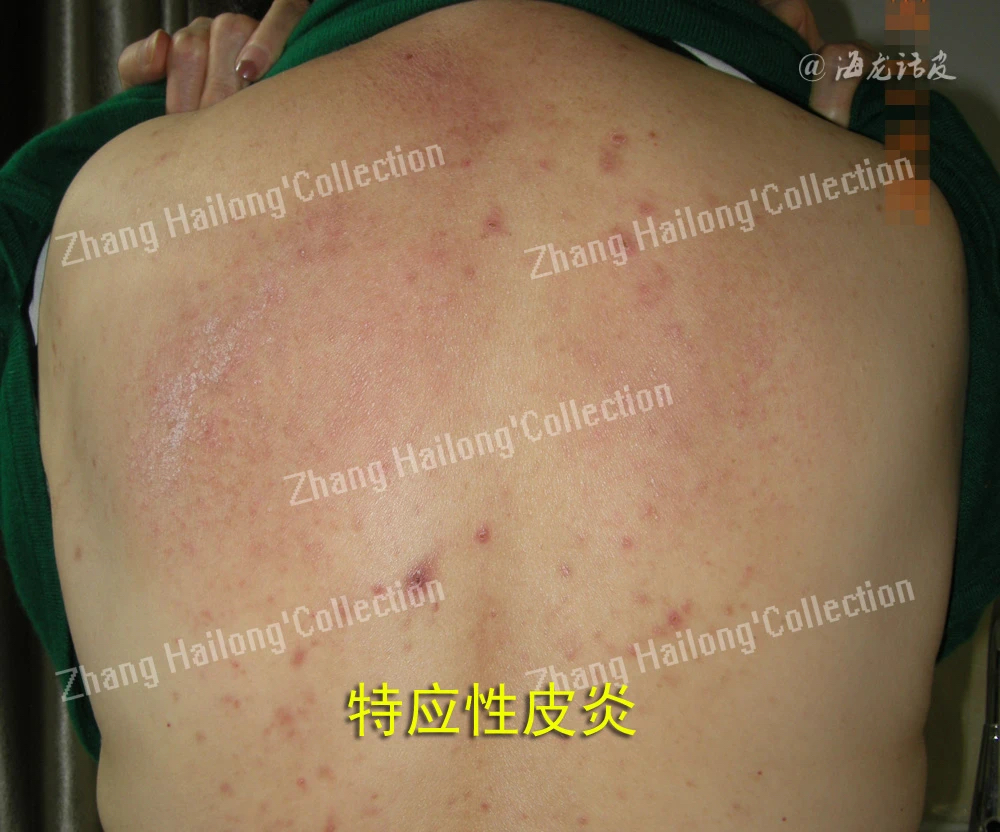
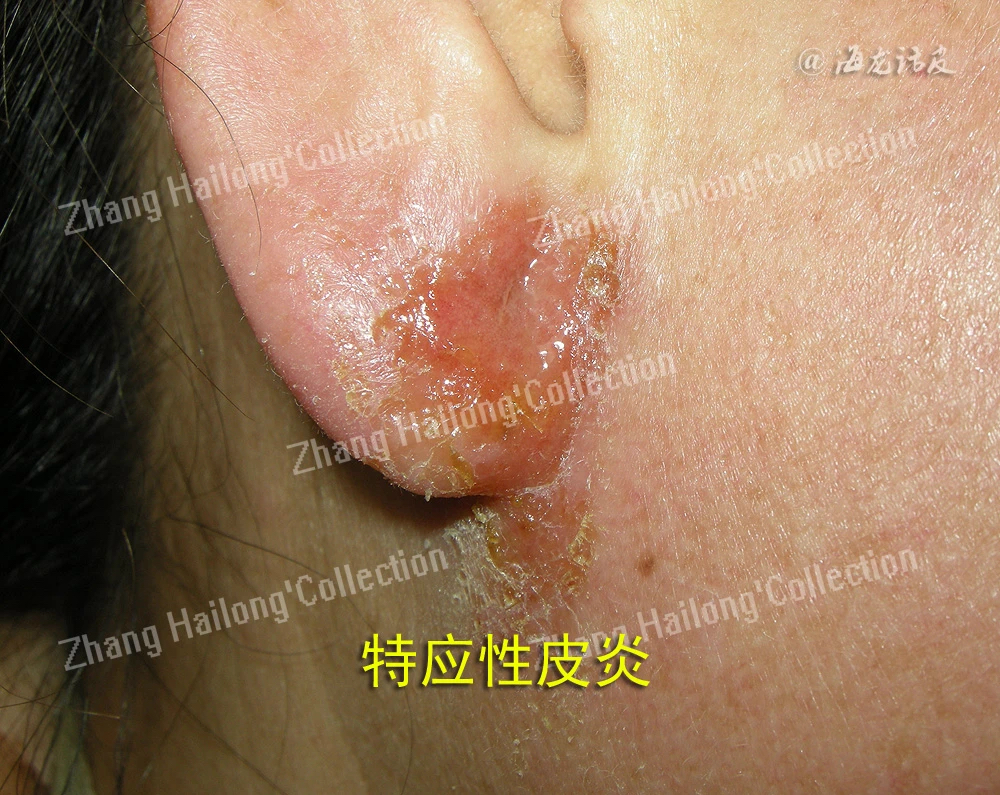
特应性皮炎是一种慢性、复发性、炎症性皮肤病,发病机制复杂,涉及遗传易感性、表皮功能障碍、皮肤微生物组异常、免疫失调和神经免疫系统,但目前尚未完全阐明,其中皮肤屏障功能障碍和免疫功能异常被认为是关键因素,尤其是Th1/Th2分化失衡造成异常的细胞因子分泌。特应性皮炎患者往往伴有剧烈瘙痒,特应性皮炎的迁延不愈对患者的身心健康造成严重影响,严重影响生活质量。患者常合并过敏性鼻炎、哮喘等其他特应性疾病,故被认为是一种系统性疾病。过去30年全球范围内特应性皮炎患病率逐渐增加,大约15%~30%的儿童和2%~10%的成年人患有特应性皮炎,中度至重度的患者多达20%。我国的特应性皮炎发病率在近10年来增长迅速。
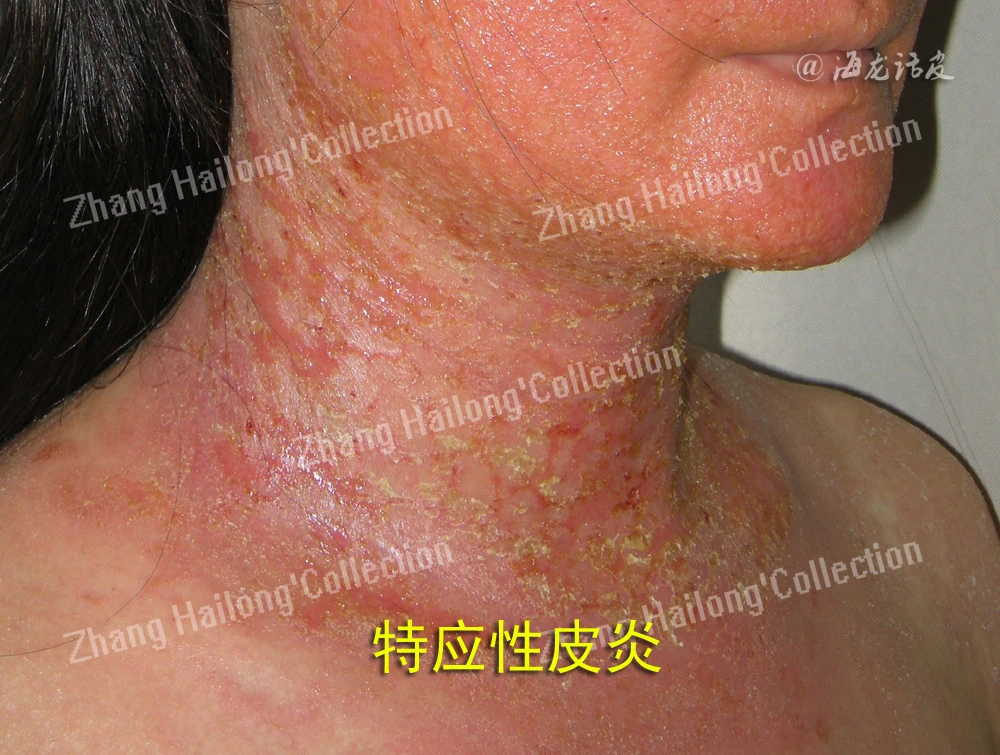
由于TRPV3在维持皮肤稳态中的发挥重要作用,越来越多的研究证明TRPV3与特应性皮炎的发生发展密切相关。在2,4-二硝基氟苯(DNFB)诱导的特应性皮炎小鼠模型中,TRPV3在小鼠皮肤组织中的表达水平显著增加。使用特应性皮炎患者皮损皮肤样本进行的实时PCR分析也可证明TRPV3在人体皮损皮肤中表达增加,且特应性皮炎患者皮肤的角质形成细胞中TRPV3的热诱导通道活性增强。
Th2细胞因子对TRPV3通道的调节
Th2型炎症是特应性皮炎的基本特征,不同Th2细胞因子之间的串扰导致TRPV3功能的增强,并且TRPV3可通过激活NF-kB上调人类角质形成细胞对Th2炎症的反应。TRPV3活化诱导角质形成细胞分泌的Th2细胞因子主要是IL-31,Th2-TRPV3通道的连接为治疗特应性皮炎提供了广阔的前景。
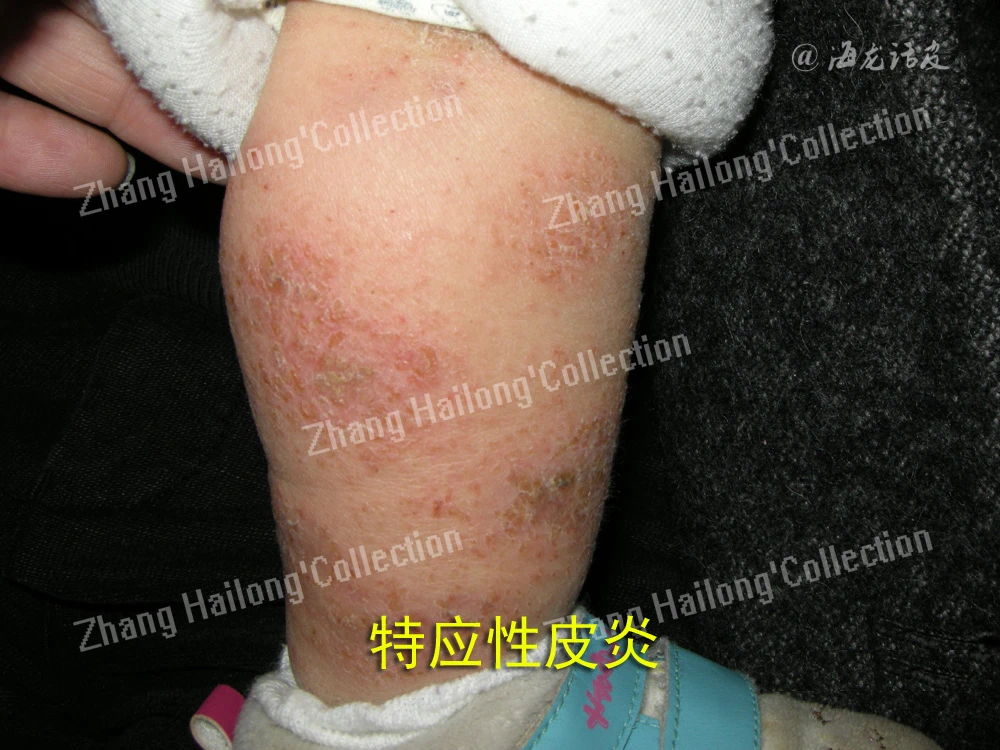
IL-31是特应性皮炎发病机制中的关键细胞因子,IL-31的过度表达可导致皮肤的剧烈瘙痒。IL-31可通过B型促尿钠排泄肽(B-type natri-uretic peptide,BNP)促进TRPV3的分泌。BNP是瘙痒从感觉水平传递到脊髓的一种重要神经肽,IL-31可在感觉背根神经节神经元中上调BNP的合成和释放。研究证明使用BNP刺激人体角质形成细胞,可导致TRPV3 mRNA水平显著增加。IL-31诱导合成的BNP与角质形成细胞上的神经肽受体1结合,通过囊泡转运和膜插入增加细胞表面的TRPV3水平,从而促进瘙痒传导。IL-31-BNP-TRPV3扩增级联增强人角质形成细胞释放引起特应性皮炎患者的严重瘙痒的Serpin E1。IL-31还可通过调节TRPV1通道间接促进角质形成细胞分泌TRPV3。
PAR2-TRPV3通路
蛋白酶激活受体2(protein-ase-activated receptor2,PAR2)是一种属于蛋白酶激活受体家族的G蛋白偶联受体。在皮肤炎症过程中,释放的促炎因子可能导致PAR2的激活,进而引发炎 症反应和瘙痒感。在特应性皮炎的发病过程中,PAR2的激活与瘙痒症状的发生密切相关。PAR2-TRPV3信号级联在特应性皮炎瘙痒中起关键作用,角质形成细胞中PAR2信号传导需要TRPV3,使用PAR2激动剂刺激TRPV3敲除小鼠,与对照组相比,TRPV3敲除小鼠的瘙痒程度较轻。
PAR2作用于TRPV3上游,通过PLC-Ca2+信号使TRPV3敏化。使用实时PCR来量化PAR2过表达小鼠皮肤中TRPV3的表达,与年龄匹配的野生型小鼠对照,病变小鼠皮肤中TRPV3转录物显著增加。PAR2和TRPV3特应性皮炎发展中的作用也可相互独立,Barr等研究支持PAR2和TRPV3在特应性皮炎发展相互独立。
TRPV3在特应性皮炎中的治疗进展
TRPV3在皮肤屏障功能和瘙痒感受中发挥重要作用,近来多种植物来源的天然TRPV3拮抗剂陆续被发现,在动物实验中显示可减轻特应性皮炎相关的瘙痒和皮肤炎症。Kang等发现刺蒺藜果实提取物可改善特应性皮炎小鼠的皮肤炎症,其作用机制与钙通道的调节和肥大细胞的活化有关。Nam等发现多根螺旋体的提取物可以通过调节Orail和TRPV3钙离子通道的活性并抑制肥大细胞脱颗粒来治疗特应性皮炎中的异常皮肤屏障病变。Qi等证明两种天然异绿原酸异构体具有治疗皮炎和慢性瘙痒的潜力。Qu等证明天然蛇床子素对TRPV3的抑制以剂量依赖性方式逆转了炎性背侧皮肤和耳水肿的严重程度,降低了炎性因子TNF-ɑ和IL-6的表达,可减轻特应性皮炎小鼠皮肤的瘙痒感觉。Zhang等证明连翘酯苷B是连翘叶的活性成分,可通过抑制NF-KB信号传导抑制皮肤炎症反应和瘙痒,未来可应用于特应性皮炎的治疗中。Wang等证明黄芩素可通过直接抑制TRPV3的活性来改善香芹酚诱导的特应性皮炎小鼠的皮肤炎症。从植物中提取的TRPV3拮抗剂仍处于动物实验阶段。这些研究为治疗特应性皮炎提供了新的潜在药物候选物,但目前还不足以将这些植物提取物和天然化合物用于临床实践,需要进一步的临床研究来确认它们对特应性皮炎患者的安全性和有效性。
TRPV3-EGFR通路与Olmsted综合征
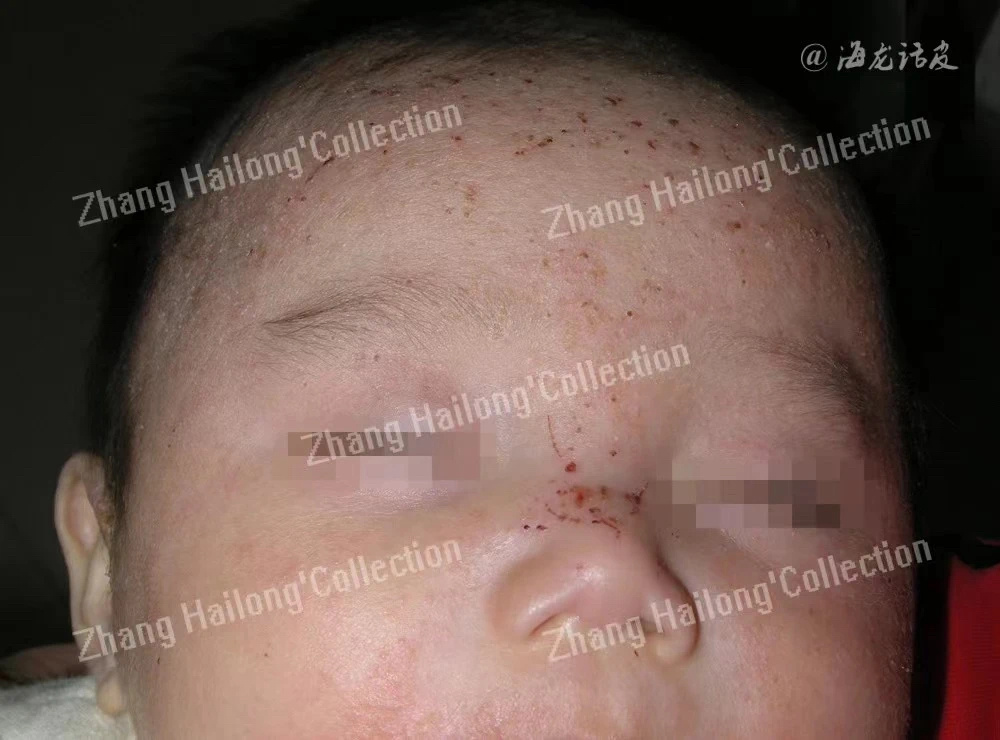
TRPV3的遗传获得功能突变可导致一种罕见的Olmsted综合征先天性疾病,其特征是掌跖、口周角化病、脱发和严重瘙痒。在一些病例中还观察到其他症状,如甲营养不良、口腔白角化病、角膜病变等。研究表明TRPV3突变相关Olmsted综合征患者在使用表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂厄洛替尼后病情得到缓解,这一发现表明EGFR信号传导对于TRPV3突变引起的OS发病机制可能至关重要。
EGFR是上皮生长因子细胞增殖和信号传导的受体,通过促进表皮细胞的增殖和迁移来促进伤口愈合和皮肤再生。TRPV3通道与EGFR信号相互作用并调节EGFR信号传导,这种相互作用对于角质形成细胞的增殖和终末分化、毛发形态发生和皮肤屏障的维持至关重要。TRPV3通过Ca2+/Ca MKII→TGFα/EGFR→PI3K→NF-KB信号通路促进角质形成细胞增殖。Cheng等观察到,缺乏TRPV3的小鼠毛发形态发生缺陷与缺乏EGFR的小鼠毛发形态缺陷极为相似,实验进一步证明了TRPV3通道能通过调节TGF-α/EGFR信号传导从而影响皮肤屏障建立和毛发生成。在角质形成细胞中,TRPV3与EGFR形成信号复合物,其活性受EGFR偶联信号通路的调节。低水平的TRPV3通道开放引导了钙离子流入,以“反式 激活”的方式促进了TGF-α信号分子的产生,EGFR磷酸化水平升高,然后导致EGFR下游通路PI3K和NF-KB的激活,促进细胞增殖和表皮增厚,调控皮肤屏障建立。TGF-α对EGFR的激活触发下游激酶的激活,即丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,从而产生最终效应物,即细胞外信号调节蛋白激酶(extra cell ular signal-regulated protein kinases,EPK)。EGFR对TRPV3的增敏作用是由ERK介导的,低水平的TRPV3诱导EGFR依赖性信号传导,进而通过在正反馈回路中激活ERK来扩增TRPV3 。
TRPV3与其他炎症性皮肤病
炎症性皮肤病是指皮肤的炎症反应,表现为皮肤发红、肿胀、瘙痒或脱屑。常见的炎症性皮肤病,包括特应性皮炎、银屑病、酒渣鼻和烧伤后瘙痒,给患者带来沉重负担。炎症性皮肤病的临床表现各不相同,但可能具有共同的生理病理途径。研究证明除特应性皮炎外,其他炎症性皮肤病也与TRPV3密切相关。
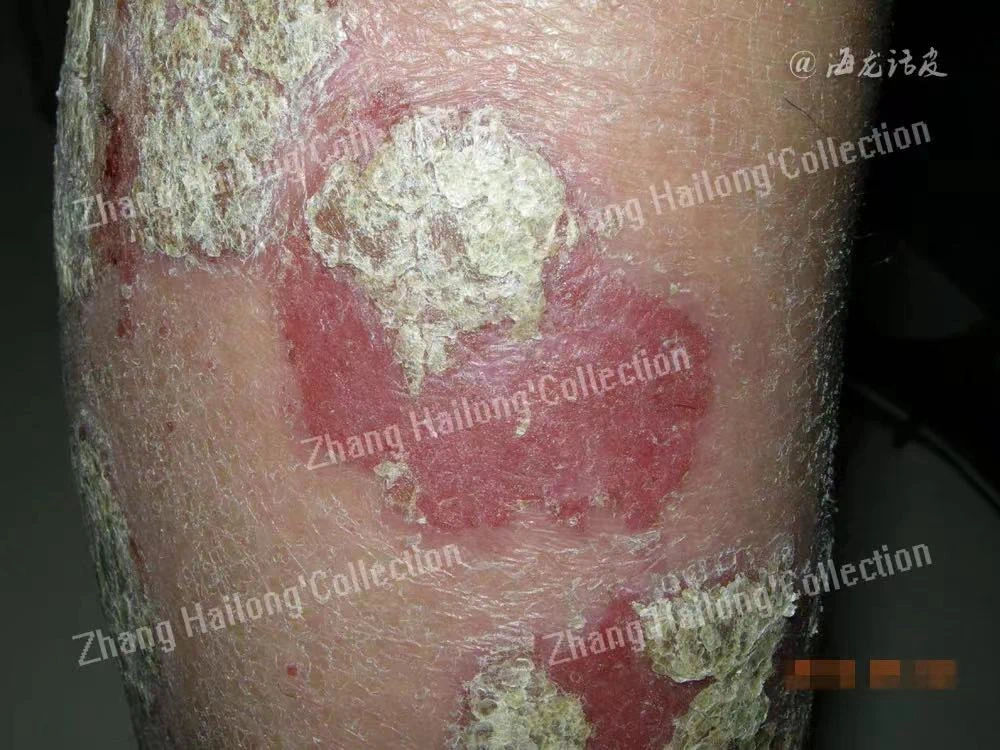
TRPV3可促进表皮增殖,表明TRPV3在促进伤口愈合和调节瘢痕形成方面的潜力,但TRPV3的过度激活会导致瘙痒感。烧伤患者创伤愈合的过程中细胞内Ca2+水平的增加、TRPV3的表达增加,导致患者的瘢痕增生,同时促进TSLP从角质形成细胞中释放,使瘢痕组织的瘙痒加重。Kim等在烧伤患者的瘢痕上使用TRPV3的激动剂香芹酚,证明香芹酚会加重患者瘢痕的瘙痒,一般的抗组胺药物很难减轻烧伤后的瘙痒,TRPV3的调节可能是烧伤患者瘙痒的一个可能的治疗靶点。同时有研究发现浓度低于100μM香芹醇可促进人角质形成细胞的增殖,但在300μM时,细胞活力降低,这证明TRPV3存在非单调增殖效应,TRPV3的适度激活促进增殖,强烈激活导致细胞死亡。因此,找到合适剂量的TRPV3激活剂以促进皮肤再生并最大限度地减少副作用是我们面临的一个挑战。
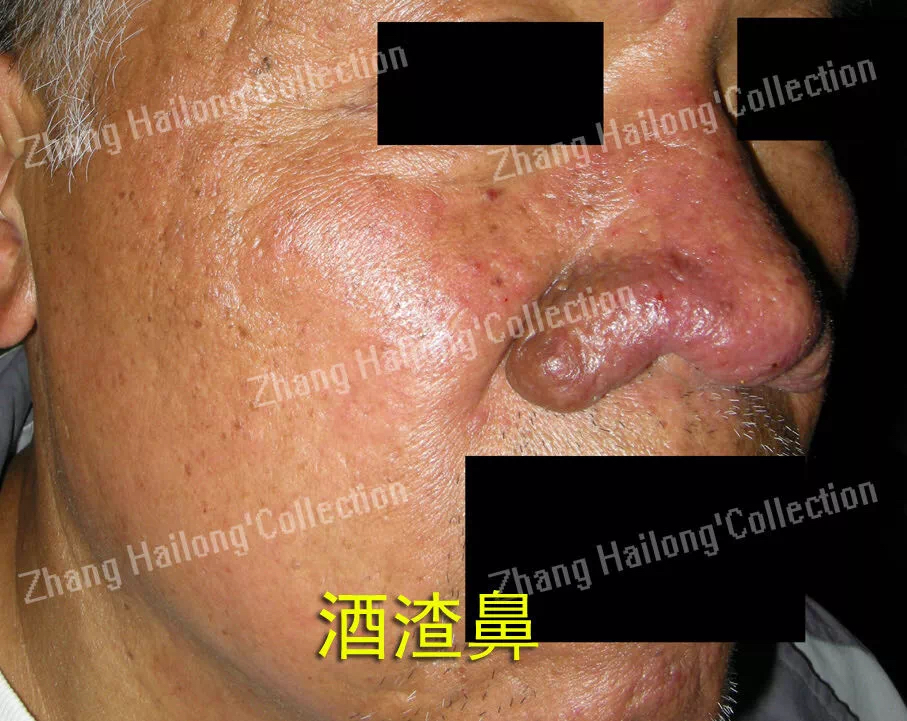
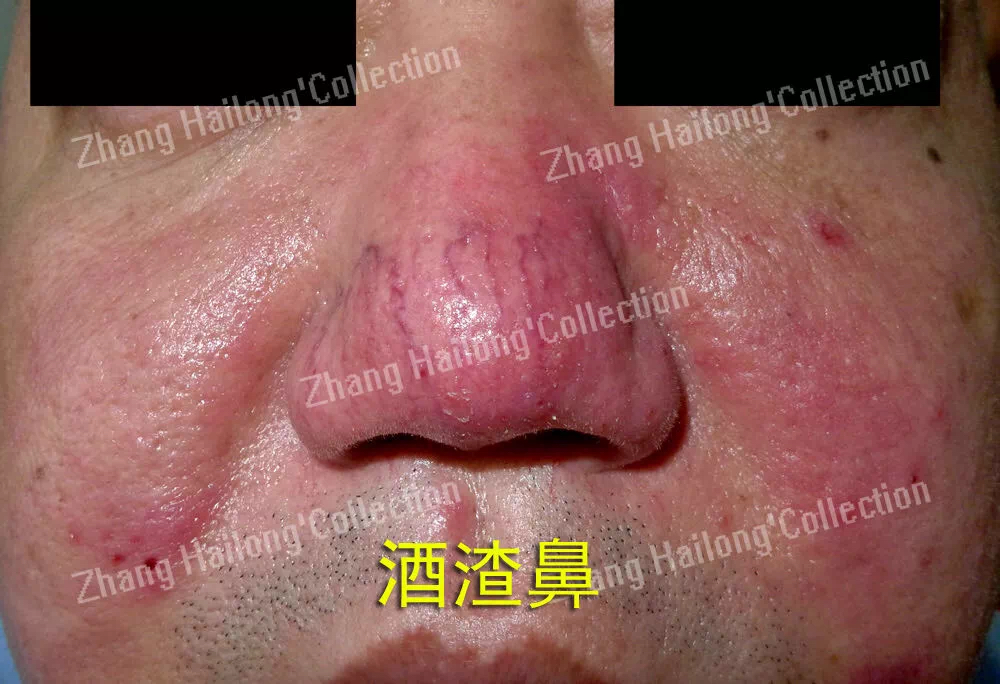
酒渣鼻患者的免疫细胞和成纤维细胞中TRPV3的免疫染色增加,TRPV3可能通过调节角质形成细胞,在酒渣疮的炎症和纤维化过程中起作用。而TRPV3与银屑病的关系目前存在矛盾,临床数据表明,TRPV3在银屑病患者的角质形成细胞中的表达显著增加。TRPV3的激活可诱导NO的产生,NO可调节血管紧张度和血管舒张,角质形成细胞通过激活TRPV3释放NO介导血管舒张进而引发银屑病的红斑。但Özcan等采用PCR检测银屑病患者TRP通道的mRNA表达水平。与对照组相比,患者组的TRPV3基因表达水平降低,需要进一步的研究证明TRPV3与银屑病的具体关系。
小结与展望
TRPV3在皮肤角质形成细胞中表达最为丰富,对 维持皮肤稳态有着重要作用,TRPV3参与角质形成细胞增殖、皮肤屏障形成、感觉传导、毛发生长等生理过程,且与皮肤炎症和瘙痒密切相关。目前越来越多的研究结果表明TRPV3在多种皮肤病的发生发展中发挥重要作用。虽然TRPV3可成为治疗多种皮肤病的一个很有前景的治疗靶点,但TRPV3在瘙痒通路中的具体作用和TRPV3的临床疗效还需要进一步证明。如何使TRPV3在治疗方面发挥进一步作用,我们任重道远。

