好文推荐 | 中老年突发感音神经性聋患者脑小血管病负荷的危险因素分析
时间:2024-01-12 21:03:58 热度:37.1℃ 作者:网络
摘要
目的 本研究旨在探讨中老年突发性感音神经性聋患者脑小血管病负荷增加的危险因素。方法 回顾性收集2019年5月—2023年5月因突发性感音神经性聋住院的中老年患者临床资料,分析其临床表现、听力学检查及影像学特征。评估所有入组患者的脑小血管病(cerebral small vascular disease,CSVD)总负荷,比较不同程度负荷患者(0分、1分、2分和≥3分)的临床及听力等特征差异,通过有序Logistic回归探究中老年突发感音神经性聋(sudden sensorineural hearing loss,SSNHL)患者CSVD总负荷升高的独立危险因素。结果 共纳入206例SSNHL患者,包括男性94例、女性112例,平均年龄(58.70±7.98)岁。CSVD总负荷0分组108例(52.4%),1分组54例(26.2%),2分组29例(14.0%),≥3分组15例(7.2%)。单因素分析显示不同CSVD负荷组间的年龄、高血压、饮酒史、LDL>3.1 mmol/L、发病时是否伴随眩晕差异有统计学(P<0.05)。Logistic回归显示增龄(OR=1.050;95%CI 1.023~1.077)、高血压(OR=1.584;95%CI 1.036~2.422)、饮酒史(OR=2.304;95%CI 1.415~3.754)、发病时伴眩晕(OR=1.691;95%CI 1.085~2.637)是45岁及以上突发性感音神经性聋患者CSVD总负荷升高的独立危险因素。结论 增龄、高血压、饮酒史、发病时伴眩晕是中老年突发感音神经性聋患者CSVD总负荷升高的独立危险因素,对此类患者临床医生应注意进行影像学评估以早期识别CSVD。
突发性感音神经性聋(sudden sensorineural hearing loss,SSNHL)指72 h内发生的原因不明的感音神经性听力损失,中国突发性聋指南(2015)定义为连续两个频率听力下降≥20 dB。SSNHL是急诊科、神经内科、耳鼻喉科的常见急症,常伴有头晕、眩晕、耳鸣等症状,其病因及发病机制尚不明确。SSNHL患者可能比正常人具有更高的脑血管病风险。
近年来,SSNHL的血管性因素日益被关注。一方面,可能与SSNHL与脑血管的危险因素存在重叠有关,如高血压、糖尿病等代谢综合征。另一方面,动脉硬化累及全身各种类型动脉,除了基底动脉和/或小脑前下动脉(anterior inferior cerebellar artery,AICA)动脉硬化导致远端内听动脉缺血之外,动脉硬化危险因素的共同作用可能导致内耳微血管与脑内微血管同时受累。既往研究发现,SSNHL患者比一般人群脑白质病变(white matter lesion,WML)发生率相对更高,尤其是48~60岁的患者,且存在WML的患者较不存在WML的患者的听力恢复率更低。因此,中老年SSNHL患者CSVD总体负荷可能高于一般人群,且脑小血管病总负荷与听力的恢复有一定联系。
脑小血管病(cerebral small vascular disease, CSVD)是中老年人最常见的脑血管疾病之一。50岁以上人群约占5%,而90岁以上人群则几近100%。尽管CSVD起病隐匿,但该病会导致大约25%的缺血性卒中和部分脑出血,以及约45%~50%的痴呆。此外,CSVD还与卒中后不良预后有关。
SSNHL与CSVD的研究涉及耳鼻喉科与神经科交叉领域,目前尚缺乏中老年SSNHL患者CSVD影像负荷危险因素的研究。随着我国社会人口老龄化,早期识别中老年SSNHL患者高危CSVD风险,早期干预,对改善该类患者的整体预后具有一定临床意义。本研究连续入组2019年5月—2023年5月就诊于首都医科大学附属北京天坛医院符合纳入和排除标准的SSNHL患者,旨在探究中老年SSNHL患者CSVD影像总负荷的危险因素,为早期识别此类高风险患者提供参考。
1 资料与方法
1.1 研究对象
本研究为回顾性研究,回顾性分析2019年5月—2023年5月期间,首都医科大学附属北京天坛医院耳鼻喉头颈外科和眩晕诊疗中心连续收治的突发性感音神经性聋住院患者958例。
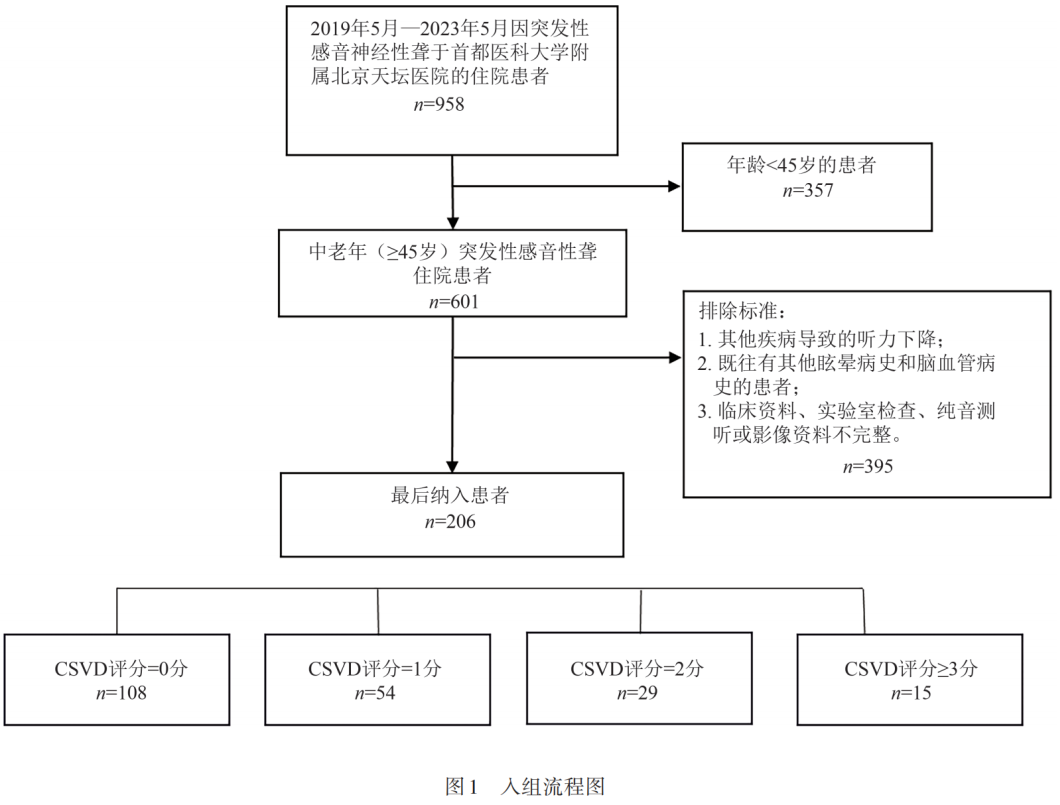
纳入标准:(1)年龄≥45岁;(2)以SSNHL入院,符合中国《突发性聋诊断和治疗标准(2015)》;(3)住院期间完成头部MRI+MRA检查且影像质量达标,有完整、可用于影像判读的T1、T2、Flair、SWI、MRA序列。排除标准:(1)其他疾病导致的听力下降;(2)既往有其他眩晕病史和脑血管病史的患者;(3)临床资料、实验室检查、纯音测听或影像资料不完整。符合以上纳入和排除标准的患者共206例,入组流程(见图1)。
1.2 基线信息收集
通过电子病历系统收集患者的人口学信息,以及既往高血压、糖尿病、高脂血症史,吸烟、饮酒史。其中,吸烟史定义为在入院前至少每天吸1支烟,超过6个月;饮酒史定义为根据患者的自我报告,每周3次以上摄入100 ml以上的烈酒。记录发病时的伴随症状,包括有无头晕、眩晕、不稳、耳鸣、耳闷胀感、头痛等。头晕、眩晕、不稳症状的标准参考Drachman和Hart在1972年提出的头晕分类。而耳鸣是指对实际不存在的声音的感知。所有数据均由2名调查人员独立提取、输入和统计分析。收集患者住院期间血脂指标如低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-c)、高密度脂蛋白胆固醇(High density lipoprotein-cholesterol,HDL-c)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC),肝肾功能指标如谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、肾小球滤过率(glomerular filtration rate,GFR)及尿酸(urine acid, UA)。
1.3 听力特征分析
收集患者纯音音阈测定结果,纯音音阈测定均为Astera纯音测听设备(ISO/EC17025)完成,记录受损耳的0.5 kHz、1 kHz、2 kHz、4 kHz气导听阈平均值即平均听阈。听力下降程度按照WHO1997年标准分度,分为轻度(21~40 dB)、中度(41~60 dB)、重度(61~80 dB)、极重度(≥80 dB)。听力下降曲线类型按照突发性聋诊断和治疗指南(2015)进行分型,分为低频下降型、高频下降型、平坦下降型和全聋型。在本研究中双侧突发性听力下降定义为有突然发生的双耳听力下降的症状,且入院后双耳的纯音测听结果符合SSNHL的诊断标准。按听力下降更严重一侧的听力情况进行归类入组。
1.4 影像特征分析
对纳入的所有SSNHL患者进行头部核磁脑小血管病影像标记物的评估,并计算总负荷得分。头部核磁共振影像学判读由1名经过培训的血管神经病学专业高年资医师及1名神经影像科医师共同完成,保证评定结果的准确及可靠性。影像评估内容包括结构影像和磁共振血管成像。
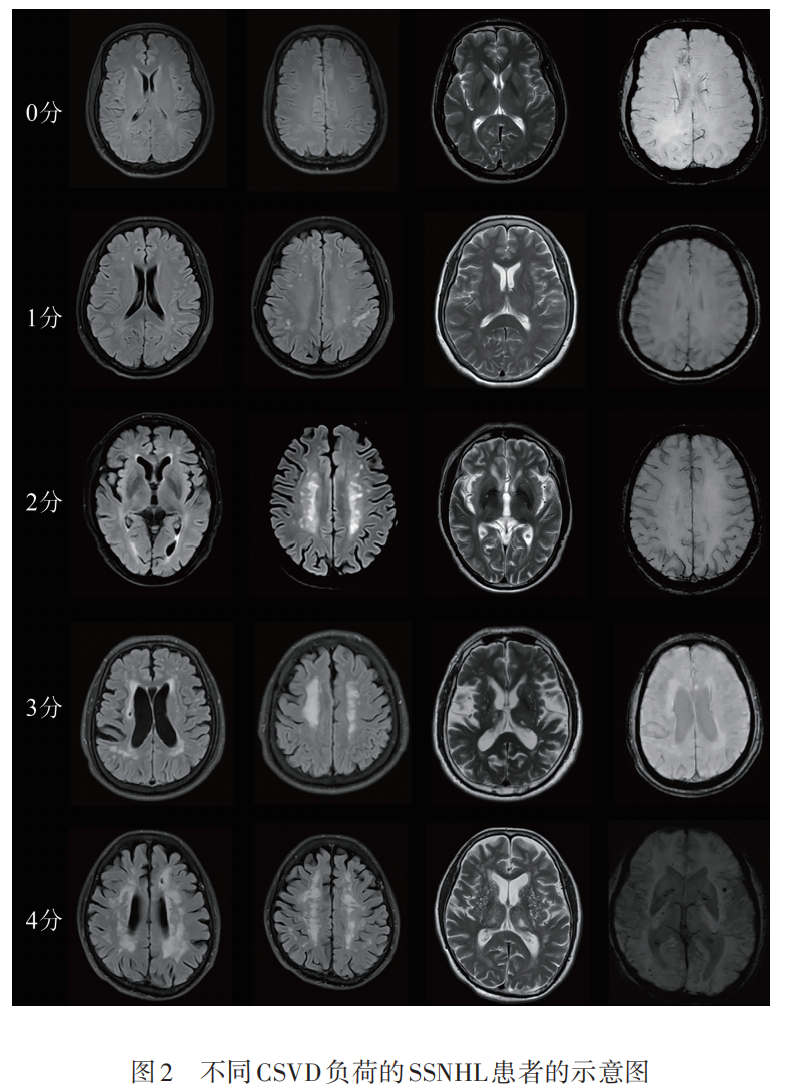
结构影像学特征评估主要包括脑白质病变、微出血、血管周围间隙、腔隙,MRA成像主要评估颅内大动脉狭窄情况。脑白质病变、微出血、血管周围间隙等脑小血管病影像特征评定标准参考脑小血管病影像评估的STRIVE标准。脑白质病变评级方式参照Fazekas评分(0~3分),在Flair序列辅以T2序列中判读,按部位分为侧脑室旁和深层白质。腔隙评估按部位分为皮质下白质(如半卵圆中心、放射冠、胼胝体)、基底节区(如尾状核、壳核、苍白球、内囊、丘脑)及脑干。血管周围间隙扩大(enlarged perivascular space,EPVS)分为基底节区和半卵圆中心,均选择数量最多的层面计数单侧,按照0级:无EPVS;1级:≤10 EPVS;2级:11~20 EPVS;3级:21~40 EPVS;4级:>40 EPVS进行分级。微出血在SWI序列中判读,主要计数微出血位置及数目。按照脑小血管病影像负荷评分标准:(1)Fazekas评分中深部白质病变评分≥2分和(或)脑室旁白质病变评分为3分计1分;(2)≥1个腔隙计1分;(3)基底节区中重度(2~4级)EPVS计1分;(4)≥1个深部或幕下微出血计1分;统计SSNHL患者的CSVD影像负荷总分(0~4分)(见图2)。颅内大动脉狭窄的评估主要根据MRA,辅以血管超声、TCD、CTA等,主要判断有无颅内大动脉狭窄,包括颈内动脉(颅内段)、大脑中动脉(M1-M3段)、大脑前动脉(A1段)、大脑后动脉(P1-P3段)、椎动脉(颅内段)、基底动脉。
1.5 统计方法
应用SPSS 26.0统计软件,计量资料以(x±s)表示,计数资料以数量和百分比表示。单因素分析中符合正态分布的计量资料多组间进行方差分析、不符合正态分布的计量资料进行Kruskal-Wallis检验;计量资料进行卡方检验或Fisher精确检验。将单因素分析中P<0.05的变量纳入有序Logistic回归分析中,拟合方程确定SSNHL患者CSVD负荷的独立危险因素。以P<0.05为差异具有统计学意义。
2 研究结果
2.1 基线信息及不同CSVD总负荷SSNHL患者的信息比较
本研究共纳入206例SSNHL患者。包括男性94例、女性112例,平均年龄(58.70±7.98)岁。根据CSVD总负荷(0~3分)将其分为4组。单因素分析显示(见表1),4组患者间的年龄、高血压、饮酒史有统计学差异(P<0.05)。伴随症状方面,共有88例(42.72%)SSNHL患者发病时伴有头晕,50例(24.27%)伴眩晕,11例(10.19%)伴不稳感,165例(80.10%)伴有耳鸣,8例(3.88%)伴有头痛,91例(44.17%)伴有耳闷胀堵感。其中SSNHL伴眩晕4组间比较时差异有统计学意义(P=0.039),CSVD负荷更高的患者伴随眩晕症状比例更高。实验室化验指标方面,低密度脂蛋白(>3.1)在不同CSVD负荷组间差异有统计学意义(P=0.046)。
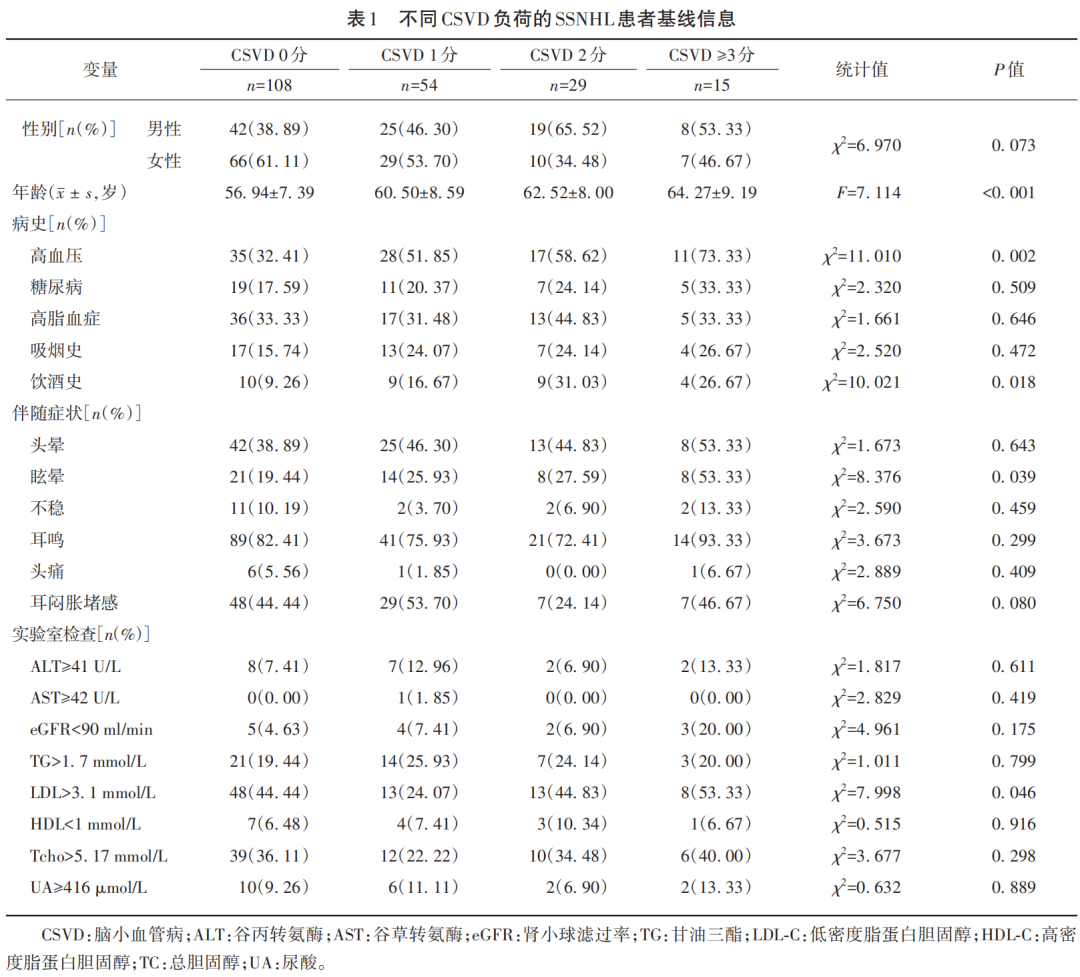
听力下降方面(见表2),虽然本研究详细分析了听力程度及听力曲线类型,但是并未发现不同CSVD负荷的患者之间存在明显差异。在颅内大动脉狭窄方面,206例中老年SSNHL患者中44例(21.36%)存在颅内大动脉狭窄,4组间之间无统计学差异(P=0.194)。

2.2 SSNHL患者CSVD总负荷的独立危险因素
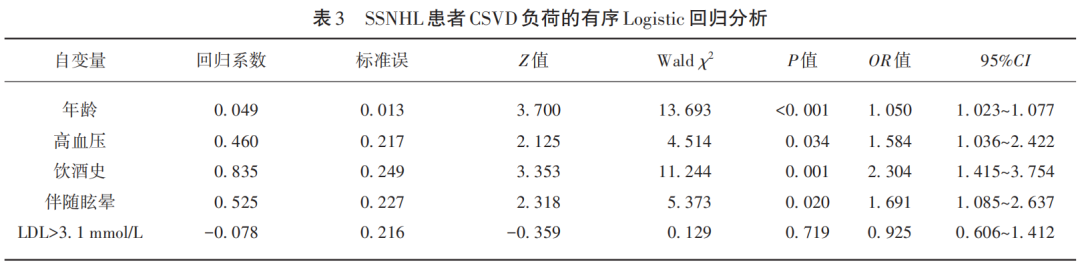
根据临床实际情况及单因素分析的结果,我们将有意义(P<0.05)的变量纳入有序Logistic回归模型中。我们发现增龄、高血压、饮酒史及伴随眩晕为CSVD总负荷评分增高的独立危险因素(见表3)。
3 讨 论
近年来,SSNHL的血管源性机制引起广泛的关注。虽然不少研究者探究了SSNHL与小脑前下动脉及后循环梗死之间的关系,但较少有人关注SSNHL与CSVD的关联。本研究探究了SSNHL患者中CSVD的发病情况及其影像总负荷评分增高的危险因素。研究结果显示,增龄、高血压、发病时伴眩晕及饮酒史是中老年突发感音神经性聋患者脑小血管病负荷增高的独立危险因素,听力相关特征和CSVD负荷增高无明显关系。
众所周知,年龄是脑小血管病(CSVD)的主要危险因素。随着年龄增长,CSVD的发病率也会增加。之前的研究表明,50岁以上的人群中CSVD的发病率约为5%。本研究中,中老年SSNHL患者的平均年龄为(58.70±7.98)岁,98例患者(47.57%)CSVD总负荷评分≥1分,提示SSNHL患者中CSVD的发病率可能相对一般人群较高。Lin等人的研究发现在1 423例SSNHL患者中,高血压、糖尿病和高脂血症的发生率明显高于作为对照组的5 692例因阑尾切除术而住院的一般患者,这说明了伴发多种血管危险因素可能是导致SSNHL患者中CSVD发病率较高的原因。本研究发现,中老年SSNHL人群中,年龄是CSVD总负荷评分升高的一个危险因素(OR=1.050;95%CI 1.023~1.077)。Shin等人的研究也有类似发现,即年龄的增长与SSNHL患者的脑白质病变Fazekas评分的增加相关,但其只关注了白质病变、缺乏对能更好的反映全脑小血管情况的总负荷评分的评估。
高血压是SSNHL患者CSVD负荷增高的另一个独立危险因素(OR=1.584;95%CI 1.036~2.422)。这与之前的发现类似,即伴有高血压的SSNHL患者的Fazekas评分更高,且伴高血压的SSNHL患者听力较差。高血压可引起血管舒缩功能障碍,使神经血管单元中的动脉硬化、管壁增厚、管腔狭窄甚至闭塞。长此以往导致全脑或局部脑灌注下降,从而引发白质纤维束的损伤,这种损伤表现为完全和不完全梗死(腔隙)、微出血和脑白质病变等病理变化。而关于内听动脉的血压调节失衡(blood pressure dysregulation,BPD)的假说可追溯到1972年Fisch等人在耳蜗-前庭血液循环的描述。BPD与年龄、高血压等血管危险因素有关,它源于耳蜗动脉粥样硬化(cochlear atherosclerosis,CA),在这种病理变化中,内听动脉血管外膜失去了成纤维细胞,由于纤维玻璃样变而变厚,同时肌成纤维细胞的数量减少,导致肾上腺素能对肌成纤维细胞的调节作用降低。因此,内听动脉内径的减小和BPD可能在 SSNHL 中起着核心作用,尤其是在血浆黏度、红细胞变形指数和血小板聚集发生变化之后。因此,我们谨慎认为,脑小血管循环和耳蜗-前庭循环可能存在相似的病理生理学特征。此外,本研究发现,饮酒史也是CSVD总负荷升高的危险因素(OR=2.304;95%CI 1.415~3.754)。乙醇可直接刺激血管壁,使血管失去弹性,酒精在体内中间代谢产物乙醛具有强烈的脂质过氧化反应和毒性,也可损伤血管内皮细胞膜系统。对于高龄、有高血压、有饮酒史等血管危险因素的SSNHL患者,有必要及早进行全面序列的MRI评估,并早期关注CSVD相关症状,如步态、认知、情绪情感等。
伴随症状方面,研究结果显示SSNHL伴眩晕者共51例(24.75%)、其中有30例(58.8%)CSVD评分≥1分。既往研究提示,以头晕/眩晕入院的患者61.4%经影像评估诊断为CSVD,与本研究结果类似,提示头晕/眩晕患者CSVD的发生率较高。Ahmad等人的研究也发现,在不明原因头晕的患者中,脑白质病变的严重程度比明确头晕病因如良性阵发性位置性眩晕的患者增加,表明表现为CSVD的慢性脑灌注不足可能是不明原因头晕的潜在病因。另外,回归分析显示,SSNHL患者中伴随眩晕是CSVD总负荷升高的独立危险因素(OR=1.691;95%CI 1.085~2.637)。既往Chang等人曾发现,突发性听力下降伴眩晕的患者相比单独听力下降或单独眩晕患者有更高的卒中风险(HR=2.21;95%CI 1.31~3.72),且随着两种症状出现时间间隔缩短,卒中风险有逐渐增大的趋势。这说明合并眩晕的SSNHL可能往往提示血管源性SSNHL。未来需要更大样本量的前瞻性研究进一步证实这一结果。
除上述因素以外,本研究未发现听力下降程度及听力下降曲线类型与CSVD负荷升高之间明确的关联。不除外本研究使用的听力下降类型及程度的分类方法敏感性不高的可能。有研究发现在SSNHL患者中,脑白质病变Fazekas评分为2分的患者纯音听阈平均值高于1分的患者(P<0.05),但尚未在Fazekas评分为0分与1分之间发现听力下降程度之间的显著差异。相比轻中度听力下降,重或极重度听力下降SSNHL患者CHADS2评分更高(OR=1.86;95%CI 1.29~2.71),提示听力下降的程度与患者动脉粥样硬化呈正相关。SSNHL患者听力下降程度可能与脑小血管病的病因方面存在潜在的联系,但尚不足以用来评估CSVD负荷升高的风险。
另有研究发现,没有WML的SSNHL患者发病30 d后听力完全恢复的概率为42.9%,而有WML 的患者则为11.6%(P=0.017),表明脑白质病变等影像标志物对SSNHL患者听力恢复有提示意义。我们谨慎的认为,SSNHL可能是CSVD潜在的先发症状或者共病。在此基础上,未来这方面的基础或遗传层面的研究可能有助于我们更好的理解。
本研究存在一定局限性。首先,样本量较小、仅纳入了住院患者,可能存在一定程度上的选择偏倚。未来需要更大样本量的前瞻性研究进行验证。其次,本研究缺乏对SSNHL与CSVD之间关系更深层机制的研究,未来需要更精密全面的检查手段分析CSVD与SSNHL病因与形成机制之间的关联。
总之,本研究通过全面判读206例患者的CSVD的4个影像标记物并根据其严重程度分组,发现了增龄、高血压、发病时伴眩晕及饮酒史对于SSNHL患者CSVD负荷升高的预测意义。这可能有助于临床医生通过这些指标早期发现可能的高危CSVD患者并早期控制危险因素。同时,这些因素可能也有助于预判此类患者未来听力的恢复情况。
参考文献
[1]Editorial Board of Chinese Journal of Otorhinolaryngology Head and Neck Surgery;Society of Otorhinolaryngology Head and Neck Surgery CMA. Guideline of diagnosis and treatment of sudden deafness (2015)[J]. Chin J Otorhinolaryngol Head Neck Surg,2015,50(6):443-447.
[2]Rinaldi M,Cavallaro G,Cariello M,et al. Metabolic syndrome and idiopathic sudden sensori-neural hearing loss[J]. PloS One,2020,15(8):e0238351.
[3]Lin HC,Chao PZ,Lee HC. Sudden sensorineural hearing loss increases the risk of stroke:a 5-year follow-up study[J]. Stroke,2008,39(10):2744-2748.
[4]Fusconi M,Attanasio G,Capitani F,et al. Is there a relation between sudden sensorineural hearing loss and white matter lesions?[J]. Eur Arch Otorhinolaryngol,2019,276(11):3043-3049.
[5]Ciorba A,Bianchini C,Crema L,et al. White matter lesions and sudden sensorineural hearing loss[J]. J Clin Neurosci,2019,65:6-10.
[6]Cannistraro RJ,Badi M,Eidelman BH,et al. CNS small vessel disease:a clinical review[J]. Neurology,2019,92(24):1146-1156.
[7]Wardlaw JM,Smith C,Dichgans M. Small vessel disease:mechanisms and clinical implications[J]. Lancet Neurol,2019,18(7):684-696.
[8]Appleton JP,Woodhouse LJ,Adami A,et al. Imaging markers of small vessel disease and brain frailty,and outcomes in acute stroke[J]. Neurology,2020,94(5):e439-e452.
[9]Lau KK,Li L,Schulz U,et al. Total small vessel disease score and risk of recurrent stroke[J]. Neurology,2017,88(24):2260-2267.
[10]Song TJ,Kim J,Song D,et al. Total cerebral small-vessel disease score is associated with mortality during follow-up after acute ischemic stroke[J]. J Clin Neurol,2017,13(2):187.
[11]Tong X,Wang C,Liao X,et al. Smoking-thrombolysis relationship depends on ischemic stroke subtype[J]. Stroke,2016,47(7):1811-1816.
[12]Wang L,Yin L,Hua Y,et al. Fixed-dose combination treatment after stroke for secondary prevention in China:a national community-based study[J]. Stroke,2015,46(5):1295-1300.
[13]Drachman DA,Hart CW. An approach to the dizzy patient[J]. Neurology,1972,22(4):323.
[14]Schlee W,Hall DA,Edvall NK,et al. Visualization of global disease burden for the optimization of patient management and treatment[J]. Front Med,2017,4:86.
[15]Wardlaw JM,Smith EE,Biessels GJ,et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J]. Lancet Neurol,2013,12(8):822-838.
[16]Staals J,Makin SDJ,Doubal FN,et al. Stroke subtype,vascular risk factors,and total MRI brain small-vessel disease burden[J]. Neurology,2014,83(14):1228-1234.
[17]Shin SH,Wan Byun S,Jin Kim S,et al. Clinical significance of white matter lesions in idiopathic sudden sensorineural hearing loss[J]. J Int Adv Otol,2022,18(2):100-105.
[18]陈浩,冶学兰. 脑小血管病影像学标志物及总负荷的研究进展[J]. 中国实用神经疾病杂志,2023,26(5):646-649.
[19]Meissner A. Hypertension and the brain:a risk factor for more than heart disease[J]. Cerebrovasc Dis,2016,42(3-4):255-262.
[20]de Heus RAA,Reumers SFI,van der Have A,et al. Day-to-day home blood pressure variability is associated with cerebral small vessel disease burden in a memory clinic population[J]. J Alzheimers Dis,2020,74(2):463-472.
[21]Fisch U,Dobozi M,Greig D. Degenerative changes of the arterial vessels of the internal auditory meatus during the process of aging. A histological study[J]. Acta Otolaryngol,1972,73(2):259-266.
[22]Kano K,Tono T,Ushisako Y,et al. Magnetic resonance imaging in patients with sudden deafness[J]. Acta Otolaryngol Suppl,1994,514:32-36.
[23]Kidwell CS,Rosand J,Norato G,et al. Ischemic lesions,blood pressure dysregulation,and poor outcomes in intracerebral hemorrhage[J]. Neurology,2017,88(8):782-788.
[24]朱翠婷,胡文立. 头晕/眩晕患者脑小血管病总负荷的危险因素分析[J].中国卒中杂志,2022,17(4):354-359.
[25]Ahmad H,Cerchiai N,Mancuso M,et al. Are white matter abnormalities associated with unexplained dizziness?[J]. J Neurol Sci,2015,358(1-2):428-431.
[26]Chang TP,Wang Z,Winnick AA,et al. Sudden hearing loss with Vertigo portends greater stroke risk than sudden hearing loss or Vertigo alone[J]. J Stroke Cerebrovasc Dis,2018,27(2):472-478.
[27]Tsuzuki N,Wasano K,Oishi N,et al. Severe sudden sensorineural hearing loss related to risk of stroke and atherosclerosis[J]. Sci Rep,2021,11(1):20204.
作者信息
基金项目:中国医学科学院临床与转化医学研究专项(2022-I2M-C&T-B-116);科技创新2030-“脑科学与类脑研究”重大项目(2022ZD0211805)
作者单位:1.首都医科大学附属北京天坛医院神经病学中心,北京 100070;2.首都医科大学附属北京天坛医院眩晕临床诊疗中心,北京 100070;3.首都医科大学附属北京天坛医院耳鼻喉头颈外科,北京 100070;4.国家神经系统疾病临床医学研究中心,北京100070
通信作者:鞠奕,E-mail:[email protected]
引证本文
钟瑶,李红艳,刘改芬,等.中老年突发感音神经性聋患者脑小血管病负荷的危险因素分析[J].中风与神经疾病杂志,2023,40(11):976-982.



