郑州大学侯琳、张慧娟团队《AFM》:口服多药异靶共递送自乳化系统治疗糖尿病
时间:2023-12-12 10:38:30 热度:37.1℃ 作者:网络
2型糖尿病(T2DM)是一种以高血糖(BGL)为特征的复杂代谢性疾病,持续高血糖可引发胰岛β细胞功能障碍。目前临床治疗主要以控制BGL为主,仅能暂时缓解T2DM症状,但无法改善胰岛β细胞功能。因此,修复受损胰岛β细胞是实现T2DM根治的极具前景的新策略。研究表明,炎症和氧化应激是导致胰岛β细胞功能障碍的关键因素,姜黄素(CUR)具有良好的抗炎和抗氧化作用,因而具有潜在的抗T2DM应用前景。
然而,T2DM发病机制复杂,单一治疗方案效果有限。近年来,越来越多的研究揭示,肠道菌群紊乱与T2DM发生和发展的触发因素(如血糖摄取、粘膜免疫、肠通透性、胰岛素抵抗和全身性炎症)密切相关。双歧杆菌(Bifidobacterium, BI)作为最常用的益生菌,在调节肠道微生物紊乱、增强肠黏膜屏障功能、改善胰岛素抵抗、维持血糖稳态等方面具有很大的优势。因此,CUR和BI联合给药可有效提高对T2DM的治疗效果。
近期,郑州大学侯琳/张慧娟团队报道了一种基于自乳化技术的CUR和BI口服共递送系统(CUR-BI-SEDDS),该系统在修复胰岛β细胞功能方面表现出优异的疗效,每天只需给药一次即可维持全身葡萄糖稳态。相关工作以“Oral Multidrug Co-Delivery System Targeting Differential Sites for Diabetes Mellitus Treatment”为题发表在Advanced Functional Materials。

受含有益生菌的酸奶制备技术启发,本研究将自乳化策略引入到配方设计中。自乳化给药系统可以增加CUR的溶解度,提高其通过肠粘膜屏障的能力。最重要的是,SEDDS被肠上皮细胞吸收后可以进入淋巴循环。由于胰腺中有丰富的淋巴网络流入肠道淋巴结,这为CUR在胰腺中蓄积提供了可能性。此外,SEDDS可以为BI形成一层“保护伞”,减少胃酸侵蚀,提高BI存活率,有效克服肠道滞留不足的问题。基于此,该团队构建了油包水(W/O)型 BI和CUR共递送SEDDS (CUR-BI-SEDDS)(方案1)。
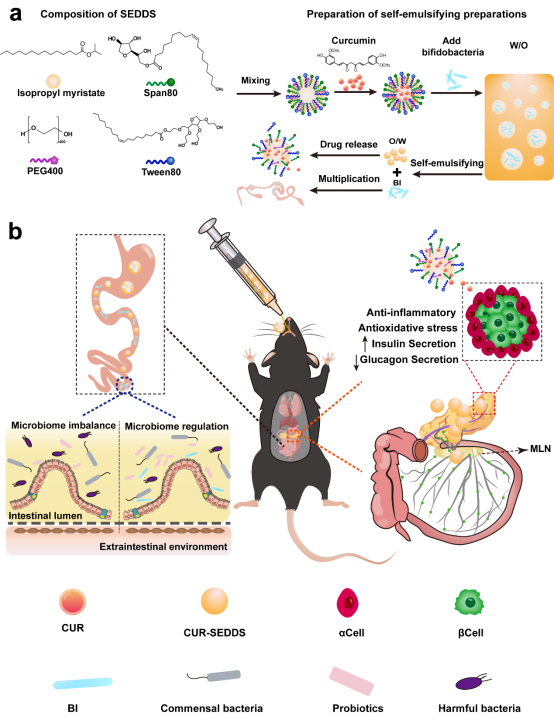
方案1. CUR-BI-SEDDS的制备工艺及T2DM治疗机制
本研究为了制备理想的SEDDS,确定了配方为:吐温80和司盘80,HLB值=9(乳化剂),聚乙二醇400(PEG400)(共乳化剂),肉豆蔻酸异丙酯(IPM)(油相)。当Km为1:1时,形成W/O乳状液的能力最好。复合乳化剂与油相的最佳配比为3:2。乳化后的CUR-SEDDS呈均匀分散的圆形。绿色荧光标记的BI被包裹在内水相中,一旦暴露在胃肠道环境中,SEDDS开始乳化,原来的W/O形式变成了双连续相,此后,BI逐渐从内水相分离并附着在油-水界面上,最后,随着SEDDS成为纳米乳液,BI完全分离(图1)。SEDDS可以有效减少胃酸对BI的破坏,从而提高BI的存活率(图2)。
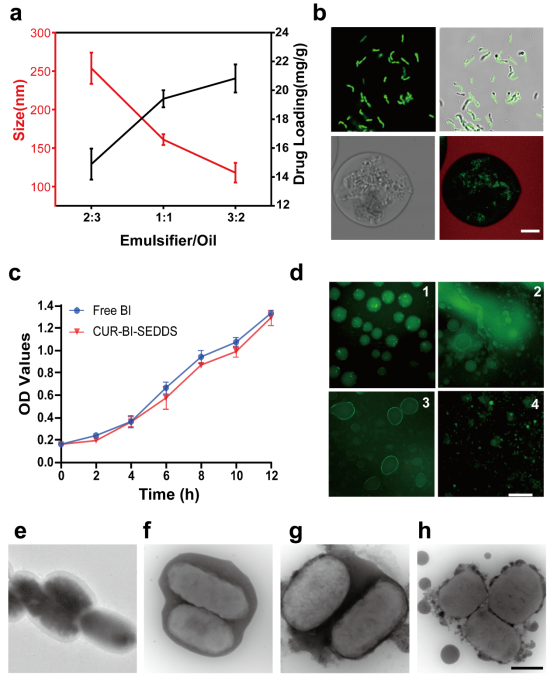
图1. CUR-BI-SEDDS的表征
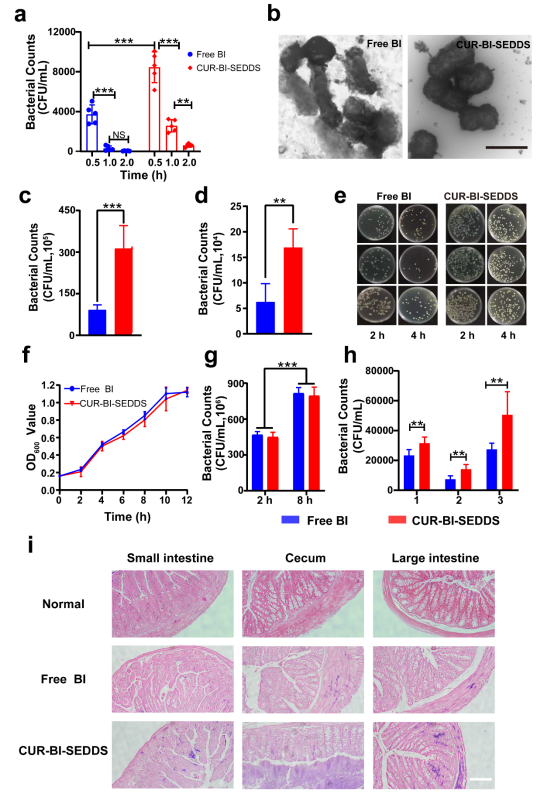
图2. 无涂层和涂层BI对胃肠道环境的耐受性
本研究推测CUR-SEDDS可以在肠道内形成乳糜微粒,并通过肠系膜淋巴途径转运到胰腺,并对其进行了验证。IR780标记的给药系统(IR780-BI- SEDDS)在肠道内的分布明显增加,并表现出明显的肠系膜淋巴结(MLN)积聚行为,且IR780-BI-SEDDS在胰腺中的积累随着时间的推移而增加,其蓄积量远远高于游离IR780和环己酰亚胺(CHX)预处理组(图3b,d),表明口服CUR-BI-SEDDS具有良好的胰腺靶向能力。体内药效学结果显示,CUR-BI-SEDDS可减少氧化应激、炎症浸润和逆转胰岛β细胞功能障碍,从而实现降低T2DM鼠血糖,长期控制葡萄糖稳态,改善胰腺微环境的目的(图4)。
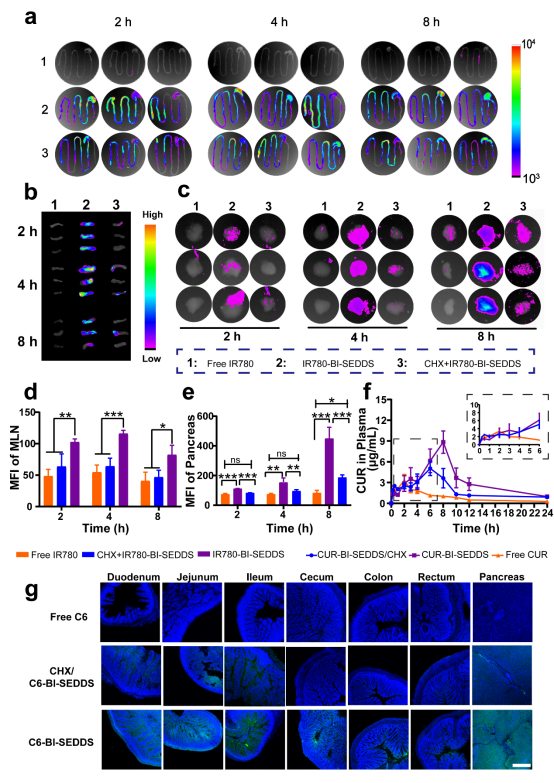
图3. CUR-BI-SEDDS口服后的淋巴转运

图4. 体内药效学结果
为进一步探讨CUR-BI-SEDDS降血糖机制,本研究对其抗炎、抗氧化作用进行了评价。由于CD4+T细胞在肥胖诱导的胰岛素抵抗中发挥重要作用,作者分析了血液中CD4+T细胞亚群(Th1、Th2、Th17和Treg)的比例,结果显示,CUR-BI-SEDDDS可以重塑T2DM小鼠体内Th1/Th2和Treg/Th17的动态平衡,从而缓解炎症浸润。此外,CUR-BI-SEDDS治疗组胰腺内MDA和ROS水平最低,抗氧化活性最好(图5)。
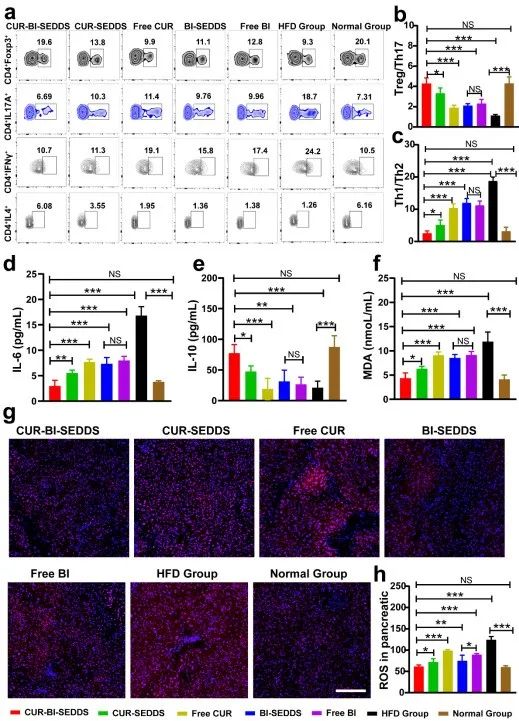
图5. CUR-BI-SEDDS的体内抗炎和抗氧化作用
大量研究表明,肠道微生物群在饮食诱导的T2DM中起重要作用,为了进一步探讨BI对肠道微生物群的影响,该团队使用小鼠结肠内容物进行了16s rRNA基因测序。结果显示,CUR-BI-SEDDS组的微生物区系图变化明显,厚壁菌门(Firmicutes)丰度降低,拟杆菌门(Bacteroides)丰度增加(图6c),肠道菌群的微生物群落多样性得到改善,罗伊氏乳杆菌(Lactobacillus reuteri)和普氏菌科(Prevotellaceae)在肠道表现出不同程度的富集(图6f,g),进一步验证了SEDDS包封BI对肠道微生物群的正向调节作用。经过CUR-BI-SEDDS治疗后,小鼠肠绒毛延长,炎症浸润减少,出血和水肿减少,肠道屏障功能得到有效改善。
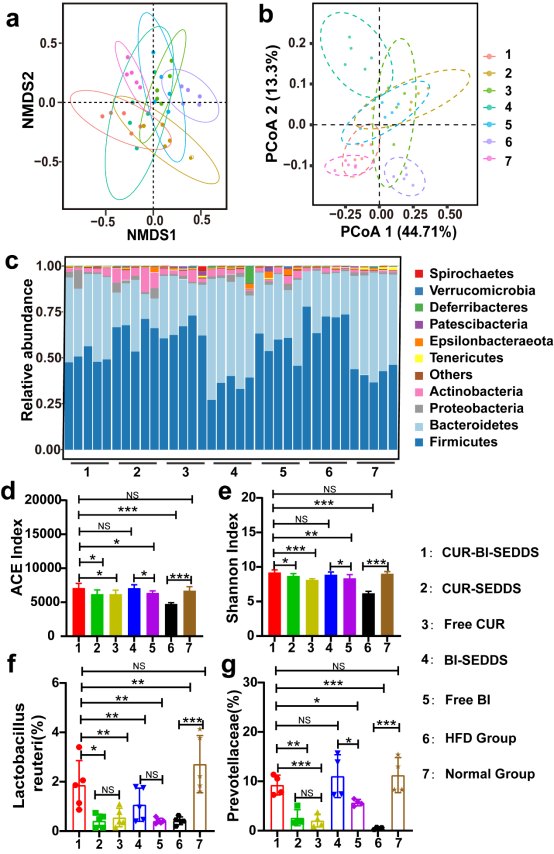
图6. CUR-BI-SEDDS对肠道微生物区系的正向调节能力
【结论与展望】
综上所述,该研究团队成功构建了一种自乳化系统CUR-BI-SEDDS,用于CUR和BI联合治疗T2DM。经口服给药后,肠道环境可触发CUR-BI-SEDDS的自乳化过程,实现BI和CUR-SEDDS纳米乳的裂变。随后,CUR-SEDDS经肠系膜淋巴通道转运至胰腺,通过发挥抗炎、抗氧化作用,恢复受损胰岛β细胞功能。同时,乳剂包被可以保护BI更好地在肠道定植,积极调节肠道微生物群,丰富肠道微生物群落的多样性,二者联合实现良好的降糖效果。本研究为T2DM的根治提供了一个新策略。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202309809?af=R


