读书报告 | DESTINY-Gastric02研究:德曲妥珠单抗治疗含曲妥珠单抗方案失败的欧美Her2阳性晚期胃癌和胃食道结合
时间:2023-12-10 13:36:25 热度:37.1℃ 作者:网络
导读
背景:大约15-20%的晚期胃癌和胃食管交界癌过度表达HER2。在DESTINY-Gastric01中,与化疗相比,来自日本和韩国的局部晚期或转移性HER2阳性胃或胃-食管交界处癌症患者的靶向HER2的ADC药物德曲妥珠单抗(Deruxtecan)改善了疗效和OS,这些患者都是在使用含曲妥珠单抗方案过程中或在曲妥珠单抗方案后发生了疾病进展。本研究报告了对单臂2期DESTINYGastric02试验的初步和最新分析,该试验旨在评估Deruxtecan在欧洲和美国的转移性或不可切除的HER2阳性胃癌或胃-食管交界部癌患者中的活性和安全性。
研究方法:DESTINY-Gastric02是一项针对来自美国和欧洲(比利时、西班牙、意大利和英国)24个研究中心的成年患者的单臂2期临床研究。符合条件的患者年龄至少为18岁,ECOG 0或1,病理为不可切除或转移性胃或胃食管交界处腺癌, Her2 阳性,含含曲妥珠单抗方案失败 。
研究结果:在2019年11月26日至2020年12月2日期间,89名患者接受了筛查,79名患者入选,随后接德曲妥珠单抗治疗(中位年龄60.7岁[IQR 52.0-68.3],79人中有57人[72%]为男性,22人[28%]为女性,69人[87%]为白人,4人[5%]为亚洲人,1人[1%]为黑人或非裔美国人,1人[1%]]为夏威夷原住民或太平洋岛民,1人[1%]]缺失种族,3人[4%]为其他种族)。在初步分析中(中位随访5.9个月[IQR4.6–8.6个月]),79名患者中有30名(38%[95%CI 27.3–49.6])报告了经证实的客观反应,其中包括3名(4%)CR和27名(34%)PR。截至更新分析的数据截止点(中位随访10.2个月[IQR5.6-12.9]),79名患者中有33名(42%[95%CI 30.8-53.4])报告了经证实的客观反应,其中包括4名(5%)CR和29名(37%)PR。
结论:这些有临床意义的结果支持德曲妥珠单抗作为HER2阳性晚期胃癌或胃食管交界部腺癌的二线治疗(Lancet Oncol.2023 Jul;24(7):744-756. doi: 10.1016/S1470-2045(23)00215-2)。
研究背景
大约15%-20%的进展期胃和胃食管交界癌过表达HER2(ERBB2)。对于HER2阳性的胃或胃食管交界癌患者推荐的一线治疗为化疗联合曲妥珠单抗。KEYNOTE811 III期临床研究结果加速了FDA批准帕博利珠单抗联合曲妥珠单抗及化疗用于局部晚期无法切除或转移性HER2阳性的胃或胃食管交界癌的一线治疗。而针对HER2阳性胃或胃食管交界癌患者的HER2靶向治疗的关键二线临床试验主要终点OS未达到,有证据表明,曲妥珠单抗一线治疗后HER2表达缺失可能是导致对后续抗HER2治疗耐药的机制之一。
T-DXd是一种抗体偶联药物(ADC),由人源化抗HER2 lgG1抗体、可裂解的四肽连接子和拓扑异构酶I抑制剂组成。细胞毒性有效载体在分裂后可穿透细胞膜,充分发挥旁观者效应,准确杀伤表达HER2的目标肿瘤细胞和邻近肿瘤细胞。
T-DXd 治疗胃或胃-食管交界部腺癌的有效性和安全性是在开放标签、多中心、随机、II期临床试验DESTINY-Gastric01中确定的,这些患者是来自日本和韩国HER2阳性、局部进展期或转移性胃或胃-食管交界部腺癌且经过至少两种治疗方案(包括氟尿嘧啶类、铂类和曲妥珠单抗)进展。在DISTINY-Gastric01中,与医生选择的标准化疗方法相比,T-DXd在ORR和OS方面显示出显著的获益。
本研究报告了DESTINY-Gastric02的最新结果,这项研究的目的是评估 T-DXd 在欧洲和美国的转移性或不可切除的HER2阳性胃癌或胃-食管交界部癌患者中的活性和安全性,这些患者都是在使用含曲妥珠单抗方案过程中或在曲妥珠单抗方案后发生疾病进展,并被证实保留了肿瘤HER-2阳性。
研究设计
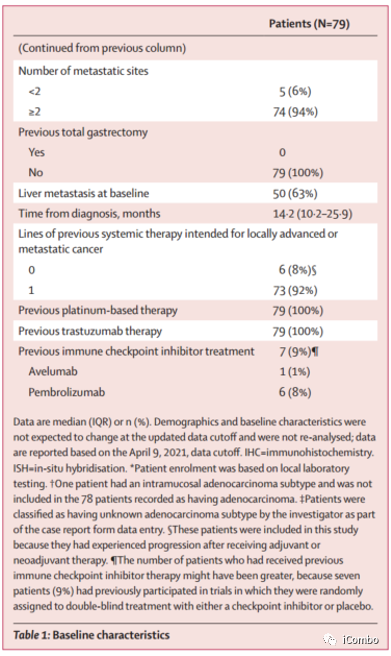
入组情况及基线特征
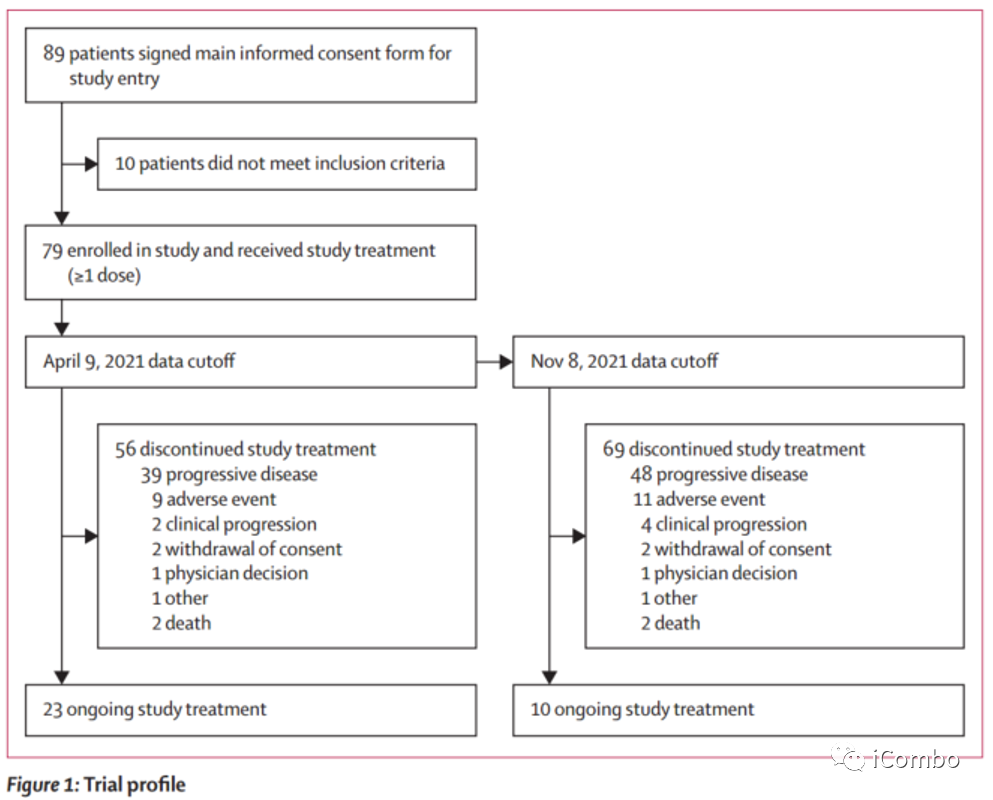

研究结果
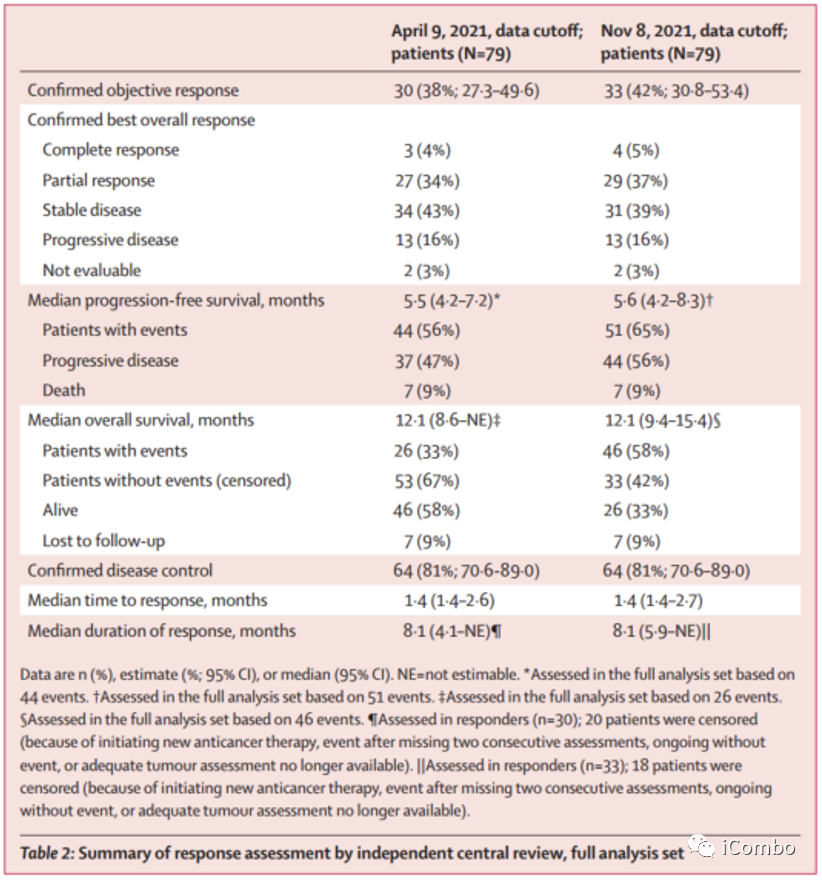
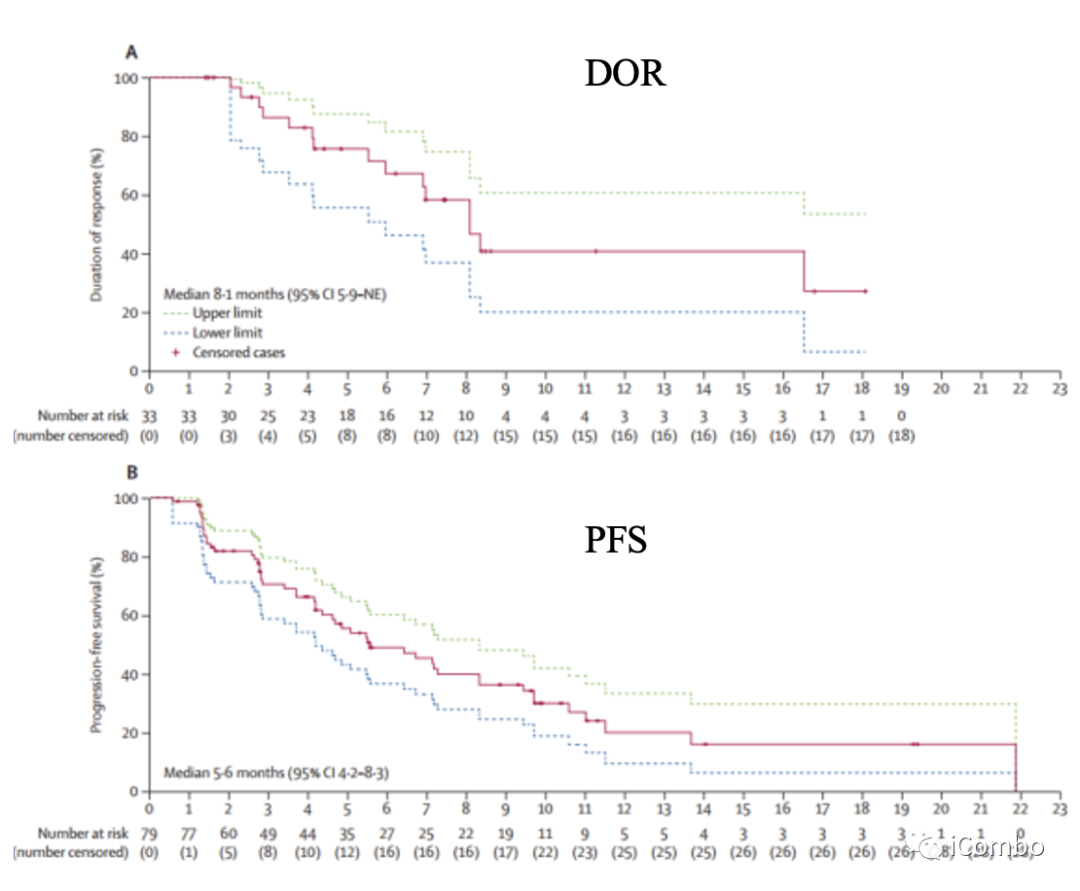
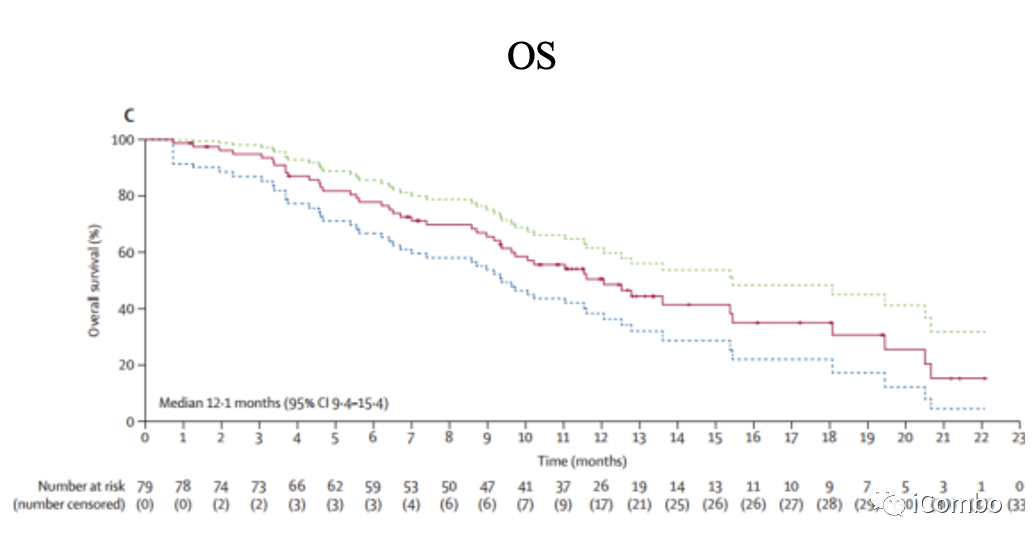
截至到2021年4月9日(中位随访时间5.9个月),30例(38%)患者达到ORR,其中3例(4%)CR,27例(34%)PR;中位OS 12.1个月,中位PFS 5.5个月;中位DOR 8.1个月;
截至2021年11月8日(中位随访时间为10.2个月,33名患者(42%)达到ORR,其中4例(5%)CR,29例(37%)PR;中位OS 12.1个月,中位PFS 5.6个月;中位DOR 8.1个月。
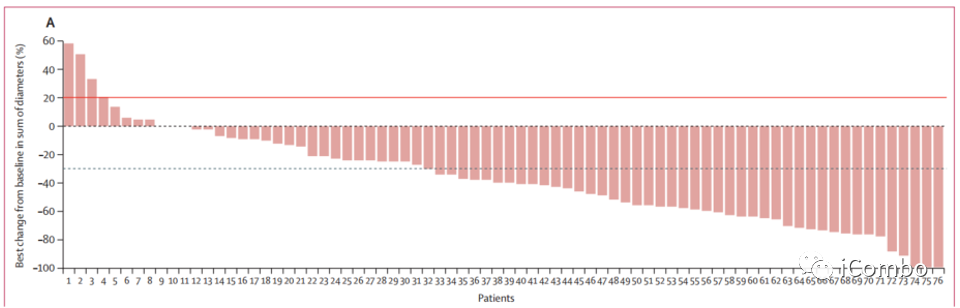
图A:肿瘤大小较基线改变的最佳百分比
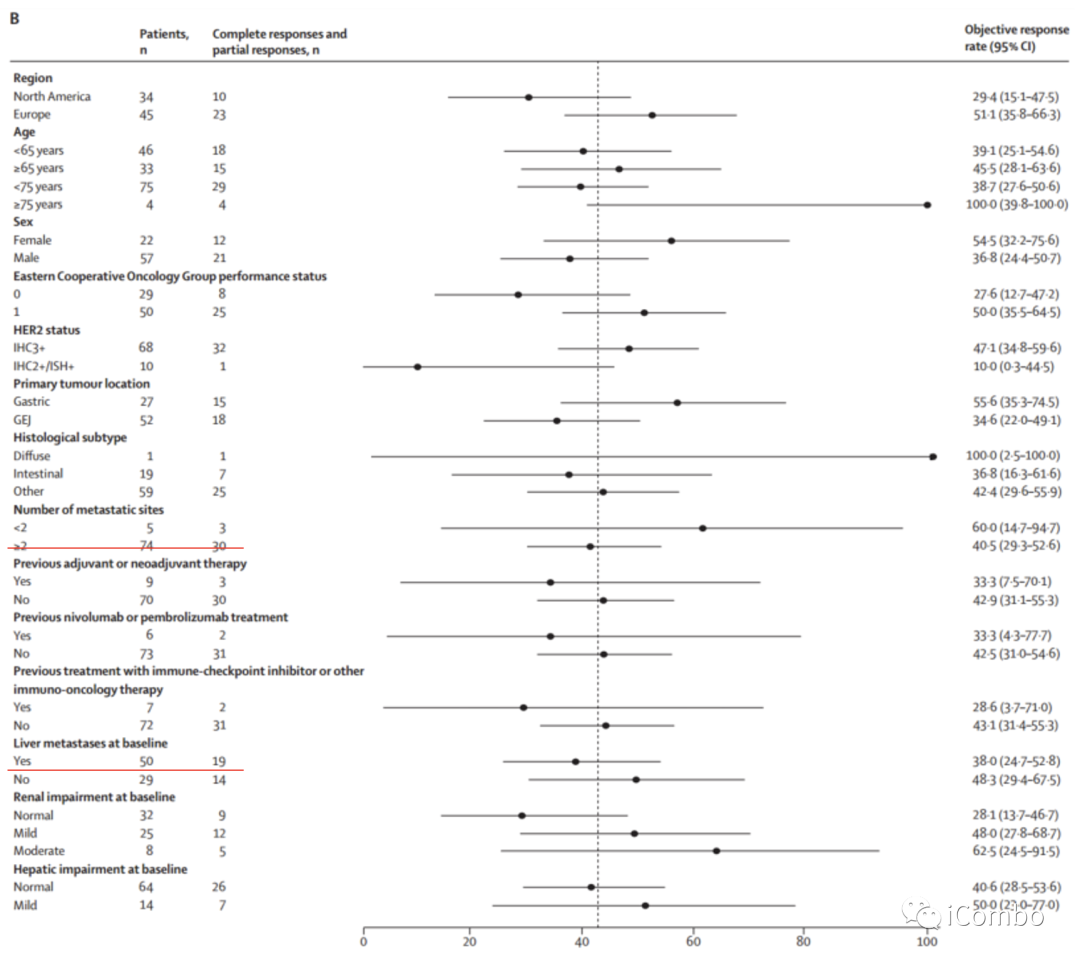
图B:ORR的亚组分析
安全性
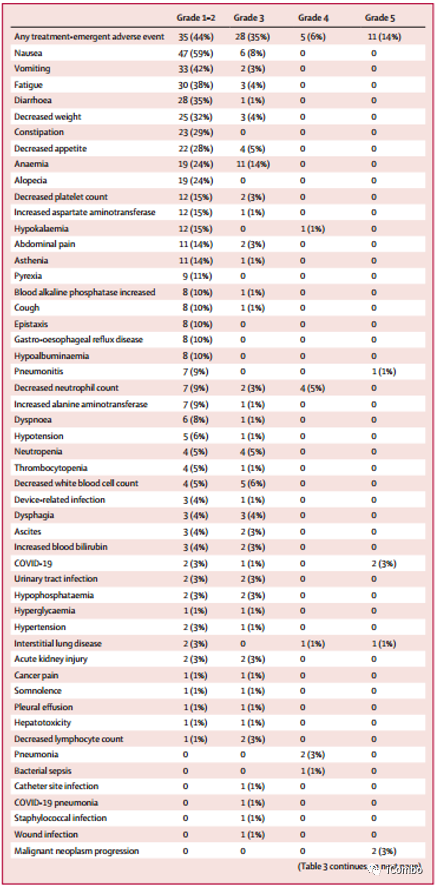

79例(100%)患者发生不良事件(AE),44例(56%)发生3级及以上AE,33例(42%)发生严重AE(SAE),其中,最常见的3级及以上AE包括贫血(11例[14%])、恶心(6例[8%])、中性粒细胞计数减少(6例[8%])和白细胞计数减少(5例[6%]);
治疗相关不良事件(TRAE)导致15例(19%)患者暂用停药,其中10例(13%)与药物相关;TRAE导致17例(22%)患者减量,其中14例(18%)与药物相关;TRAE导致23例(29%)患者治疗中断,其中8例(10%)与药物相关;
最常见的药物相关TRAE是肺炎(3例[4%])、间质性肺疾病(ILD)(2例[3%])和恶心(2例[3%]),导致暂用停药的最常见的药物相关TRAE是ILD或肺炎;导致减量的最常见药物相关TRAE为恶心(6例(8%))和中性粒细胞计数减少(4例[5%]);
8例(10%)患者发生了与T-DXd相关的ILD或肺炎,多为1-II级,1例(1%)患者死于ILD,1例(1%)死于肺炎。发生T-DXd相关ILD或肺炎的中位时间为80.5天,中位持续时间为36.0天。
讨论与总结
DESTINY-Gastric02研究表明,在美国和欧洲HER2阳性胃癌或胃食管结合部癌患者中,T-DXd显示出有意义的临床活性和可控的安全性,并且在接受含曲妥珠单抗的治疗方案后发生疾病进展的患者中达到持久缓解。对于欧美患者来说,T-DXd在二线治疗的临床疗效具有巨大前景。
目前在HER2阳性胃癌的二线治疗患者中开展的研究较少,目前针对这一人群的靶向治疗仍有高需求。在DESTINY-Gastric02试验中,胃癌患者HER2表达缺失也可能增加后续的HER2靶向治疗的难治性,故关于研究T-DXd治疗后HER2表达是否消失的研究也正在进行中。
本研究为单臂临床试验,缺乏对照组或安慰剂组;样本数及亚组规模较小;缺乏亚洲患者数据,胃癌或胃食管结合部癌亚洲患者的T-DXd治疗策略也仍在探索。
这项研究计划分析内容将包括评估循环生物标记物,包括游离DNA以及正在进行的生物标记物研究,以评估液体活检在胃癌和其他实体肿瘤中的使用。本研究结果也支持正在进行的3期DISTY-GISTEC04试验,该试验正在评估T-DXd与雷莫芦单抗+紫杉醇在曲妥珠单抗治疗时或之后进展的胃癌或胃-食管结合部腺癌患者中的疗效和安全性。


