EHJ:中国农业大学任发政/郭慧媛等合作揭示主动脉夹层的发病新机制
时间:2023-12-06 13:33:35 热度:37.1℃ 作者:网络
Stanford A型主动脉夹层(AD)是一种退行性主动脉重构疾病,无有效药物治疗,死亡率极高。膜介质内的平滑肌细胞(SMCs)具有一系列的状态,它们从收缩表型向合成表型的转变从根本上引发了AD。然而,控制这种群体转移和随后的AD的潜在病理机制,特别是在不同的疾病时间阶段,仍然是难以捉摸的。
2023年11月22日,中国农业大学任发政、郭慧媛、首都医科大学张宏家、姜文剑共同通讯在European Heart Journal在线发表题为“The activator protein-1 complex governs a vascular degenerative transcriptional programme in smooth muscle cells to trigger aortic disp and rupture ”的研究论文,该研究表明激活蛋白-1复合物能够控制平滑肌细胞中的血管退行性转录程序,以触发主动脉夹层和破裂。93397个细胞的转录谱显示了一个动态的时间特异性表型转变和激活蛋白-1 (AP-1)复合物的显著升高,积极地促进了合成SMC的扩张。
机制上,肿瘤坏死因子信号通过抑制线粒体氧化磷酸化(OXPHOS)增强AP-1转录活性。用OXPHOS增强辅酶Q10或AP-1特异性抑制剂T-5224靶向这条轴,可以阻止表型转变和主动脉变性,同时在β-氨基丙烯单马酸酯诱导的AD模型中,生存率分别提高42.88% (辅酶Q10治疗为58.3%-83.3%)、150.15% (2周T-5224治疗为33.3%-83.3%)和175.38% (3周T-5224治疗为33.3%-91.7%)。在AD进展过程中,人类升主动脉细胞图谱的横断面概要提供了先前未被重视的关于允许主动脉变性的转录程序的见解,强调了通过调节肿瘤坏死因子-OXPHOS-AP -1轴,抗重构干预作为一种有吸引力的策略来管理时间特异性AD的概念的翻译证明。

主动脉夹层(AD)是一种以极高的死亡率为特征的血管重构疾病。根据解剖形态,将解剖分为著名的Stanford A型和B型解剖。主要的病理标志是主动脉变性,表现为平滑肌细胞(SMC)丢失、细胞外基质(ECM)碎裂和炎症这些细胞的改变,在环境和遗传风险因素的共同作用下,会导致不可逆的动脉衰弱、夹层和破裂,最终导致循环衰竭。尽管在过去的十年里,阿尔茨海默病的治疗取得了长足的进步,但总的生存率仍然有限,阿尔茨海默病的诊断与极差的预后有关。虽然最佳的干预措施主要是手术修复,但仍需要其他治疗,包括非侵入性治疗由于缺乏有效的治疗方法,迫切需要更全面地了解解剖的人主动脉的细胞特性,这是开发合适的抗AD治疗方法的第一步。
平滑肌细胞是内膜的主要细胞类型,在维持主动脉形态、完整性和弹性方面起着至关重要的作用与心肌细胞和骨骼肌不同,SMCs不是终末分化的,并具有广泛的表型状态。在不同的外部刺激下,SMCs从收缩型可逆地转变为合成型,表现出收缩蛋白的丧失、ECM的积累和降解以及炎症的增加,所有这些都有助于主动脉重构。在主动脉夹层中,合成标记物的表达增加,同时收缩基因的减少,表明在AD发病过程中SMC表型发生了改变。据报道,SMC表型开关的操纵可以改变多种主动脉疾病的发展。然而,精确的SMC亚型、它们的功能特征、转移轨迹以及导致AD病理生理特征的机制尚不清楚。这可能归因于SMC群体的高异质性和功能多样性,这些关键因素往往被大量遗传分析所掩盖。幸运的是,单细胞RNA测序(scRNA-seq)可以强有力地揭示人主动脉SMCs (aoSMCs)的细胞异质性和不同的细胞景观,并确定潜在的细胞类型特异性表型转变机制。
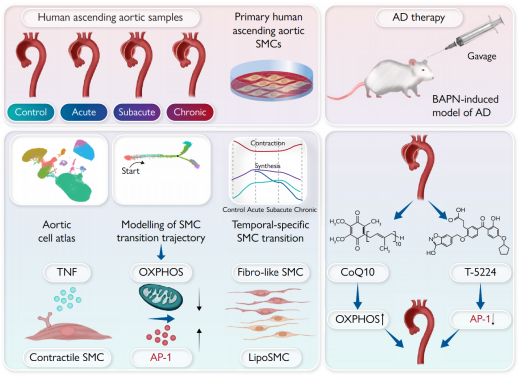
机理模式图(图源自European Heart Journal )
根据初始症状和表现之间的时间间隔,夹层可分为急性期(2周内)、亚急性期(2周到3个月)和慢性期(3个月以上)。急性斯坦福A型AD (STAAD)可迅速致命。延迟诊断为急性AD的患者经历自然选择,渡过急性期,最终进入慢性病程因此,解剖的不同时间模式反映了疾病随时间转变的自然史。临床研究表明,与急性AD相比,慢性AD在主动脉扩张率、器官灌注不良和疾病结局等方面存在许多不同。此外,组织学评估显示弹性蛋白断裂和中膜坏死随着时间的推移逐渐发生变化,这表明SMC表型与时间AD之间存在密切关联。因此,破解不同形式AD的表型转变的特定模式将大大提高人们对该疾病时间进化的理解。
该研究构建了AD不同时间阶段的人夹层升主动脉的横断面单细胞转录组图谱,并确定了在发病过程中触发SMC表型转变的血管退行性转录程序。具体来说,该研究揭示了肿瘤坏死因子(TNF) -氧化磷酸化(OXPHOS) -激活蛋白-1 (AP-1)轴触发夹层主动脉的表型缺陷。因此,在相关的AD小鼠模型中,增强OXPHOS或抑制AP-1可改善AD的发展,同时提高生存率。这项工作提供了对退行性主动脉重构的全面理解,为治疗人类AD奠定了良好的基础。
本研究是由中国农业大学和首都医科大学附属北京安贞医院合作完成。中国农业大学的罗永挺教授、罗俊杰教授、安鹏教授、赵文婷博士和首都医科大学附属北京安贞医院的赵远斐副研究员为本文的共同第一作者。中国农业大学任发政院士、郭慧媛教授以及首都医科大学附属北京安贞医院院长张宏家教授、心外科姜文剑教授为本文的共同通讯作者。
原文链接:
https://doi.org/10.1093/eurheartj/ehad534


