Front.aging neurosci: 阿尔茨海默病可以通过视网膜变化早诊?
时间:2023-04-20 11:22:58 热度:37.1℃ 作者:网络
光学相干断层扫描 (OCT) 于 1991年首次展示,是一种基于干涉测量的非接触式成像模式。于1993年首次用于人体视网膜成像, 具有快速扫描时间的高分辨率、非侵入性模式。OCT 一直处于神经变性研究的视网膜生物标志物的前沿,基于 OCT 的体内人体研究寻找新的神经变性生物标志物有一个主要局限性:患者被诊断为疾病晚期,发病时间难以确定。因此,疾病的小鼠模型通常被选为替代品。小鼠模型在多个研究领域一直很重要,并提高了对疾病病理生理学的理解。基于 OCT 成像,已发现神经退行性疾病引起的视网膜变化,包括视网膜层厚度的变化。最近作者揭示了视网膜纹理生物标志物有助于在早期阶段区分年龄匹配的健康对照和阿尔茨海默病 (AD) 动物模型。尽管小鼠疾病模型在临床研究中起着关键作用,但仍缺乏小鼠模型视网膜厚度的纵向规范数据,这些数据一直关注小鼠发育最初几个月的厚度变化,而忽略了长期变化。
在这项研究中,作者使用光谱域OCT数据提出了 C57BL6/129S小鼠视网膜厚度的综合规范数据库。该数据库涵盖16个月的纵向时间段,从 1个月到16个月,并提供有关视网膜发育和随时间变化的见解。


根据每个受试者的体积分段OCT 数据,为每个视网膜层/层聚合计算成像区域上的详细厚度图。图 2显示了 1、4、8、12 和 16 个月大的 WT 和 3×Tg-AD 小鼠的平均 TRT 图。对每只眼睛在每个时间点获得的平均 TRT 值的详细分析表明,除 1 个月大的 3×Tg-AD 小鼠外,右眼和左眼之间的视网膜厚度没有统计学上的显着差异。TRT 图表明,两组的整体视网膜厚度随着年龄的增长而减少。这种减少在1到2个月大时似乎更为明显。与所有年龄段的 3×Tg-AD 小鼠相比,在 WT 小鼠中观察到更高的厚度值。

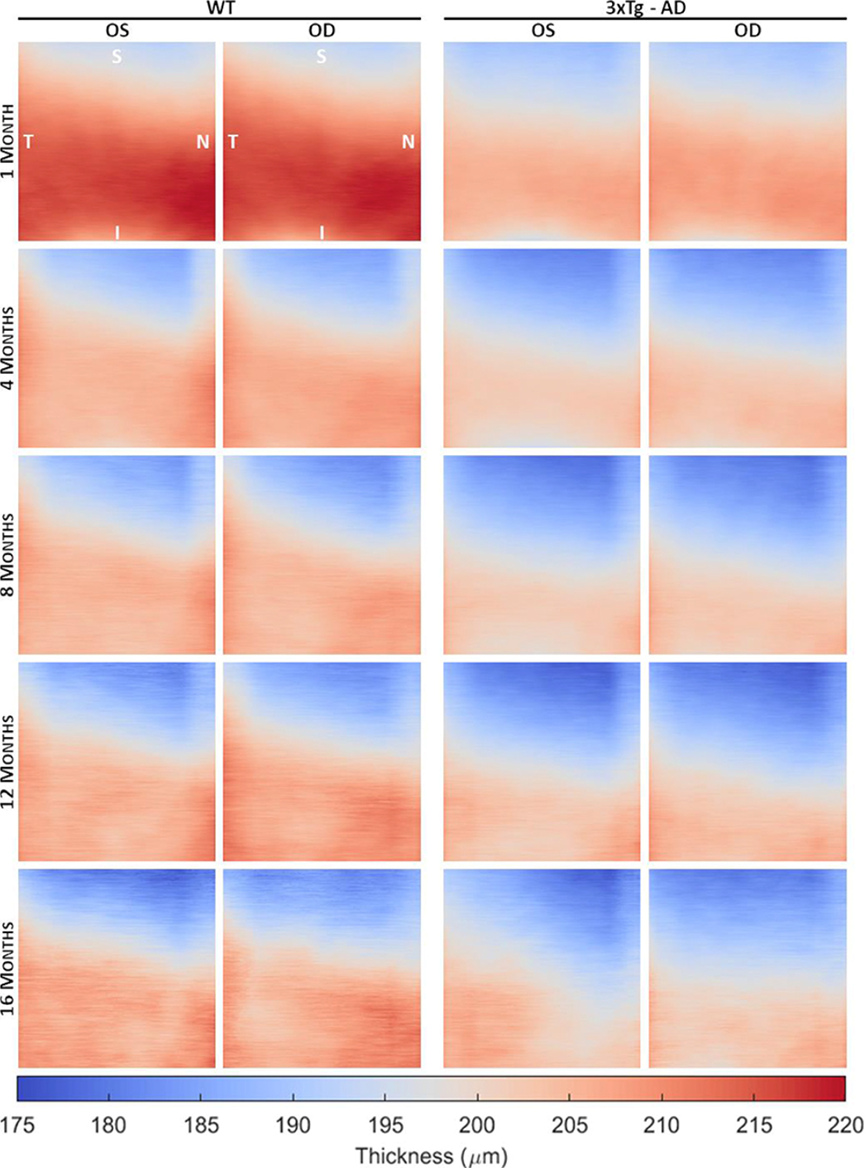
图1 野生型 (WT) 和阿尔茨海默病三重转基因小鼠模型 (3×Tg-AD) 视网膜的平均总视网膜厚度图
在所有年龄段的 WT 和 3×Tg-AD 小鼠视网膜层厚度之间发现了一致的统计学显着差异。总体而言,3×Tg-AD 小鼠的视网膜比 WT 小鼠的视网膜薄。在所有时间点,3×Tg-AD 小鼠的双眼TRT值明显低于WT小鼠。对监测的时间跨度内厚度分布的分析表明,大多数视网膜层/层聚集体的厚度在两组中都取决于年龄。此外,对于所有视网膜层,两组之间跨年龄范围的差异模式不同。

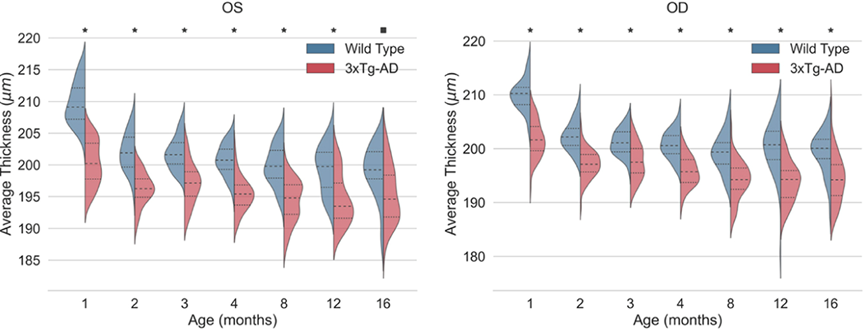
图2 野生型(蓝色)和三重转基因阿尔茨海默氏病 (3xTg-AD) 小鼠(红色)的左眼 (OS) 和右眼 (OD) 的总视网膜厚度 (TRT) 的核密度估计
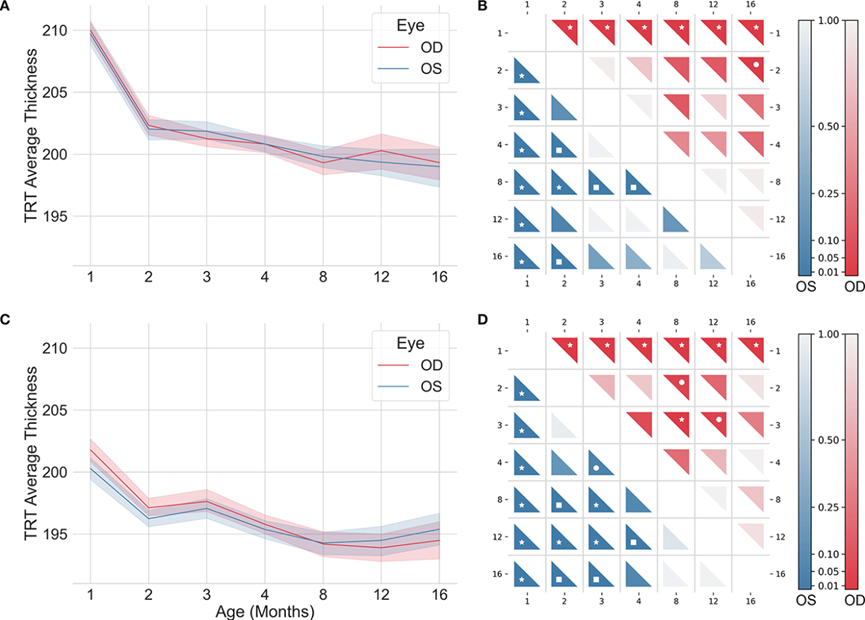

图3 野生型(A、B)和三重转基因阿尔茨海默病(C、D)小鼠左眼(OS;蓝色)和右眼(OD;红色)的纵向总视网膜厚度
结合 WT 小鼠视网膜和视网膜层/层聚集厚度随年龄变化的特征,在本研究中,作者探索了年龄匹配的转基因小鼠 AD 模型中的厚度变化。总的来说,在 WT 和转基因小鼠中观察到视网膜厚度随着年龄的增长而逐渐减少。在研究的所有年龄段,发现 3×Tg-AD 小鼠的视网膜比年龄匹配的 WT 小鼠的视网膜更薄。这与AD动物模型文献中报道的结果一致。
作者的研究结果表明,总视网膜厚度随着年龄的增长而减少,而单个视网膜层和层聚集体的厚度以不同的方式变化。例如,随着时间的推移,外丛状层 (OPL)、感光细胞内节 (ILS) 和视网膜色素上皮 (RPE) 变厚,而其他视网膜层和层聚集体变薄。此外,作者将野生型 (WT) 小鼠的视网膜厚度与阿尔茨海默病动物模型 (3×Tg-AD) 进行比较,结果表明转基因小鼠与年龄匹配的 WT 小鼠相比,总视网膜厚度有所降低,在所有评估的年龄都观察到具有统计学意义的差异。
这个小鼠视网膜厚度的规范数据库将作为未来研究神经退行性和眼病视网膜变化的参考,并将加深我们对这些病症的病理生理学的理解。在所有评估的年龄都观察到具有统计学意义的差异。这个小鼠视网膜厚度的规范数据库将作为未来研究神经退行性和眼病视网膜变化的参考,并将加深我们对这些病症的病理生理学的理解。
参考文献
Batista A, Guimarães P, Martins J, Moreira PI,Ambrósio AF, Castelo-Branco M, Serranho P
and Bernardes R (2023) Normative mice retinal thickness: 16-month longitudinal
characterization of wild-type mice and changes in a model of Alzheimer’s disease.
Front. Aging Neurosci. 15:1161847. doi: 10.3389/fnagi.2023.1161847


