读书报告 | 信迪利单抗联合贝伐单抗/奥沙利铂/卡培他滨一线治疗RAS 突变微卫星稳定MSS的不可切除的转移性结直肠癌II 期临
时间:2023-11-29 16:29:20 热度:37.1℃ 作者:网络
导读
微卫星稳定(MSS)RAS 突变的转移性结直肠癌(mCRC)患者具有免疫抑制微环境和免疫治疗应答率低的特点。基于化疗和抗血管生成可能促进免疫治疗反应,本研究是一项在中国浙江大学医学院附属第二医院袁瑛教授课题组进行的开放标签、单臂、II 期试验,旨在评估信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨作为一线治疗 RAS 突变、MSS、mCRC 患者的抗肿瘤活性和安全性。
研究设计:RAS 突变、MSS、不可切除的转移性结直肠癌患者,接受静脉注射信迪利单抗(200mg, d1)、贝伐珠单抗(7.5mg/kg, d1)、奥沙利铂(135mg/m2, d1)和口服卡培他滨(1g/m2, d1-14 ),每21天1周期。将给予最多 8周期的诱导治疗。具有客观缓解或疾病稳定(SD)的患者将继续接受信迪利单抗(200mg, d1)加贝伐珠单抗(7.5mg/kg, d1)和口服卡培他滨(1g/m2, d1-14)在每21天1周期作为维持治疗,直到确认疾病进展、死亡、不可接受的毒性或撤回同意。主要研究终点是客观反应率(ORR)和不良事件,次要研究终点是DCR和PFS,进行生物标志物分析以确定治疗反应的潜在预测因子。
研究结果:2021年4月至 2021年12月共入组25名患者,2名(8%)患者显示完全缓解(CR),19名(76%)患者出现部分缓解(PR),4名(16%)患者病情稳定。ORR达到84%(95% CI 63.9-95.5),DCR为100%(95% CI 86.3-100)。中位PFS为18.2个月。所有级别中最常见的治疗相关不良事件 (TRAE) 为贫血(21/25,84%)、中性粒细胞减少症(20/25, 80%)和手足综合征(14/25, 56%)。最常见的 3 级或 4 级TRAE是中性粒细胞减少症(3/25, 12%)和丙氨酸转氨酶升高(2/25, 8%)。未发生5级不良事件。在生物标志物探索中,5 例患者治疗后可被定性为 TTN/OBSCN“双重打击”,且治疗后肿瘤组织中拷贝数变异CNV负荷较基线显著降低。Nanostring panel RNA测序分析表明,与非 CR/PR 患者相比,CR/PR 患者,以及与短 PFS 组相比,长PFS(≥12.5个月)组具有更好的肿瘤免疫微环境细胞浸润。
结论:信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨作为一线联合治疗,在经 MDT 评估的 RAS 突变、MSS 和不可切除的 mCRC 中显示出高 ORR、DCR 和可控的安全性。这表明信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨是一种有前景的联合策略,有望提供更多的临床益处。探索性生物标志物评估分析显示 RAS 突变和 MSS患者在接受信迪利单抗加贝伐珠单抗、奥沙利铂和卡培他滨方案治疗后转变为“免疫热”亚型(EClinicalMedicine.2023 Jul 27;62: 102123. doi: 10.1016 /j.eclinm. 2023 .102123)。
引言
根据2020年全球癌症统计数据,结肠直肠癌(CRC)仍然是世界癌症相关死亡的第二位。根据最新的中国癌症报告,CRC是中国癌症相关死亡的第四位。且CRC的发病率和死亡率均呈逐年增长的趋势。在新诊断为结直肠癌的患者中,20%已有远处转移。转移性结直肠癌(mCRC)的5年生存率低于20%。
mCRC 患者的标准化疗方案是基于氟尿嘧啶、奥沙利铂和/或伊立替康的化疗方案,结合基于 RAS 和 BRAF状态的抗血管生成(贝伐珠单抗)或EGFR受体(西妥昔单抗)。
mCRC中RAS突变的比例达到50-56%。对于RAS突变的mCRC患者,贝伐单抗联合化疗是标准的一线治疗方案。然而,与RAS野生型相比,RAS突变患者的预后较差,生存期较短。有研究表明,RAS突变mCRC具有免疫抑制微环境。因此,提高其一线治疗的有效性已成为当前治疗的挑战。
近年来,免疫检查点抑制剂开创了新的治疗方案,并由于其对包括恶性黑色素瘤和肺癌在内的几种实体癌的长期持久反应而显著改善了预后。
然而,免疫检查点抑制剂对微卫星稳定(MSS)mCRC 基本上无效,并且只有一小部分MSI-H的mCRC 显示出有效的反应。这可能与 MSS mCRC中肿瘤特异性抗原的低表达、抗原呈递缺陷和内在免疫抑制途径的过度激活有关。
MSS患者占mCRC的大多数(约95%)。因此,需要新的方法来改善这种亚型的免疫治疗反应。
血管生成信号通路的上调与肿瘤免疫抑制之间的相互作用已被证实。血管内皮生长因子(VEGF)通过抑制树突状细胞的成熟,上调树突状细胞上PD-L1的表达来减少肿瘤抗原的呈递,从而抑制CD8+ T细胞的功能。VEGF/血管内皮生长因子受体(VEGFR)通路的上调也能促进调节性T细胞的增殖,诱导M1和M2巨噬细胞的失衡。
抗血管生成治疗可以通过使血管正常化来逆转免疫抑制的肿瘤微环境,继而诱导T细胞浸润和激活,以促进包括结直肠癌在内的实体癌的免疫治疗。
临床前研究表明,奥沙利铂可以诱导 CT26(具有MSS 状态和 KRAS G12D 突变的小鼠结肠癌细胞)免疫原性肿瘤细胞死亡,并增加肿瘤部位的 CD8+ T 细胞浸润。在体内,5-氟尿嘧啶对髓源性抑制细胞(MDSC) 的消除增加了特异性 CD8(+) T 细胞肿瘤浸润产生的 IFN-γ,并促进了体内 T 细胞依赖性抗肿瘤反应。
这些数据提供了一个理论基础,当化疗与免疫检查点抑制剂联合使用时,化疗可以诱导肿瘤的免疫原性,具有协同效应。
本次报告这项 II 期研究:信迪利单抗联合贝伐单抗、奥沙利铂和卡培他滨一线治疗 RAS 突变、MSS、不可切除的转移性结直肠癌的有效性、安全性和生物标志物结果。
研究设计
本研究是一项在中国浙江大学医学院附属第二医院进行的开放标签、单臂、II 期试验,旨在评估信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨作为一线治疗 RAS 突变、MSS、mCRC 患者的抗肿瘤活性和安全性。
本研究已在 ClinicalTrials.gov 注册,编号为 NCT04194359。
患者入排标准:
-
年龄18-75岁
-
组织学证实的转移性结直肠腺癌
-
经多学科MDT证实不可切除的转移性结直肠癌。
-
MSS
-
基因测序:RAS 突变和 BRAF 野生型(使用一组六个单核苷酸重复标记:BAT-25、BAT-26、NR-21、NR-24、NR-27 和 MONO-27)。
治疗方案流程图
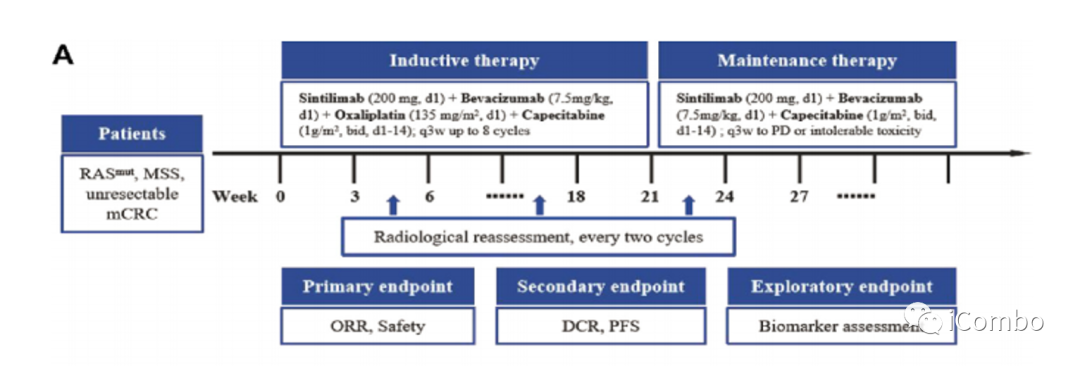
符合条件的患者接受静脉注射信迪利单抗(200mg, d1)、bevacizumab(7.5mg/kg,d1)、奥沙利铂(135mg/m2, d1)和口服治疗卡培他滨(1g/m2, d1-14 ),每个21天周期。将给予最多8个疗程的诱导治疗。具有客观缓解或疾病稳定(SD)的患者将继续接受信迪利单抗(200mg, d1)加贝伐单抗(7.5mg/kg, d1)和口服卡培他滨(1g/m2, d1-14)在每个21天的周期中作为维持治疗,直到确认疾病进展、死亡、不可接受的毒性或撤回同意。
我们根据实体瘤疗效评估标准(RECIST)(1.1 版)标准,每2个周期(6周)使用 CT 或 MRI 评估治疗反应。使用国家癌症研究所不良事件通用术语标准(5.0版)对不良事件进行监测和分级。
临床研究的流程图

2021年4月至2021年12月期间入组了25名符合条件的患者,进行疗效和安全性评估,所有患者均接受至少1次指定方案的治疗。
截至数据截止日(2022年11月30日),7例患者仍在接受维持治疗,中位随访时间为16.5个月(范围为6.6至22.1个月,IQR14.7-18.7) 。
6例(24%)患者接受了手术治疗,达到了无疾病(NED)状态。接受手术治疗的患者被排除在符合方案组(PPS)之外。
因此,19例患者被纳入PPS。1例患者在疾病进展后接受了转移瘤的姑息手术。1例患者在接受信迪利单抗加贝伐珠单抗、奥沙利铂和卡培他滨治疗后达到cCR。
结果
结果 基线特征
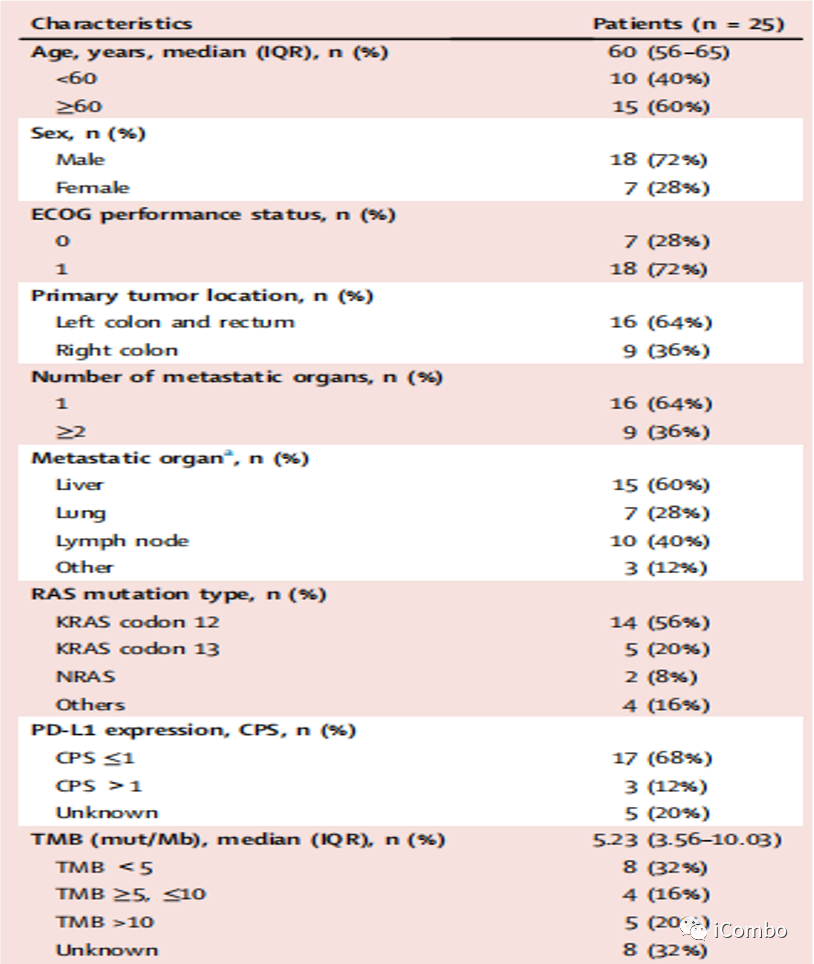
中位年龄为 60 岁(范围 45-74,IQR 56-65)。
大多数患者为男性(18/25,72%)。
ECOG评分0-1
左半结肠癌64%(16/25),右半结肠癌占36%(9/25)。
最常见的转移部位是肝脏(15名患者,60%)、淋巴结(10名患者,40%)和肺(7名患者,28%)。
KRAS 密码子12突变56%(14/25) ,KRAS密码子13突变20%(5/25)。
20例患者的 PD-L1 免疫组织化学(IHC)结果中,有3例患者的综合阳性评分(CPS)>1。
17名有肿瘤突变负荷(TMB)结果的患者中,5名TMB >10 mut/Mb。
结果 疗效
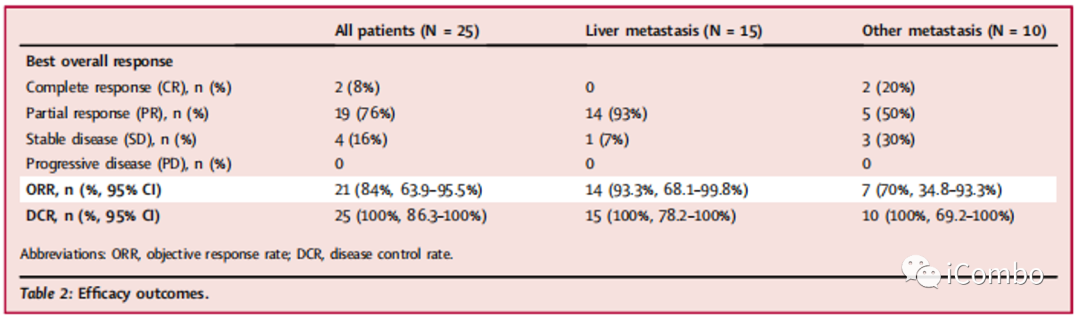
在符合FAS疗效并可评估的25名患者中,根据RECIST 1.1版,有21名患者(84%)获得客观缓解,2名(8%)患者cCR,其中一名在手术切除后证实为病理性 CR,19名患者(76%)PR,4名患者(16%)SD。DCR达100%。
肝转移患者(N=15)的ORR(14/15, 93%)对比总体ORR(84%)更高。
结果
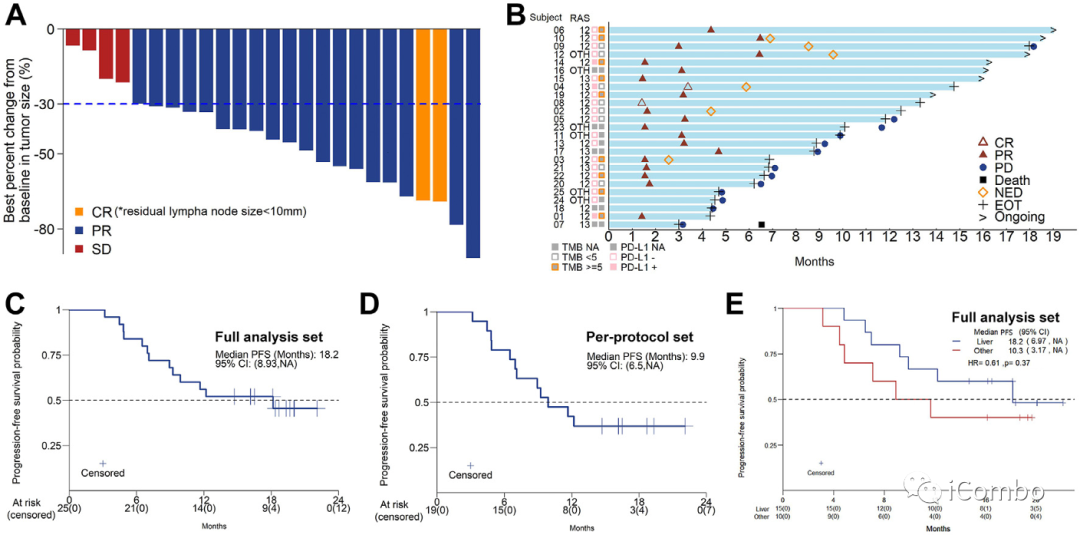
A. 所有 25 名患者均表现出肿瘤不同程度的缩小。
B. 七名患者在数据截止日仍在接受维持治疗(CR1、PR5,NED1)。
C. FAS 中的中位 PFS 为 18.2 个月(95% CI,8.93-NA)。
D. PPS 中的中位 PFS 为9.9 个月(95% CI,6.5-NA)。
E. 肝转移患者的中位 PFS 为 18.2 个月(95% CI.97–NA),非肝转移患者的中位 PFS 为 10.3 个月(3.17–NA)。
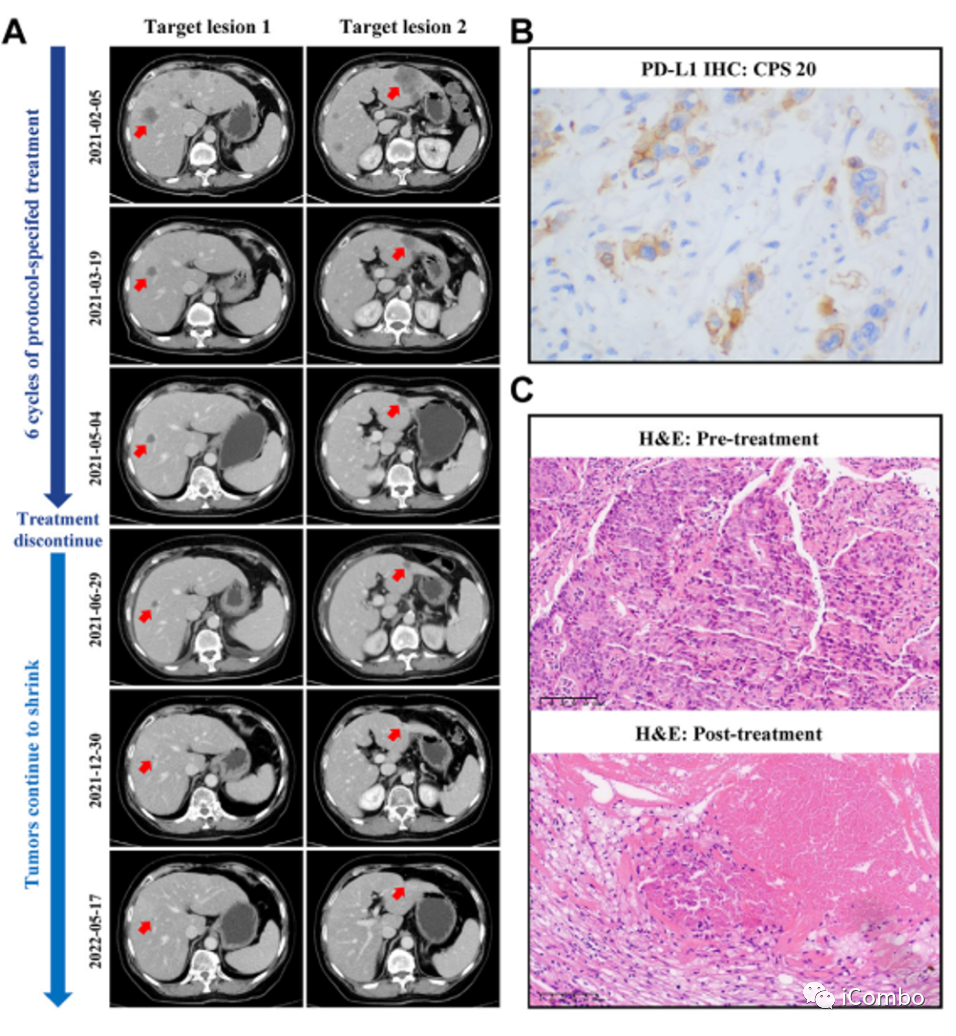
代表性患者No.1接受6周期指定方案治疗后,停止治疗。
(A)患者No.1的影像学表现,停止治疗后,肝转移仍继续缩小。
(B)患者No.1 标本的PD-L1 IHC染色。
(C)患者No. 4治疗前后标本的H&E染色,治疗后显示病理CR。
安全性

所有25名患者均接受了至少一次指定方案的治疗,并进行了安全性评估。治疗总体耐受性良好。
表3总结了治疗相关不良事件(TRAE)和免疫相关不良事件。
截至数据截止日期(2022年11月30日),所有级别中最常见的 TRAE 是贫血(21/25, 84%)、中性粒细胞减少症(20/25, 80%)、恶心(14/ 25, 56%)、手足综合征(14/25, 56%)、白细胞减少症(14/25, 56%)和高血压(14/25, 56%)。最常见的3 级或 4 级 TRAE 是中性粒细胞减少症(3/25, 12%)和丙氨酸转氨酶增加(2/25, 8%)。
研究期间没有发生 5 级不良事件。
生物标志物
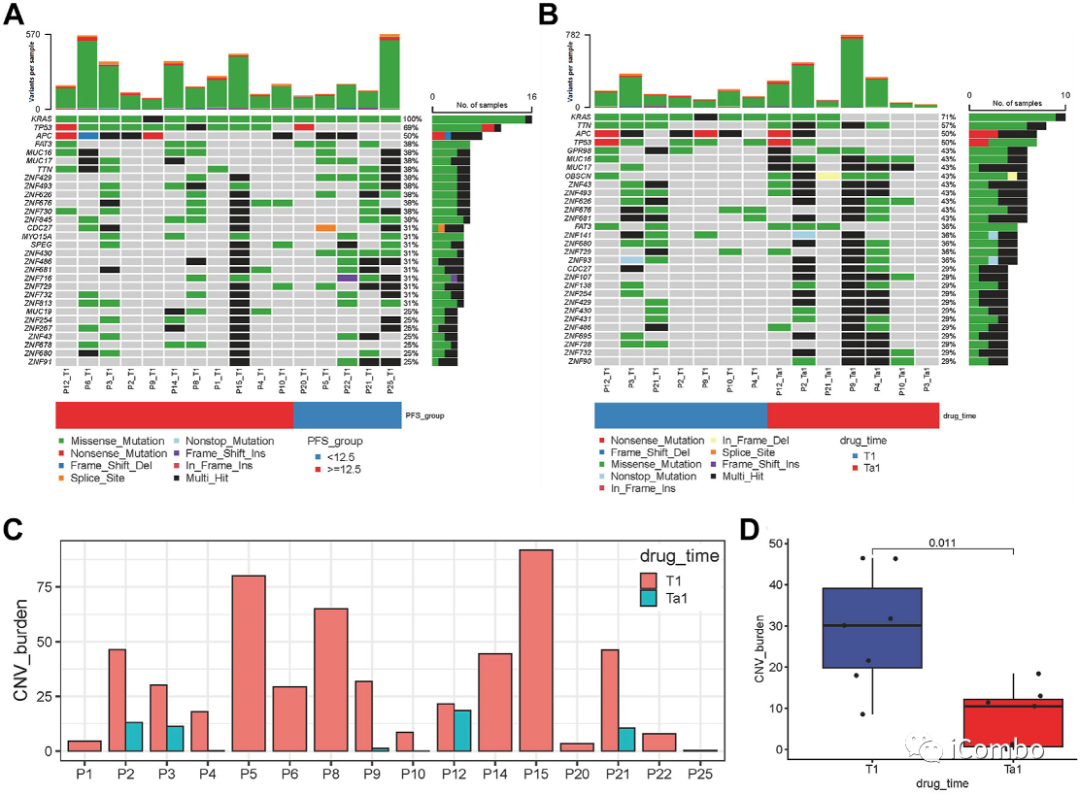
本次小样本分析没有发现CR/PR和非CR/PR患者之间的PD-L1表达、RAS突变类型和TMB有任何显著差异。
A. 本研究中,64%(16/25)的患者进行了 WES。如图A所示,基线(T1)时最常见的基因突变是KRAS、TP53和APC。此外,TP53、ZNF430、ATM和ZNF429在PFS <12.5个月和≥ 12.5个月组之间基因组改变频率存在显着差异。
B. 对比7名接受手术治疗的基线(T1)患者与治疗后(T1a)的基因组改变,4 名患者未检测到 KRAS 突变,5名患者治疗后肿瘤组织出现 TTN/OBSCN“双重打击doublt hit”。
图C和D. 与基线(T1)相比,治疗后(T1a)肿瘤组织中的CNV负荷显著降低。
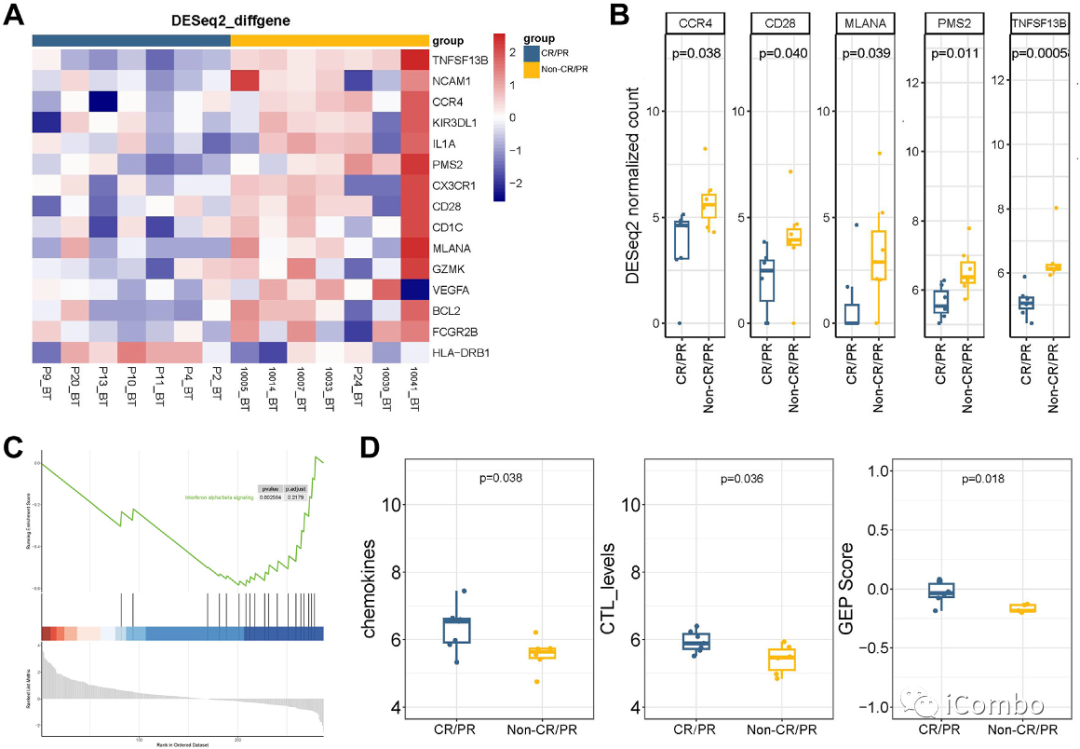
对基线组织样本进行基因分析,对比CR/PR
和非 CR/PR 患者,以寻找可能的生物标志物预测信迪利单抗加贝伐珠单抗、奥沙利铂和卡培他滨的疗效。
A-B:与CR/PR 患者时,非 CR/PR患者肿瘤组织显示CCR4、CD28、MLANA、PMS2和TNFSF13B的转录水平较高。
C. 进行基因集富集分析(GSEA)来鉴定两组之间变化基因的生物学功能,结果表明基因在“干扰素信号传导”通路显著富集。
D. 同时,分析基线肿瘤标本的不同TIME细胞浸润评分。CR/PR患者的趋化因子、CTL水平和基因表达谱(GEP)评分显著较高。
这些结果表明,CR/PR患者的TIME细胞浸润优于非CR/PR患者,有待进一步研究证实。

A-C:在PFS短(<12.5 个月)和PFS长(≥12.5个月)组,对基线组织样本进行了转录谱结果分析和GSEA基因集富集分析。
D.根据细胞类型评分,与 PFS 短组相比,PFS 长组的耗竭CD8+T 细胞评分更高(图6D)。

研究还分析了CR/PR患者治疗前和治疗后的GEP评分和T细胞标记物的变化
A-B:CR/PR患者治疗前后GEP评分的变化。
C-D:CR/PR患者治疗前后T细胞标志物的变化
讨论
这项 II 期临床研究达到了主要终点,表明在mCRC一线贝伐单抗联合奥沙利铂和卡培他滨中添加信迪利单抗可能会改善 ORR 和 PFS,并且对于 MSS 和 RAS 突变的 mCRC 患者来说也是安全可耐受的。
与RAS 突变 mCRC 中标准一线化疗加贝伐珠单抗约 43-59% 的 ORR 和 8-9 个月的 PFS 相比,本研究在 FAS 中达到了 84% 的 ORR 和 18.2 个月的 PFS 。本研究的结果提供了一种理想的综合策略,将免疫疗法、靶向疗法和化疗结合起来治疗 MSS、 RAS 突变 mCRC 。
近期,多项类似研究也取得了初步结果,如CheckMate 9 × 8、AtezoTRIBE、NIVACOR Trial等 。
CheckMate9×8 评估了纳武单抗联合mFOLFOX6 加贝伐单抗一线治疗 mCRC,尽管未达到 PFS 的主要终点,但纳武单抗联合 mFOLFOX6 加贝伐单抗在12个月后实现了更高的 PFS 率。亚组分析中,在CMS3型患者中(中位 PFS 为 16.1 个月 vs 8.7 个月),在 mFOLFOX6 加贝伐珠单抗中添加纳武单抗可带来显著益处。本研究中纳入的MSS 和 KRAS 突变的 mCRC 患者正是 CMS 3 型。
在AtezoTRIBE 试验的 pMMR亚组中,对于分配到阿替利珠单抗组(FOLFOXIRI + 贝伐单抗 +阿替利珠单抗)的患者,报告的中位 PFS为 12.9 个月,而对照组为11.4个月(FOLFOXIRI + 贝伐珠单抗),ORR 和 DCR 分别为 59% vs 64% 和 92% vs 93%。
NIVACOR试 验评估了纳武单抗联合FOLFOXIRI 和贝伐单抗一线治疗RAS/BRAF突变mCRC的疗效和安全性。MSS的亚组分析中,ORR 为 78.9%,DCR 为 96.2%,中位 PFS 为 9.8 个月(95% CI 8.18–15.24)。
NICHE研究是第一个结直肠癌新辅助免疫治疗的研究。患者接受单剂ipilimumab 1mg/kg 和两剂nivolumab 3mg/kg 治疗,并在6周内接受手术。30名pMMR肿瘤患者进行疗效分析评估,9/30(30%,95% CI 14-46%)患者观察到病理反应。结果提示pMMR 结肠癌并非对免疫疗法完全没有反应。对于 pMMR/MSS 肿瘤,识别区分免疫治疗有应答者和无应答者的潜在生物标志物是未来研究的重点。
本研究中,24%(6/25)的患者接受了 R0 手术切除并达到了 NED 状态。荟萃分析提示三联化疗(FOLFOXIRI)加贝伐珠单抗 R0 切除率为 28.1%。BeTRI研究FOLFOXIRI 加贝伐珠单抗作为未经治疗mCRC患者初始化疗的R0切除率为22.7%。另一项荟萃分析(包括 29 项已发表试验、3500名患者)提示,对于 FOLFIRI 加贝伐单抗方案,任何转移部位的切除率为 9.3%,肝转移的切除率为 18%。
据报道,TTN/OBSCN“双重打击double-hit”的 CRC是一种“免疫热”亚型,具有潜在更好的免疫治疗效果和良好预后的预测因子。在肝胆癌中,有研究表明拷贝数变异(CNV)可以预测基于免疫检查点抑制剂的治疗的疗效,这与生存率呈负相关;CNV 风险评分较低的患者比 CNV 风险评分较高的患者具有更长的总生存期和 PFS。
在本研究中, 7名手术患者中有5名在治疗后肿瘤组织中出现TTN/OBSCN“双重打击”。此外,信迪利单抗联合贝伐单抗、奥沙利铂和卡培他滨治疗后,CNV 负荷显著降低。本研究的 NanoString 结果表明CR/PR 患者与非 CR/PR 患者相比,以及治疗后样本与基线样本相比,有更好的肿瘤免疫微环境细胞浸润。这些 RAS 突变和 MSS 患者在接受信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨方案治疗后转变为“免疫热”亚型,具体机制值得进一步探索。
这项二期试验有一些局限性。首先,它采用单臂设计,没有对照组,这可能会引起一些选择偏差。其次,这项单中心试验的样本量有限。此外,由于缺乏总体生存分析,因此无法确定该方案是否能带来长期生存获益。信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨的疗效和安全性需要在更大样本量的随机对照研究中进一步评估。
目前正在启动一项 III 期、随机、开放标签、多中心临床试验(NCT05171660),以进一步分析信迪利单抗联合贝伐单抗、奥沙利铂和卡培他滨作为 RAS 突变型 MSS 一线治疗mCRC的效果、安全性和预后生物标志物。这项即将进行的试验将招募来自 20 个中心的 494 名患者,随机(1:1)分为两组。
总之,信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨作为一线联合治疗,在经MDT评估的 RAS 突变、MSS和不可切除的mCRC中显示出高 ORR、DCR 和可控的安全性。这表明信迪利单抗联合贝伐珠单抗、奥沙利铂和卡培他滨是一种有前景的联合策略,有望提供更多的临床益处。探索性生物标志物评估分析显示 RAS 突变和 MSS患者在接受信迪利单抗加贝伐珠单抗、奥沙利铂和卡培他滨方案治疗后转变为“免疫热”亚型。


