肺癌持续胸腹水咋办?再次基因检测发现ROS1融合,双药治疗破困局!
时间:2023-11-18 21:53:18 热度:37.1℃ 作者:网络
恶性胸腹腔积液是晚期恶性肿瘤常见的临床表现,与预后不良相关。本文报告1例晚期肺腺癌患者伴ROS1重排,其特征为持续的恶性胸腹腔积液。患者接受克唑替尼和安罗替尼联合治疗,恶性积液明显减少甚至消失。探索性使用这种治疗方法改善了患者的生活质量,并有可能延长总生存期。但鉴于该方案为单病例报告,其对伴ROS1重排的肺腺癌患者的疗效仍需多中心临床数据进一步验证。
背 景
非小细胞肺癌(NSCLC)是世界上最常见和最致命的恶性肿瘤之一,占所有癌症病例的80-90%。恶性胸腹腔积液可由恶性肿瘤局部进展或远处转移引起。研究一致表明,伴有恶性胸腹腔积液的患者预后明显较差,中位总生存期为3-6个月。此外,恶性胸腔积液对呼吸、循环系统和消化功能不利,降低患者的生活质量,影响抗肿瘤治疗的有效性。恶性胸腹腔积液的综合治疗策略包括胸腔穿刺术、胸腔闭式引流术和胸腔导管置入。因此,制定合适的治疗方法,有效治疗恶性胸腹腔积液,对于提高癌症患者的生活质量和改善治疗效果至关重要。
近年来,肿瘤的靶向治疗领域取得了重大进展,显著延长了携带特异性基因突变患者的生存期。ROS1基因重排发生于约1-2%的NSCLC患者,是经过验证的治疗靶点。克唑替尼是一种靶向MET/ALK/ROS1的多靶点酪氨酸激酶抑制剂(TKI),在治疗ROS1重排的NSCLC中表现出显著的疗效。安罗替尼是中国研发的一种新型多靶点TKI,可有效抑制血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体、成纤维细胞生长因子受体、c-Kit等激酶,发挥对肿瘤血管生成和生长的抑制作用。虽然克唑替尼和安罗替尼联合治疗小细胞肺癌(SCLC)已经引起了研究的关注,但其临床应用仍然有限。克唑替尼靶向间变性淋巴瘤激酶(ALK)基因重排,而安罗替尼是一种多靶点药物,可抑制多种生长因子受体和血管生成相关途径。体外实验和动物模型表明,克唑替尼和安罗替尼联合治疗SCLC具有潜在的协同作用。这种治疗方法有望同时靶向肿瘤生长和血管生成相关的多个关键通路,从而提高治疗效果。
在对PubMed、Web of Science和CNKI等数据库进行广泛的筛查后,发现有关克唑替尼和安罗替尼联合治疗肺腺癌伴癌性胸腹水的中国患者的文献有限。本文报告1例携带ROS1重排的肺腺癌患者伴恶性胸腹腔积液。经克唑替尼联合安罗替尼维持治疗后,积液获得长期完全缓解。
病 例
患者男,58岁,于2017年6月8日被青岛市市立医院胸外科收治。入院时患者表现为咳嗽、胸闷、持续呼吸急促1个多月。患者工作环境中无明显的触发因素,无癌症或遗传病家族史。整个病程中报告的主要症状是呼吸困难。初始治疗方法为胸腔穿刺引流胸腔积液,缓解了患者的胸闷和呼吸系统症状。
胸部增强CT扫描示右肺门及纵隔多发肿大淋巴结,右胸膜多发结节,胸腔积液。双肺未见明显占位性病变。胸腔积液细胞学检查进一步证实了癌细胞的存在。组织学图像显示,显微镜下可见肿瘤细胞,具有明显异质性。部分细胞呈实性团块或小索状排列,部分可见腺腔形成,部分呈管状或腺样结构排列。免疫组化结果显示:Ki-67(5%+)、TTF-1(+)、NapsinA(+)、CK7(+)、CR(-)、MC(-)、Vim(-)、EMA(+)、CK(+)、CK5/6(-)。体格检查:无胸廓畸形,双肺呼吸运动对称,右肺叩诊音浑浊,中下肺呼吸音消失,左肺叩诊音清晰,无干湿啰音。
患者的肿瘤大小无法测量,肿瘤转移在胸膜处,存在胸腔积液,淋巴结侵犯同侧肺门和纵隔,综合患者的症状、影像学表现、胸腔积液特征、免疫组织化学检测和美国癌症联合委员会(AJCC)分期指南,患者被诊断为右肺晚期恶性肿瘤(腺癌、ⅣA期)。自2017年6月8日起,患者的治疗历程持续了5年多。
该患者的主要治疗方式为化疗(多个周期)。化疗第1个周期于2017年6月17日开始,培美曲塞800mg第1天,奈达铂60mg第1天。2017年7月12日,胸腔内注射Endo45mg、灵芝多糖4mg。随后于2017年7- 8月,患者接受2-3个周期化疗(培美曲塞900mg第1天,卡铂700mg第1天)。基因检测显示EGFR/ALK/ROS1未见变异。2017年9月至2018年1月,患者接受4-7个周期的静脉化疗(培美曲塞900mg第1天、顺铂50mg第1天、贝伐珠单抗600mg)。同时胸腔内注射顺铂80mg和贝伐珠单抗200mg。完成7个周期的化疗后,患者胸腹水症状明显改善,呼吸困难减轻。2018年3月6日,按照医嘱,给予Endo 30mg(第1-7天),培美曲塞800mg(第4天)。但患者未按照医嘱进行治疗。随后的检查显示肿瘤标志物水平增高,PET-CT提示疾病进展。因此,进行额外的2个周期化疗:Endo 30mg(第1-7天),培美曲塞800mg(第3天)。该治疗周期结束后,患者因腹胀和呼吸困难再次入院。随后的CT扫描显示存在恶性胸腔和腹腔积液(图1)。
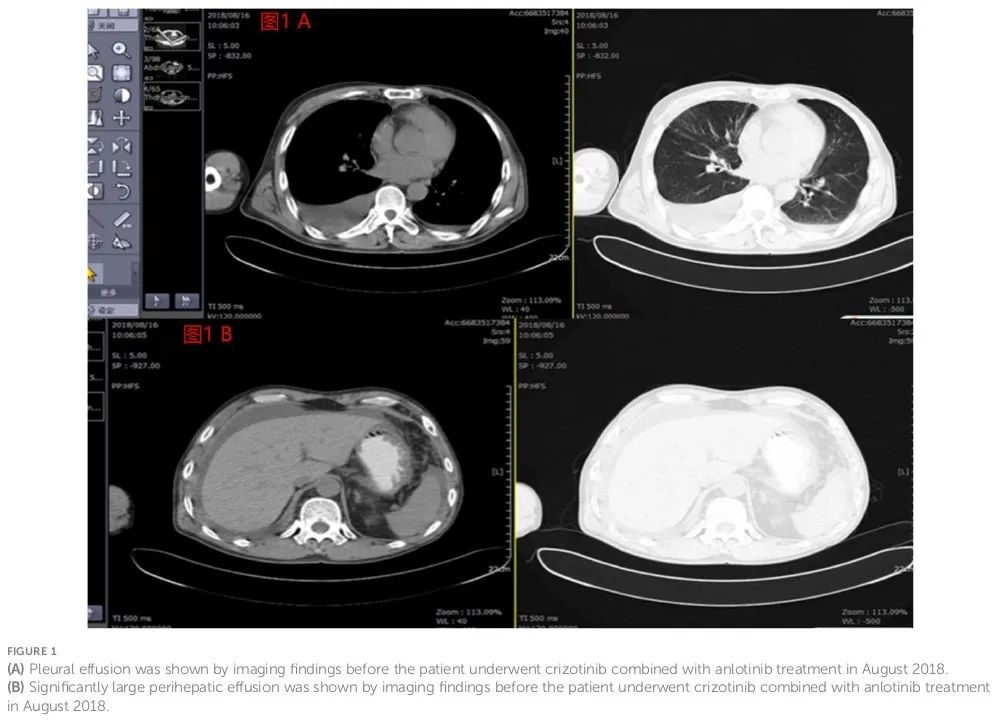
图1(A)2018年8月,影像学检查发现胸腔积液。(B)2018年8月影像学检查示腹腔积液。
2018年8月21日,患者接受姑息化疗(顺铂40mg第1天,50mg第2 -3天)。因复发性胸腹腔积液,于2018年8月24日进行腹腔灌注Endo105mg(第1天、第5天)。随访CT扫描显示肿瘤浸润肠道。血液样本的二代测序显示ROS1重排。自2018年9月5日起,患者开始接受克唑替尼(250mg、2次/d)联合安罗替尼(10mg、1次/d)靶向治疗。治疗后患者症状明显缓解,恶性胸腹腔积液较2018年8月21日CT结果显著减少(图2)。

图2(A)患者在靶向治疗1个月后胸腔积液显著减少。(B)患者的腹腔积液在靶向治疗1个月后显著减少。
继续使用克唑替尼(250mg、2次/d)联合安罗替尼(10mg、1次/d)(安罗替尼给药2周后休息1周)靶向治疗方案,评估患者胸部和肺部体征。随访4年余,患者无呼吸困难,胸腹部影像学检查未见明显恶性肿瘤浸润。用药期间患者出现2级高血压,经口服降压药控制。截至2023年3月,患者疾病进展,并接受了姑息治疗。
诊断/随访和治疗结局
诊断:1.肺部恶性肿瘤ⅣA期;2.恶性胸腔积液;3.恶性腹腔积液;4.转移性结肠恶性肿瘤。
随访及治疗结局:患者因各种原因,目前在青岛市市立医院肿瘤科接受姑息及营养支持治疗。
讨 论
肺癌在中国和世界范围内都是一种高度流行和致命的恶性肿瘤,其中非小细胞肺癌(NSCLC)约占80%。约5%的NSCLC肿瘤伴有位于2号染色体上的ALK基因重排。2007年,Soda在NSCLC中发现了EML4-ALK融合基因,其中最常见的ALK重排涉及EML4基因的5 '端与ALK基因的3 '端融合,导致EML4-ALK融合基因的形成。这种融合蛋白触发ALK细胞内激酶结构域的二聚化,激活下游致癌信号通路,导致疾病进展和预后不良。
恶性胸腹腔积液的形成与血管内皮生长因子(VEGF)密切相关。肿瘤的增殖和转移常伴随着血管密度的增加,而VEGF通过分泌包括VEGFA在内的多种促血管生成因子,促进肿瘤新生血管的形成。肿瘤血管的增生促进了恶性胸腔积液的发展。此外,VEGF还可以与间皮上皮细胞上的受体结合,增加其通透性,促进液体回流,从而破坏液体产生和吸收之间的动态平衡。
本文患者被确诊为晚期肺腺癌。尽管接受了7个周期的铂类化疗,但患者疾病持续进展,对胸腔和腹腔积液的控制欠佳。初始基因检测结果为阴性,但鉴于病情恶化,第二轮基因检测发现ROS1重排。患者接受克唑替尼和安罗替尼联合治疗,以控制胸腹腔积液,治疗1个月后,积液明显减少。患者积液获得稳定的长期缓解,用药过程中未出现严重的不良反应。
克唑替尼和安罗替尼联合治疗有几个优点和局限性。两种药物作为多靶点酪氨酸激酶抑制剂,可同时抑制VEGFR、EGFR、PDGFR、ROS1、ALK等多个关键靶点。这种多靶点抑制机制可能导致更全面的抗肿瘤效应和改善治疗效果,特别是在具有多个异常信号通路的肿瘤中。此外,克唑替尼联合安罗替尼治疗可能通过抑制趋化因子介导的血管生成和增强整体抗肿瘤疗效来克服克唑替尼单药治疗中观察到的耐药性。但值得注意的是,克唑替尼和安罗替尼联合使用可能会增加不良反应的风险,因为这两种药物都有各自的副作用,包括高血压、手足综合征、疲劳和胃肠道不适。此外,联合治疗的疗效可能因个体肿瘤特征和基因变异而不同。虽然初步研究报告了克唑替尼联合安罗替尼治疗肺癌的良好效果,但仍缺乏大规模的临床试验和长期随访数据来确定这种联合治疗的有效性和安全性。因此,需要进一步的研究来验证其疗效并确定最佳的治疗策略。
患者接受了多个周期静脉注射及局部注射的Endo和贝伐珠单抗治疗,但结果并不理想。根据临床医生的经验,使用克唑替尼联合安罗替尼治疗,对患者产生了意想不到的疗效。该联合治疗对ALK-TKI耐药患者是一种有前景的治疗方法。
综上所述,本文中使用克唑替尼和安罗替尼联合治疗携带ROS1重排的晚期肺腺癌伴恶性胸腹腔积液的患者,具有良好效果,显著延长总生存期,提高患者生活质量。初始基因检测结果为阴性后,应避免永久放弃靶向治疗,并考虑进行第二轮基因检测。本病例的临床实践可能为恶性胸腹腔积液的治疗提供新的见解,但仍需进一步研究来阐明其治疗机制并证实其疗效。
参考文献:Tian J, Long L, Zang J, Liu P, Zhao L, Zhang H and Xiao J (2023) Case Report: Long-term remission of malignant pleural and peritoneal effusion in a case of advanced lung adenocarcinoma treated with combined crizotinib and anlotinib therapy. Front. Oncol. 13:1191522. doi: 10.3389/fonc.2023.1191522



