生存期相差4倍!EGFR突变NSCLC患者进行血液EGFR突变监测的意义
时间:2023-11-18 21:24:37 热度:37.1℃ 作者:网络
近年来,非小细胞肺癌的治疗发生了革命性的变化。EGFR酪氨酸激酶抑制剂的出现推动了新的治疗方案的产生。液体活检已成为一种有用工具,在联合低剂量CT扫描的早期诊断以及监测治疗应答和预测患者疾病发展方面显示出潜在效用。本文应用液体活检技术对38例携带EGFR突变的非小细胞肺癌患者在肿瘤进展的不同阶段的循环肿瘤DNA(ctDNA)进行研究。研究结果显示,液体活检单变量分析,EGFR突变阳性患者的平均总生存期显著低于野生型患者(29±4个月vs.104±19个月;P= 0.004),多变量分析也得出同样结论(P= 0.008)。由此可见,液体活检可能是提高生存率的关键。
背 景
肺癌是全球癌症死亡的主要原因,占新发癌症的11.4%,占癌症死亡总数的18%。肺癌主要分为两种类型:小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。约85%的肺癌为NSCLC,包括不同组织学亚型,如腺癌、鳞状细胞癌和大细胞癌。高达80-90%的NSCLC患者在诊断时表现出与原发肿瘤相关的呼吸系统症状;也可能出现与转移灶相关症状,尤其是中枢神经系统受累导致的神经症状和骨痛。吸烟是NSCLC最主要的危险因素之一。但观察到NSCLC非吸烟女性患者的增加,其潜在原因尚不清楚(例如,可能与激素暴露、既往为治疗其他恶性肿瘤(如乳腺癌)而进行的放疗、家庭环境因素等有关)。
肺癌的治疗取决于病理类型、临床分期、分子特征和对患者临床症状的评估。手术是最有效的治疗方法,但仅限于I、II或IIIA期NSCLC患者(仅占总病例的35%)。由于大多数NSCLC患者在诊断时已处于晚期,因此细胞毒性药物的全身性治疗常被用作标准治疗,并显示出一定的生存获益。
随着对NSCLC中促进肿瘤发生发展的潜在分子机制更多了解,许多针对特定基因变异的靶向工具得以开发。表皮生长因子受体(EGFR)基因激活突变的发现,以及EGFR酪氨酸激酶抑制剂(TKIs)的研发,对晚期NSCLC患者的个体化治疗产生了重要影响,改善了患者的生存期。除了这些针对EGFR突变的TKIs外,近年来,通过针对ALK、ROS1、RET、BRAF和KRAS等基因变异药物的研发,以及基于PD-1/PD-L1表达的免疫治疗,使肺癌的治疗发生了革命性突破。因此,NSCLC将个体化治疗带到了全球的前沿,最新发布的指南建议晚期非鳞状NSCLC和部分鳞状细胞癌(SCCs)患者应进行基因检测。
尽管目前在肿瘤早筛、早期复发监测、靶向治疗耐药监测等方面取得了进展,但挑战仍然存在。组织样本是指通过手术或活检等方式采集的肿瘤组织。应考虑对于难以取得组织或取得肿瘤组织不够进行基因检测的患者。
液体活检(LB)是一种微创方法,基于分析生物液体(主要是血液)中的循环肿瘤细胞(CTCs)、血浆中的游离DNA(cfDNA)、循环miRNA、外泌体和肿瘤诱导血小板(TEP)。该方法已成为识别癌症患者分子变异的有力工具。液体活检具有无创性、可动态监测、克服肿瘤异质性等优点。主要的制约是ctDNA含量极低。目前,有各种可用的方法和平台,然而,关于何时是否进行液体活检尚未达成明确共识。
西班牙萨拉曼卡大学医院根据肿瘤内科服务指南对患者进行LB检测EGFR突变状态。本研究的目的是分析该院对EGFR突变型NSCLC患者的临床管理,并评估了LB技术对患者肿瘤演变和OS的影响。
研究结果
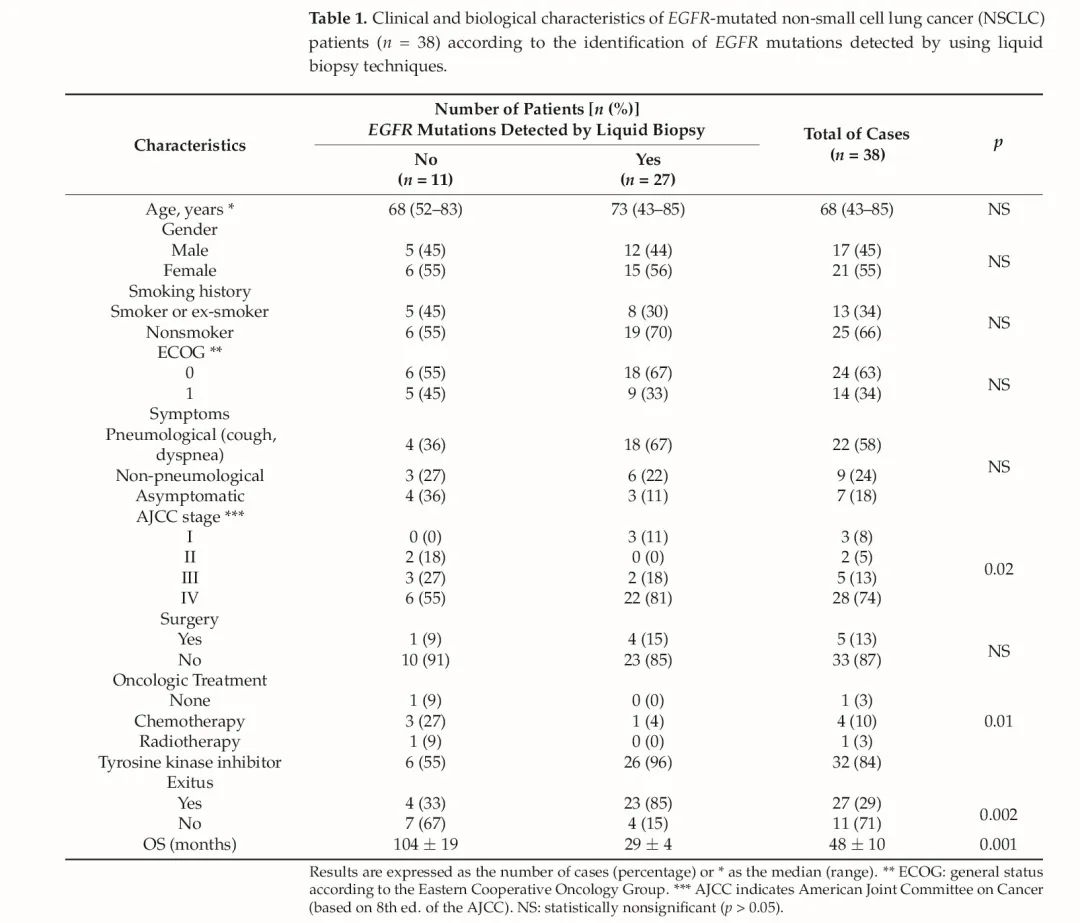
38例患者中,男性17例(45%),女性21例(55%),中位年龄为68岁(43-85岁)。大多数(25;66%)为非吸烟者(表1)。功能状态在两个级别进行评估。38例患者表现出良好的一般状态,根据ECOG评分标准,24例为0分(66%),其余14例为1分(34%)。值得注意的是,18%的患者(7例)完全无症状,其诊断具有偶然性。22例(58%)患者出现与原发肿瘤相关的症状,主要表现为咳嗽、咳痰、咯血、呼吸困难或胸痛;9例(24%)患者出现与转移部位相关的症状,突出表现为神经系统和脊柱不同水平的疼痛。近四分之三的患者为Ⅳ期疾病(28例,74%);5例患者为Ⅲ期局部晚期疾病(13%),少数患者为早期疾病(3例Ⅰ期患者,8%;2例Ⅱ期患者,5%)。大多数患者未接受手术治疗(33例;87%),因此,其组织学诊断是通过小活检(经支气管活检、空芯针穿刺活检(CNB)、细针穿刺活检(FNA)或基于胸腔积液分析的细胞学检查)获得。
表1 液体活检检出EGFR突变型NSCLC患者(n= 38)的临床和生物学特征
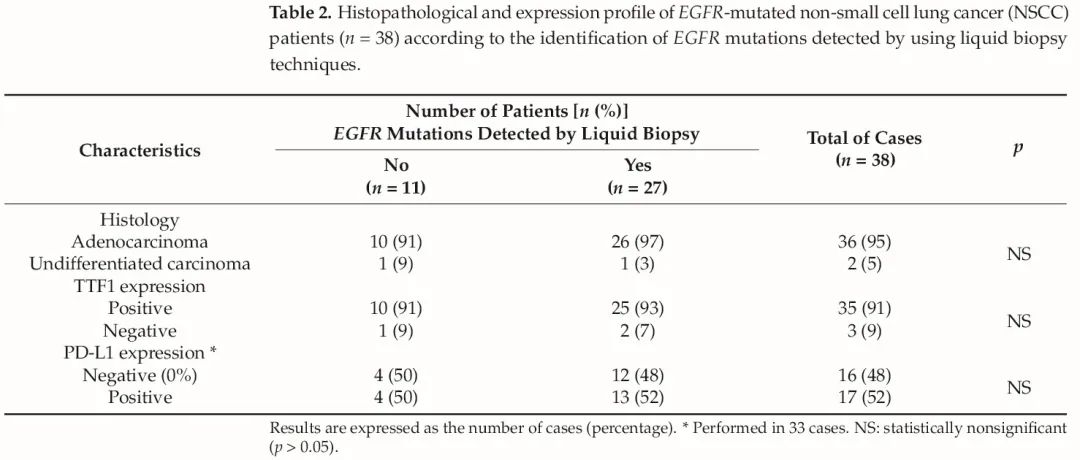
在接收的38例样本中,95%被诊断为腺癌,2例(5%)被诊断为未分化NSCLC(表2)。一方面,所有患者的p40均为完全阴性。另一方面,91%(35例)患者的TTF1呈阳性,对3例TTF1阴性患者中的2例(9%)进行了PAS和PAS淀粉酶检测,结果均为阳性。
表2 对38例EGFR突变的NSCLC患者进行组织病理学分析
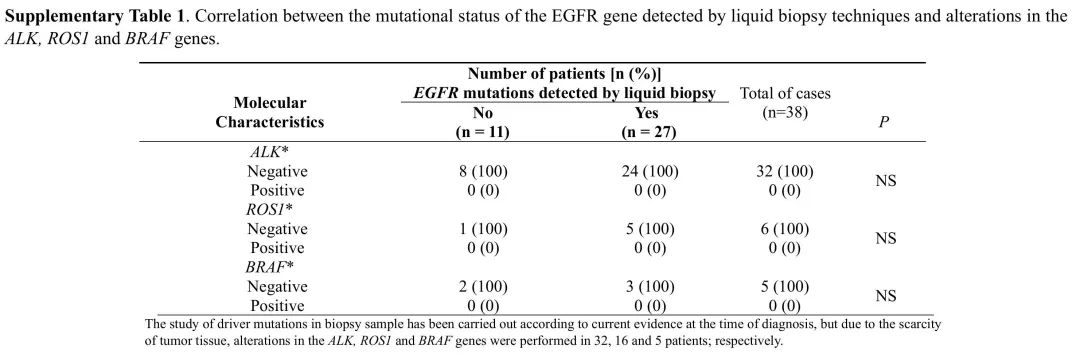
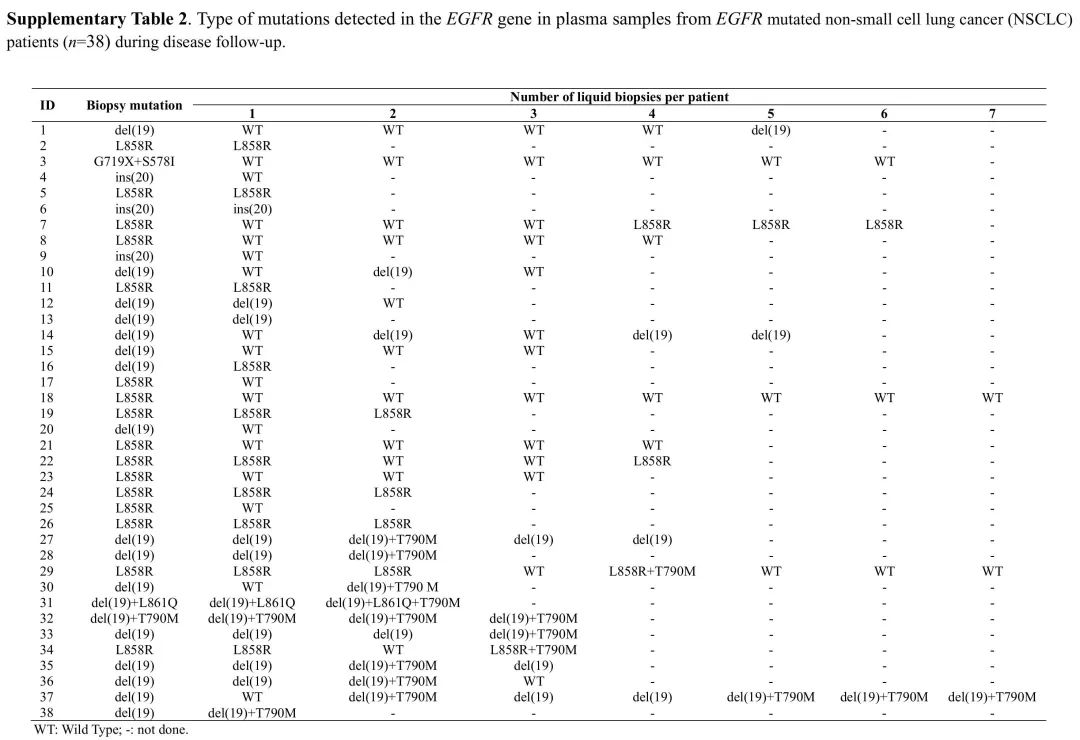
在组织样本中,del(19)和L858R突变是最常见的EGFR突变类型(n=32;84%),其次是Ins(20)(n=3;8%)和del(19)+ L861Q(n=1;3%),del(19)+ T790M(n=1;3%)、G719X + S578I(n=1;3%)复合突变(表S1)。在38例患者中,32例(84%)一线治疗使用第一代EGFR TKIs,其中20例接受厄洛替尼,10例接受吉非替尼。2例患者因Ins(20)突变耐药而接受化疗。此外,4例(10%)患者在术后复发并接受了化疗。
表S1 液体活检技术检测EGFR基因突变状态与ALK、ROS1和BRAF基因变异的相关性
该队列中所有患者进行了至少1次液体活检,以研究EGFR突变类型(表S2),中位随访时间为24个月(4-154个月)。所有LBs均按照医院肿瘤内科要求进行。如图1所示,在71%的患者(n=27)中,LB检测到至少1种EGFR突变类型,其中del(19)和L858R是最常见的突变类型(10例;26%),其次是del(19)+T790M复合突变(4例;10%)。在疾病监测期间,13例患者出现T790M耐药突变,故改用奥希替尼。只有1例患者在诊断时就发现了这种突变(与del(19)相关)。在这13例患者中,T790M突变的中位发病时间为34个月(7-78个月)。
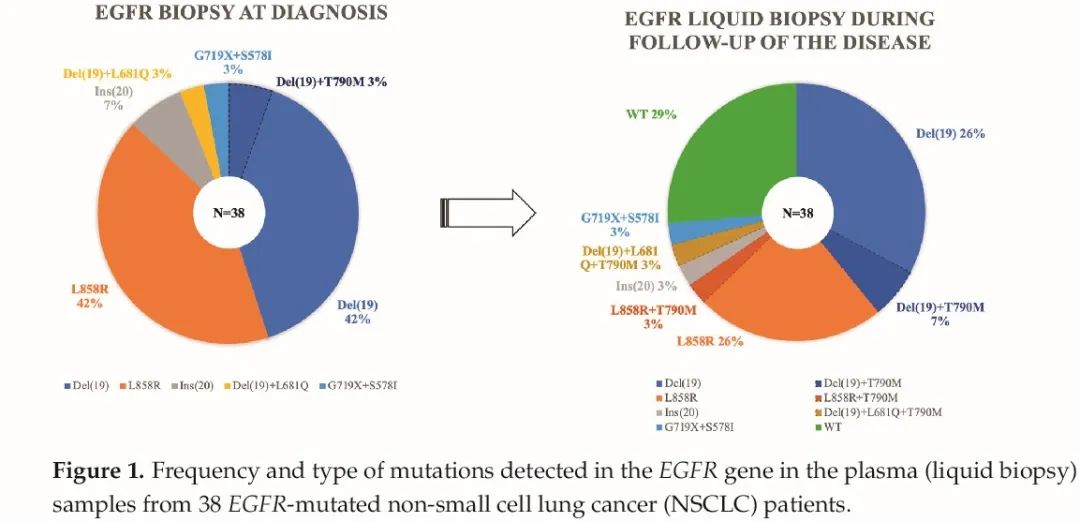
图1 38例EGFR突变的NSCLC患者血浆样本LB检测到的EGFR基因突变的类型和突变丰度
表S2 随访EGFR突变的NSCLC患者(n=38)血浆标本中EGFR基因突变类型
与预期一样,TTF1在大多数病例中呈阳性(n=36;95%),然而,在半数的研究病例中检测到肿瘤细胞中的表达,其与LB阳性无关(表2)。
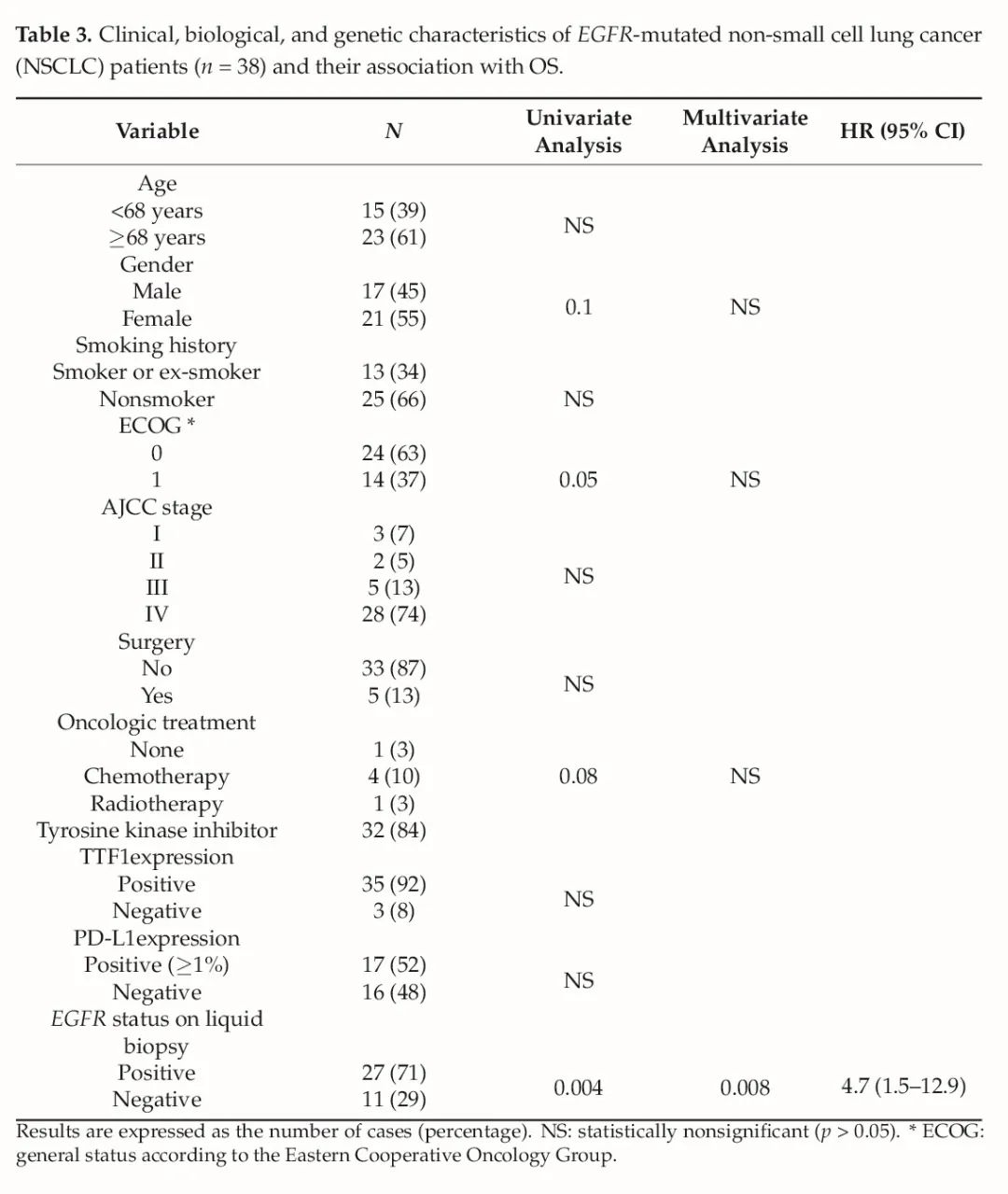
最后,患者的平均OS为48±10个月。在患者监测期间,38例患者中有31例死亡(82%),LBs阳性和阴性患者之间差异具有统计学意义(分别为27例(71%)和11例(29%),p = 0.004)。从预后角度来看,单变量分析中显示对OS有显著影响的变量是治疗、ECOG和LB(p < 0.05)(表3)。然而,在多变量分析中,只有LB保持显著性(HR = 4.7;p = 0.008), LBs阳性组和阴性组患者的平均OS分别为29±4个月vs.104±20个月(p = 0.004)(图2)。
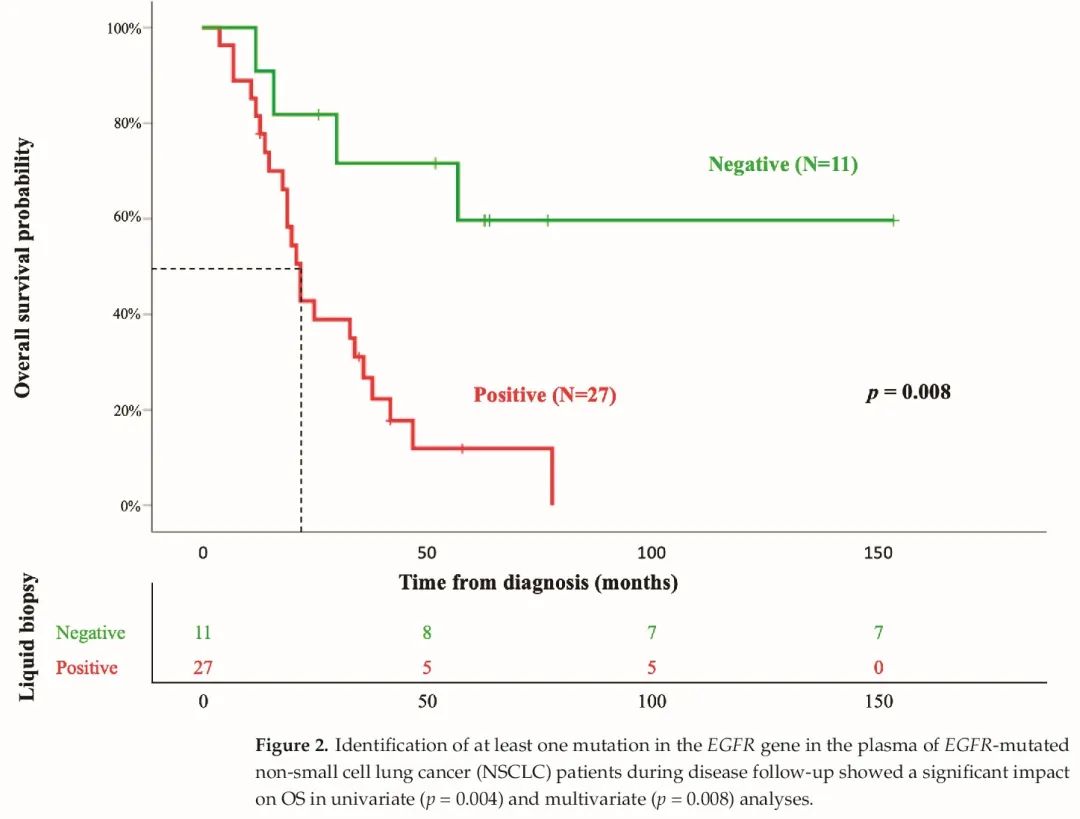
图2 疾病随访期间,在EGFR突变的NSCLC患者的血浆LB中发现至少1种EGFR基因突变类型,在单变量(p = 0.004)和多变量(p= 0.008)分析中显示对OS有显著影响
表3 EGFR突变的NSCLC患者(n= 38)的临床、生物学和基因学特征及其与OS的相关性
讨 论
EGFR突变已成为NSCLC患者,尤其是晚期患者非常重要的治疗靶点,其对患者的OS和生活质量都有重大影响。因此,提高对基因变异的认知,以及LBs在检测和监测该类患者中发挥的作用,对于改进和调整治疗方案以符合患者的疾病阶段至关重要。肺癌患病率导致了近年来个体化医疗的发展,并通过要求临床机构整合临床数据、病理结果和分子谱分析,彻底改变了患者的管理方式。
本文研究结果与既往文献中研究患者的概况相符。总体而言,本文患者中有60%为女性,67%自称不吸烟。这证实了NSCLC女性患者增加的趋势,尤其是非吸烟者。尽管男性的吸烟率随着时间的推移普遍下降,但仍居高不下。在本研究中,有一半的男性患者(n=8)是吸烟者或曾吸烟者,而这种情况只在23%的女性患者(26例中有6例)中被发现。据估计,53%的肺癌患者在55-74岁之间被诊断出,在本研究中,诊断的中位年龄为68岁。值得注意的是,女性中位确诊年龄比男性大约8岁(65±13岁 vs. 72±10岁),这可能是由于女性吸烟率较低,但与吸烟无关的肺癌病因尚未明确(如激素暴露、乳腺癌等其他肿瘤导致的既往放疗或环境因素),也未明确其特征。
尽管手术是早期NSCLC患者的最佳治疗方式,但约35-55%的患者在术后5年内复发。导致这种情况的原因尚未完全阐明,但有学者认为与病变中实性成分的比例、组织学亚型、微乳头生长方式、坏死、空气播散等有关。本研究38例患者中,5例处于疾病早期(Ⅰ-Ⅱ期),手术后,所有患者在整个病程中均出现局部或远处复发。然而,高达80%的肺癌患者被诊断为晚期,其主要诊断技术通常是小活检或FNA。本研究中几乎90%的患者处于局部晚期(n=6;14%)或转移性(n=32;74%),这证实了肺癌通常是在治疗选择有限的晚期被诊断出来的。正因为如此,人们正在广泛研究能够进行早期诊断的检测系统,从而增加治愈性治疗策略的可能性。在这方面,已经有研究证明了低剂量计算机断层扫描(LDCT)作为早期疾病筛查,使患者从中获益。然而,这种方法具有局限性,例如筛查结果容易产生伪阳性(导致误诊,过度治疗)或有极低可能性接受癌症筛检暴露的放射线而患癌症。为了解决这些问题,人们正在探索LB作为LDCT辅助工具的价值,既可以作为筛查方法,也可以通过外周血分子鉴定辅助疾病早期的诊断。事实上,TRACERx研究表明,ctDNA可在影像学检测到的病变出现前6-12个月被检出,在特定人群中,ctDNA可作为LDCT的补充,从而减少诊断干预的数量。
既往研究表明,del(19)和L858R突变是NSCLC患者中最常见的EGFR突变类型,其次是ins(20)。与其他使用类似方法论的研究一致,本文研究结果显示,近半数的NSCLC病例中存在del(19)和L858R。仅在2例患者中观察到复合突变(G719X + S578I和del(19) + L681Q)。据报道,EGFR复合突变其发生率占所有EGFR突变的5% -15%,本研究在6%的患者中观察到复合突变,与既往报道一致。在初诊时存在T790M突变的情况较为罕见。事实上,有人认为其是EGFR基因的胚系突变,并且与不良预后相关。在本研究中,只有1例患者在诊断时出现了与del(19)+ T790M复合突变,与其他携带不同突变类型的患者相比,中位生存期未观察到显著差异(19个月vs. 20个月)。
虽然在NSCLC的诊断和随访中不推荐常规进行LB检测,但本研究获得的结果虽小,却具有显著意义。本研究观察到,随访期间LB未检出EGFR突变的患者,总生存期是LB中检出至少携带1个EGFR突变患者的4倍(平均OS分别为29±4个月vs.104±19个月;P=0.001)。这些数据表明LB对NSCLC患者的预后具有强大的预测价值。在本文研究中,使用定量PCR,然而,目前有更敏感的技术,如微流控技术(数字PCR和BEAMing)或高通量测序(NGS),可进一步提高EGFR基因突变状态的预测价值。在FASTACT-2试验中对基于血液的EGFR突变状态评估的前瞻性分析表明,LB是一种相对敏感且高度特异性的突变检测方法。在基线时具有基于血液的EGFR突变阳性结果的患者中,血液样本中EGFR状态的动态变化与疗效结果有关。同样,LUNGCA-1研究发现,术后患者通过LBs检测可预测复发。尽管除了寻找耐药突变(第一代或第二代EGFR-TKI的T790M耐药突变;第三代EGFR-TKI的C797S耐药突变)或观察到患者对治疗的反应降低后,对于何时进行LB检测尚未达成共识,本文研究结果加强了将其纳入常规肿瘤检测的想法。在开始治疗前和/或术后进行LB检查,并在靶向治疗第一年每3个月进行一次,因为这时通常会出现耐药突变。
据报道,奥希替尼在EGFR突变阳性晚期NSCLC的一线治疗中显示出优于标准EGFR-TKIs的疗效,具有相似的安全性和较低的严重不良事件发生率。本研究在整个随访期间,LBs在13例(34%)患者中检测到T790M耐药突变。因此,LBs有可能作为有效的治疗策略,对患者生活质量和生存产生积极影响。目前已知的奥希替尼耐药的突变机制,如在本研究7%的病例中存在的T790M缺失或C797S突变,随着时间的推移,新的NGS技术将提供更多关于耐药机制的信息。
综上所述,本文研究结果表明,在EGFR突变的NSCLC患者中,LB技术检测到的EGFR基因突变是OS的独立预后因素。液体活检以相对简单、快速的方式监测肿瘤基因突变,这一方法与其他诊断工具一起,可能有助于日常临床实践,改善预后评估,并指导NSCLC患者治疗的临床决策。未来需要更大样本的前瞻性研究来验证LB技术在NSCLC患者诊断和随访中的应用价值。
参考文献:Roldan Ruiz, J.; Fuentes Gago, M.G.; Chinchilla Tabora, L.M.; Gonzalez Morais, I.; Sayagues Manzano, J.M.; Abad Hernández, M.; Cordovilla Pérez, M.R.; Ludeña de la Cruz, M.D.; del Barco Morillo, E.; Rodriguez Gonzalez, M. The Impact of Liquid Biopsies Positive for EGFR Mutations on Overall Survival in Non-Small Cell Lung Cancer Patients. Diagnostics 2023, 13, 2347. https://doi.org/10.3390/diagnostics13142347



