施剑林院士/胡萍研究员《JACS》:雾化吸入式纳米铁剂治疗早期肺癌
时间:2023-11-06 22:43:09 热度:37.1℃ 作者:网络
肺癌是全球死亡率最高的癌症,被称为“癌症头号杀手”。如何高效靶向且有效控制肺癌微病灶是亟待解决的关键科学问题。在肿瘤微病灶环境中,肿瘤干细胞(Cancer stem cells, CSCs)与浸润性免疫细胞群之间的双向交互,是早期形成、复发和转移的重要驱动因素。其中,CSCs和肿瘤相关巨噬细胞(TAMs)之间的相互作用是一个典型范例。TAMs与CSCs在肿瘤组织区域上的相生相伴,为两者之间物质交换提供了极大的便利性,两者既可以相辅相成,又能够相互制约。因此,调控TAMs与CSCs之间相互作用有望成为有效抑制原发性肺癌和转移性肺癌的新思路和新策略。
近期,同济大学医学院附属第十人民医院/中国科学院上海硅酸盐研究所施剑林院士/胡萍研究员团队在化学TOP期刊《JACS》发表题为“Nebulized Therapy of Early Orthotopic Lung Cancer by Iron-Based Nanoparticles: Macrophage-Regulated Ferroptosis of Cancer Stem Cells”的研究论文。该研究开发了一种雾化纳米催化铁剂治疗原位早期肺癌的新策略,基于铁基纳米颗粒靶向并利用TAMs调控肿瘤微环境铁代谢,从而有效诱导肺癌微病灶中CSC发生铁死亡。
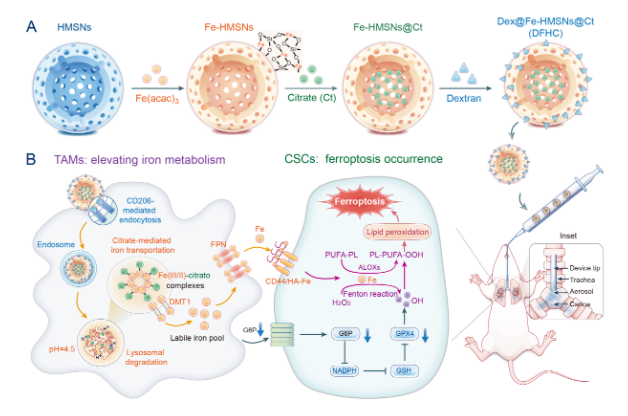
Scheme1 雾化吸入纳米铁剂调控TAMs诱导CSCs铁死亡
【文章要点】
1、设计了一种铁掺杂、孔道负载柠檬酸、表面修饰葡聚糖的介孔二氧化硅纳米平台(DFHC),葡聚糖Dextran配体以靶向TAMs甘露糖受体CD206,利用TAMs溶酶体“铁代谢工厂”生物功能实现−Si−O−Fe−杂化框架可控降解,引起铁离子和柠檬酸的共释放,柠檬酸螯合铁离子加速细胞内转运和代谢进程,最终提升局部肿瘤微环境的铁代谢水平;
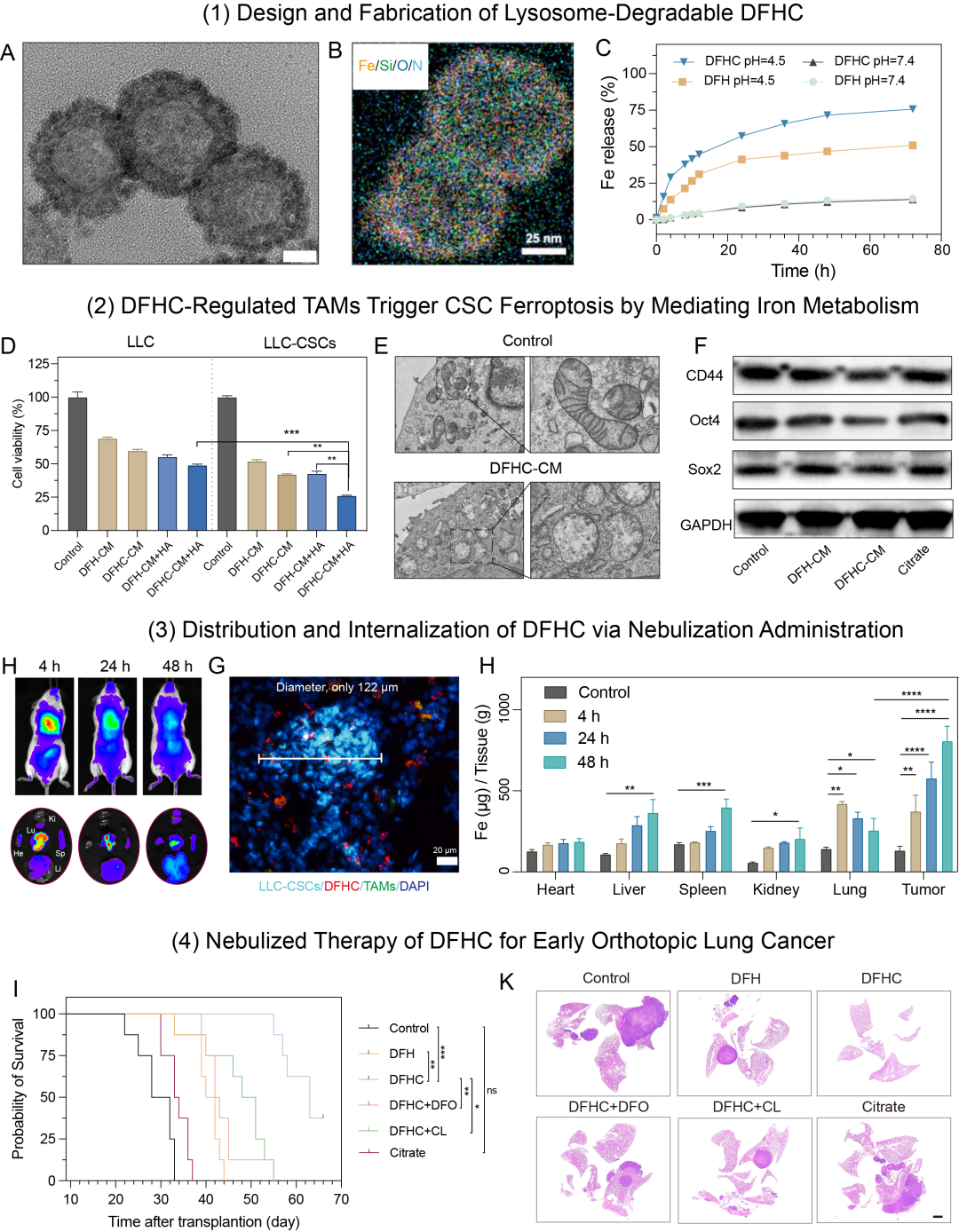
Figure 1 溶酶体可控降解的纳米铁制剂的构建和表征
2、在CSCs和TAMs共存的肿瘤微病灶中,随着铁代谢水平地升高,CSCs高表达的CD44可以通过CD44/HA-Fe通过增加细胞内铁离子水平,铁离子催化Fenton反应引起脂质过氧化,同时葡萄糖-6-磷酸(G6P)含量降低引起氧化还原失衡。最终,高铁累积、脂质过氧化和抗氧化能力损伤共同导致CSCs发生铁死亡,并且显著地降低CSCs干性。
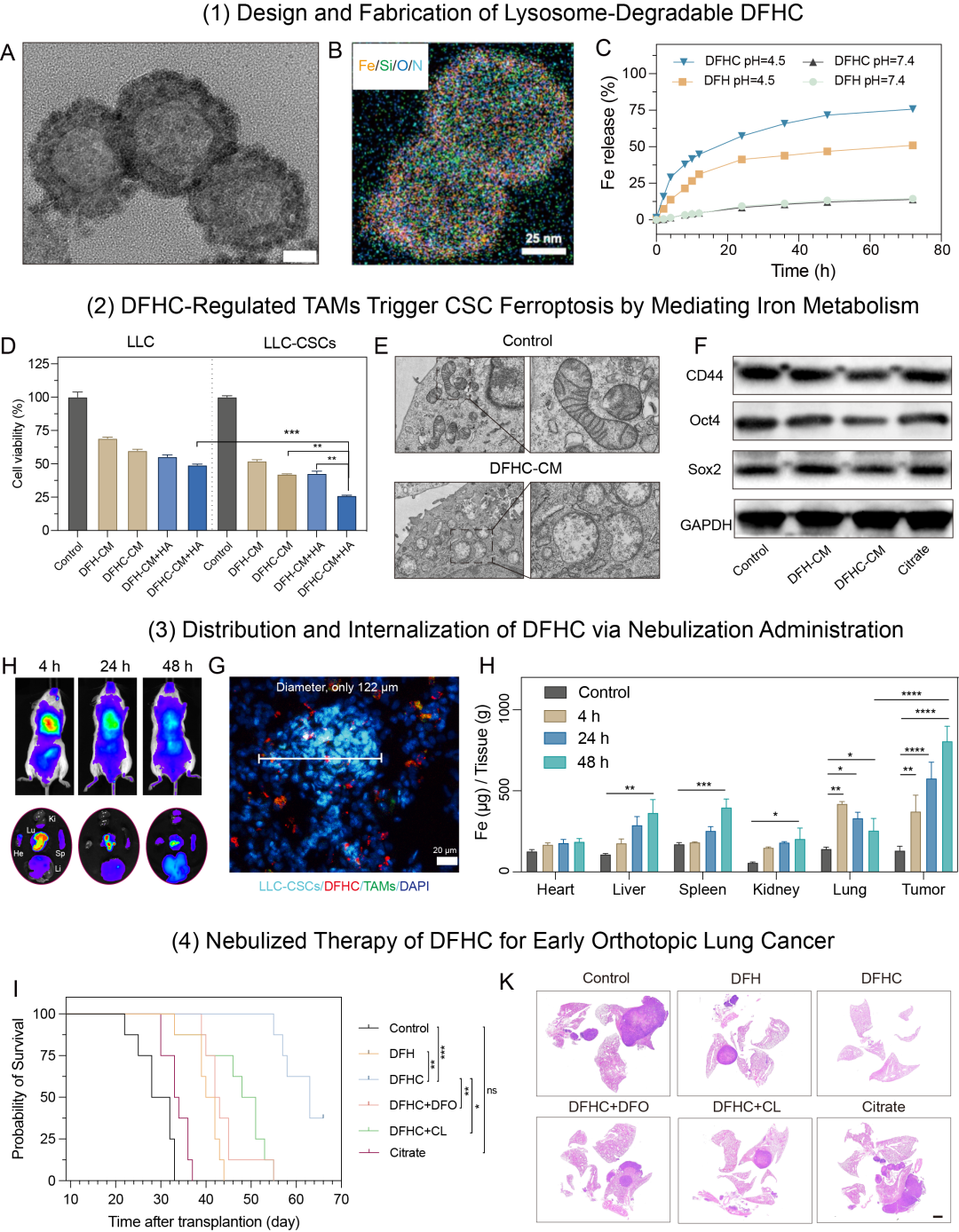
Figure 2 纳米铁制剂DFHC调控TAMs铁代谢诱导CSCs铁死亡并抑制其干性
3、采用雾化吸入给药策略,DFHC在肺内的滞留时间可以显着延长,相比于静脉给药材料在肿瘤内含量提升9倍。有意思的是,材料靶向TAMs可以有效靶向肺癌微病灶,最小直径122 μm。更为重要的是,与静脉给药相比,给药剂量降低3倍的情况下,雾化吸入DFHC仍然能够显著地抑制小鼠原位早期肺癌的生长,从而达到安全且有效地治疗早期肺癌的目标。
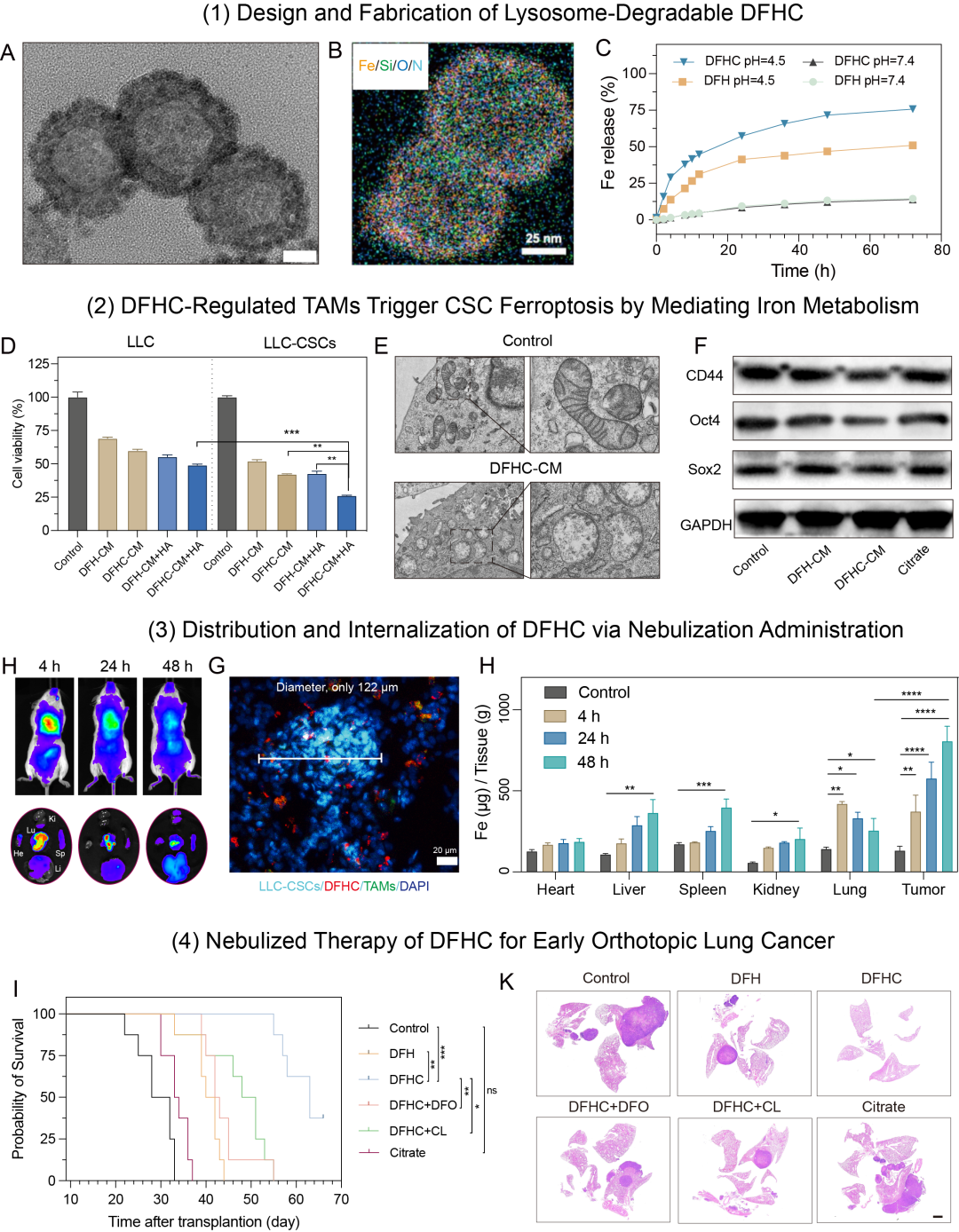
Figure 3 雾化DFHC的体内分布和代谢
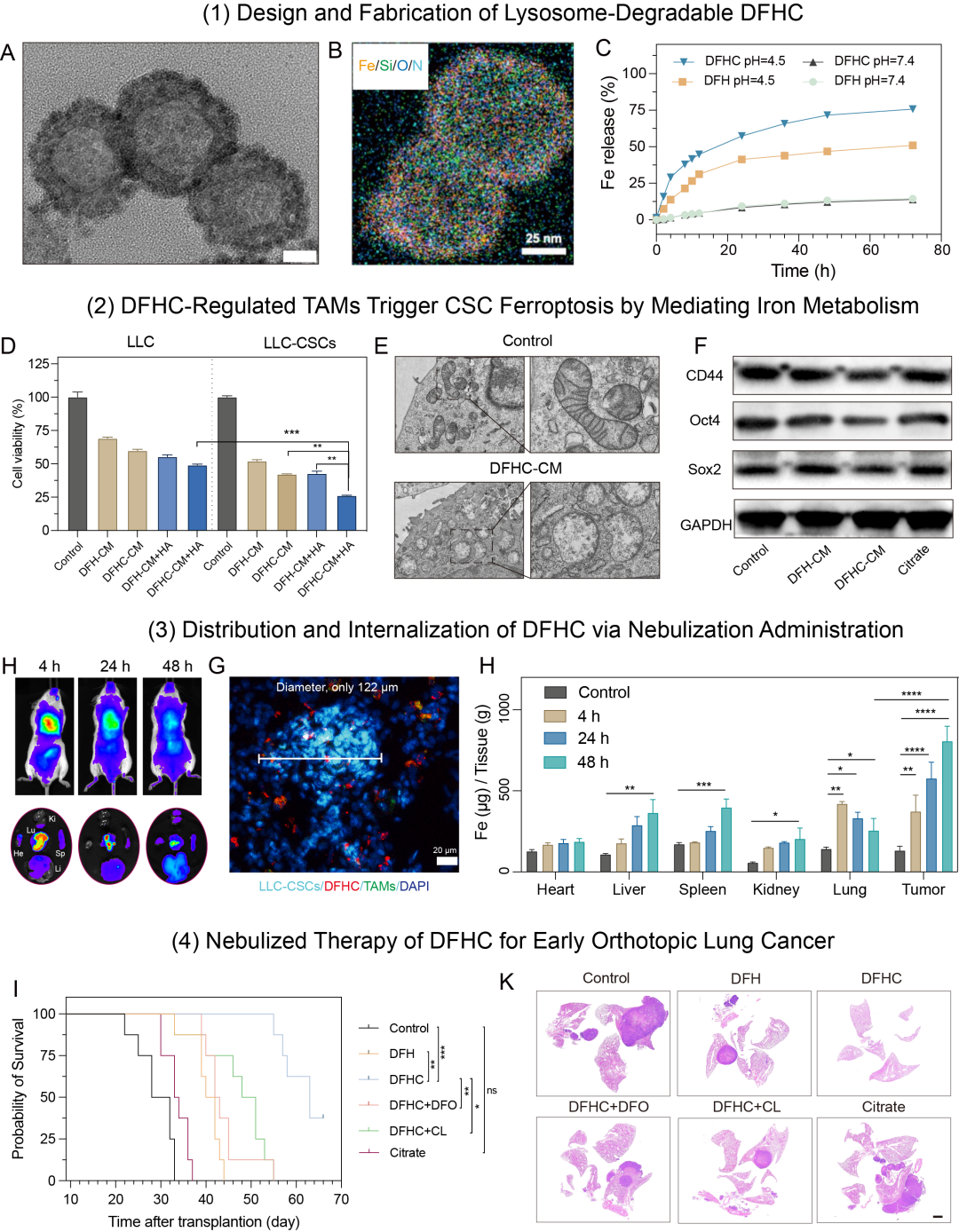
Figure 4 DFHC抑制原位早期肺癌发生和发展
本文章的通讯作者为中国科学院上海硅酸盐研究所施剑林院士和胡萍研究员,文章第一作者为同济大学医学院、附属第十人民医院博士后冯其帅;该研究工作得到了国家重点研发计划、国家自然科学基金、上海市学术研究带头人计划、上海市政府基础研究计划、中国科学院前沿科学重点研究计划和中国博士后科学基金的资助。
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.3c08032


