BLOOD:骨髓增生异常综合征的治疗
时间:2023-11-01 17:40:31 热度:37.1℃ 作者:网络
骨髓增生异常综合征
骨髓增生异常综合征 (MDS) 是一种高度异质性的髓系恶性肿瘤,患者管理和治疗也具有异质性,治疗决策包括识别个体患者的风险、症状和可选项,并进行风险-获益分析。
《BLOOD》近日发表一篇综述,描述了MDS的治疗手段和策略,现翻译全文供参考,水平有限,如有错误敬请谅解。

患者评估和治疗目标
骨髓增生异常综合征 (MDS) 患者可表现为从惰性到重度的多种疾病表现,且随时间发生进展的倾向较高。最常见的血细胞减少为贫血,通常导致慢性输血依赖、生活质量受损和发病率增加。骨髓增生异常肿瘤细胞的遗传学及其与生殖系基因组和骨髓微环境的相互作用具有深刻的异质性,因此理解参与临床稳定和疾病进展的生物学因素是管理疾病的关键。
MDS诊断流程中包括 WHO 和/或 ICC 分类,均发表于2022年,两种分类之间的一个区别是 ICC 将骨髓原始细胞≥10%的患者定义为“MDS/AML”,而 WHO 仍对这些患者使用 MDS 术语。随着新疗法的靶向性越来越强,且不受确切骨髓原始细胞百分比的影响,ICC方法可能有助于主要在急性髓系白血病 (AML) 患者中研究的药物也用于较高危 MDS 患者。
预后更优的 IPSS-M 风险分层系统的引入挑战了当前的治疗建议,这些建议通常是基于使用 IPSS 或 IPSS-R 作为入选标准的临床试验。IPSS-M 的分子信息量更多,通常导致患者从较低危类别转向较高危类别,这意味着需要重新考虑阿扎胞苷的相关建议(基于使用 IPSS 系统的关键性研究获批)。根据IPSS-M风险分层调整建议的挑战可能会持续一段时间,因为早期研究通常未使用测序技术而无法实现转化为 IPSS-M。更新的风险评分和分子特征的影响在不同治疗之间也会有所不同,如阿扎胞苷、促红细胞生成素和HSCT。换句话说,随着更个性化的风险评估,较低危和较高危 MDS 之间的边界变得不那么严格。为了解决这些问题,MDS的管理和治疗应从全面的诊断和预后评估开始,最好从多个评分系统中获取信息。此外还需对个体症状、物质资源和偏好进行深入分析。强烈建议所有符合任何干预条件的患者应在多专业会议上进行讨论,且包括尽可能多的专业(图1)。
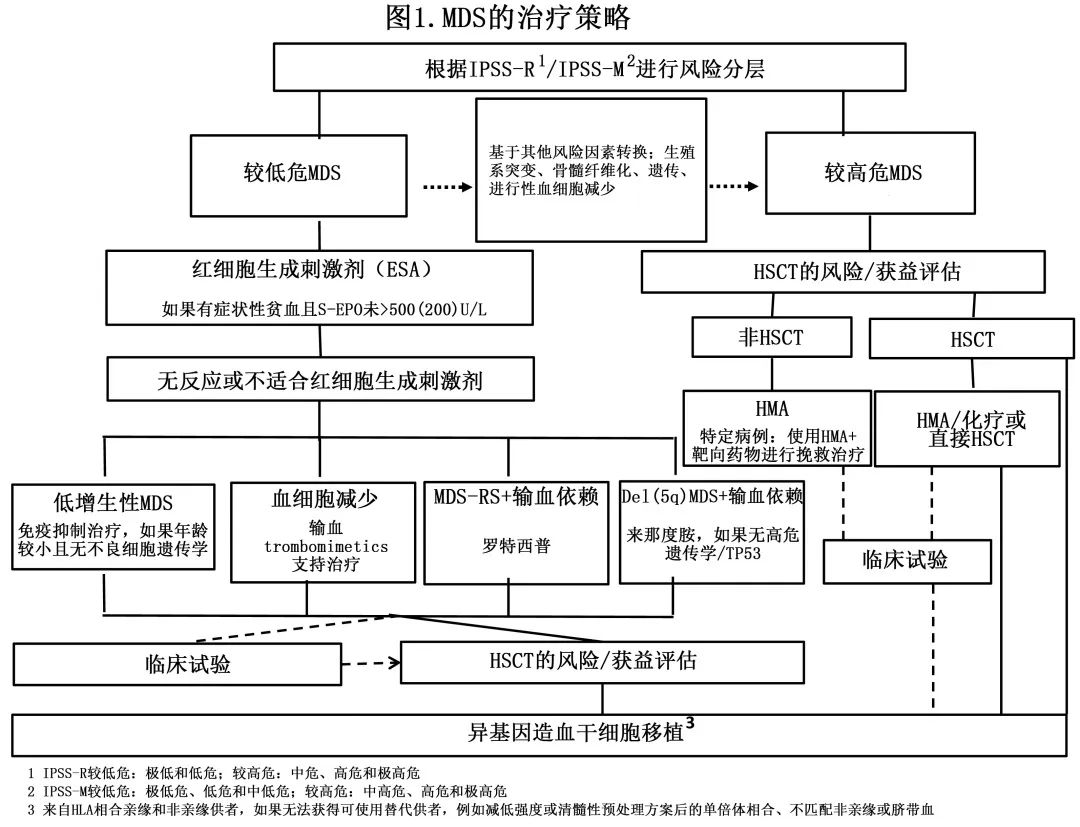
初步决策
MDS 总体预后不良,IPSS-M 中高危至极高危患者的中位生存期约为1.5年,而中低危和低危患者的 OS 分别为4.5年和6年,只有极低危患者10年时未达到中位生存期。这意味着除改善生活质量外,旨在延长生存期的治疗对大多数患者很重要。所有 MDS 变异型在造血干细胞和祖细胞区室 (HSPC) 中具有共同起源,导致目前唯一潜在的治愈方法是异基因干细胞移植 (HSCT)。MDS患者中位年龄接近75岁,加上合并症和年龄相关虚弱,导致大多数患者不适合异基因HSCT。然而考虑到通常预后不良,应始终在病程早期探索 HSCT 的指征和合格性(图1)。瑞典全国 INCA 登记研究将“HSCT意向”作为诊断报告的一部分;29%的18-74岁患者计划接受allo-HSCT,其中仅三分之二实际接受了移植;未HSCT 的原因为疾病进展和难治性、无供者、合并症和感染并发症。具有低危特征的可移植患者在诊断时可能不适合立即进行HSCT,但应进行更密切的监测,以便确定疾病进展,避免错过 HSCT 的最佳时间点。
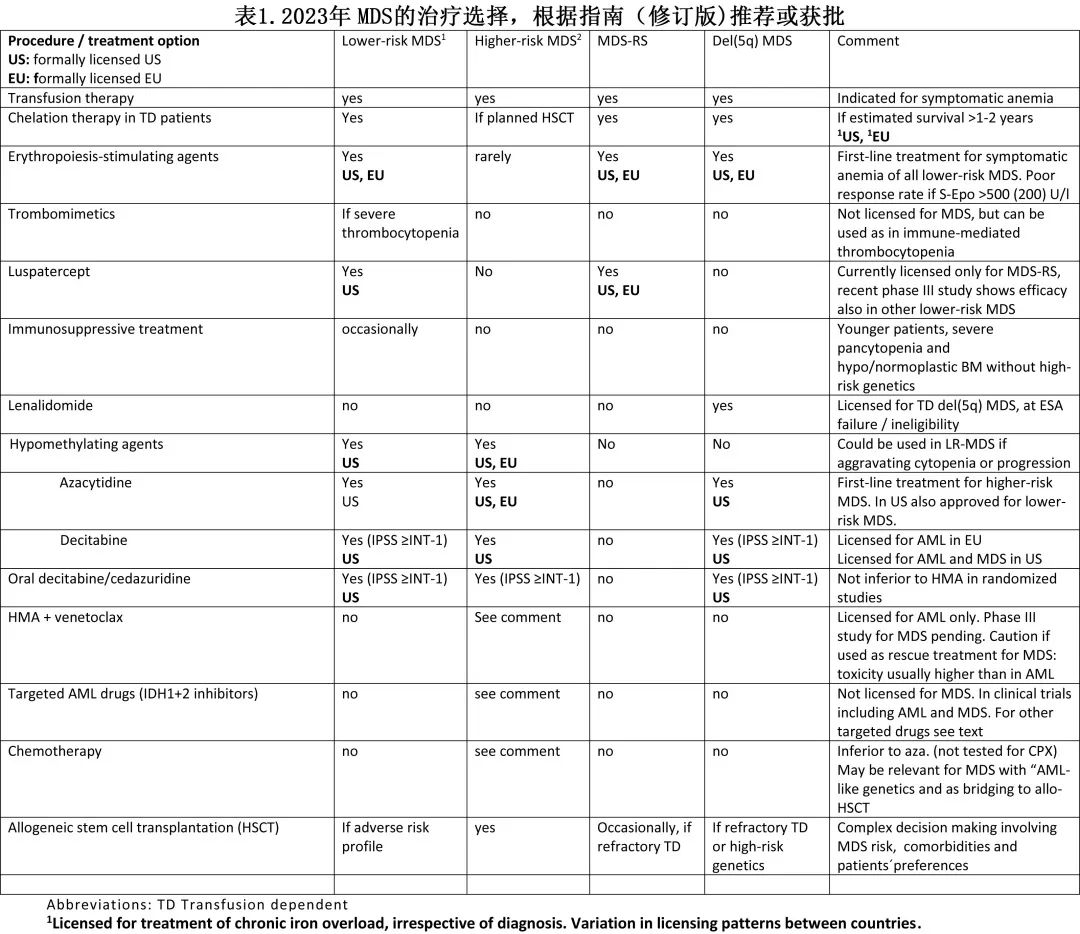
不适合立即进行 HSCT 计划的患者可根据症状、风险特征和疾病生物学做出治疗决策,将在下文进一步讨论。表1列出了 MDS 患者的治疗替代方案以及欧美之间的差异。
支持治疗
支持治疗是所有患者管理的基石,包括主动疾病监测、输血治疗和处理血细胞减少症的其他方面。基于人群的研究显示,约50%的新诊断患者需要输注红细胞 (RBC),大多数未治疗患者贫血会发生进展。诊断时的 RBC 输血需求和病程中的输血强度均与生存期、生活质量和无进展生存期受损相关,且后者提示与更晚期的疾病生物学相关。临床研究表明,较高的输血目标与 QoL 改善相关,因此长期输血治疗应针对个体症状和合并症,而非主要针对血红蛋白水平。一项初步报告的大型流行病学研究显示,输血需求也可能是一个强有力的时间依赖性预后标志物:不考虑 IPSS-M 风险组,在诊断后8个月和12个月的标志性时间点未接受输血的患者的生存率显著优于标志性时间点依赖连续输血的患者。考虑到慢性输血治疗可能是数年甚至数十年内的唯一治疗方法,应仅给予过滤血液制品,以降低免疫风险。
诊断时约40%的患者血小板计数<100x109/L,但仅5%的患者需要输注血小板。血小板计数>20-30 x109/L时罕见重度出血症状,但存在个体差异。然而症状性血小板减少可随着病程的延长而变得更加频繁,常见于化疗和去甲基化药物 (HMA) 治疗期间。基于共识的指南一致认为,积极治疗过程中的血小板输注应由触发水平控制,但主要是基于慢性血小板减少时的出血症状。其他保护性措施(如粒细胞-CSF和感染预防)并非MDS所特有,应遵循当地和国家指南。
铁螯合治疗
儿童期开始不断升级的铁过载会损害器官功能、缩短寿命,而铁过载在导致成人 MDS 患者发病并影响结局的确切程度尚不十分清楚。最近的研究表明,非转铁蛋白结合铁的水平对器官损伤比实际身体铁储备更重要,特别是增生性无效红细胞生成,如 SF3B1 突变MDS-RS 可能增加铁过载相关发病风险。
回顾性分析表明,铁螯合治疗 (ICT) 与较低危MDS 患者的预后改善相关,但治疗决策可能受到医生对患者预期生存期判断的影响。一项前瞻性随机 II 期研究比较了地拉罗司与安慰剂,显示地拉罗司组患者的无事件生存期改善(事件定义为死亡、转化和心脏或肝脏异常),但该研究的目的并非评估对总生存期的影响。此外,一项针对较低危 MDS 患者的大型前瞻性非干预性登记研究的倾向评分匹配分析显示,接受铁螯合治疗的患者的总生存期更佳。由于铁过载可增加异基因干细胞移植后非复发死亡的风险,如果在治疗过程中考虑异基因干细胞移植,应开始螯合治疗,但不应推迟移植。如果适当螯合的时间太短,可在预处理治疗期间给予低剂量地拉罗司以降低不稳定的血浆铁。欧洲和 NCCN 指南也采纳了一种实用的观点,即铁螯合适用于长期输血需求但预后良好的较低危 MDS 患者,以及适合异基因干细胞移植的患者。用于铁螯合的药物目前有地拉罗司(口服)、去铁胺(通过输液泵静脉或皮下)和去铁酮(口服)。大多数指南建议以地拉罗司开始治疗,如果疗效充分且毒性可接受,则继续治疗。然而在通常使用植入式静脉输液港的国家,肠外使用去铁胺也是一种有效的替代方法,除需要连续输注外无其他副作用。通常可以联合使用不同的螯合剂而无问题。
治疗反应标准
已经制定了干预性治疗反应的统一标准,以便对临床试验的结果进行比较。较低危MDS 的标准通常要求 Hb<10g/dL 的患者有资格参加旨在改善血红蛋白水平的试验。此外,只有 Hb<9g/dL 时给予的红细胞输注被认为是按照方案给予的。然而临床试验中的受试者在许多方面与真实世界患者不同,贫血引起的症状在高龄时变得更糟,尤其是在心血管合并症的情况下。从而导致 NCCN 和MDS欧洲指南都认为“症状性贫血”是开始临床实践干预的原因。对于重度血红蛋白病(hemoglobinopathies)患者,难治性输血依赖 MDS 患者应尽可能好的与疾病共存,而非仅仅生存。
生长因子治疗
红细胞生成刺激剂 (ESA) 用于治疗较低危MDS 贫血已有30多年的历史,根据国际指南,ESA已成为一线治疗。许多 II 期研究表明,ESA可改善超过50%接受治疗患者的血红蛋白水平且无副作用(前提是避免超常血红蛋白水平)。两项随机安慰剂对照研究纳入无或中度输血需求的较低危患者,分别证明了依泊汀-α和达依泊汀对血红蛋白水平和至 RBC 输血依赖(TD)时间的显著影响。ESA 是否影响总生存期的问题已被其他类型的研究解决。北欧和意大利较低危MDS 患者(后者当时无法获得ESA)之间的比较显示,无输血需求或低输血需求的患者接受 ESA 治疗后 OS 改善。最近的一篇系统性综述得出结论,ESA治疗除了提高血红蛋白水平,还与 QoL 和 OS 改善相关,低或中度 TD 和S-促红细胞生成素低水平可预测治疗反应。大型前瞻性 EU-MDS 登记研究入组了诊断时为 IPSS-R 极低危-中危MDS患者,并记录了根据临床常规给予的治疗,意味着基于国家立法和治疗传统,患者是否暴露于ESA治疗。基于来自17个国家的1696例患者的分析显示,当在长期输血依赖发生之前或之后早期开始治疗时,ESA治疗可显著延长至首次输血的时间。重要的是,倾向评分匹配分析比较暴露或未暴露于 ESA 的患者(无论反应或治疗持续时间如何),显示 ESA 暴露组的生存率有改善趋势 (p=0.07)。根据2448例患者(ESA未治疗,n=1265;ESA治疗,n=1183)对该分析进行的初步更新显示,ESA暴露组与未暴露组达到合格标准的中位 OS 分别为44.9和34.8个月,表明 ESA 组具有明显的生存优势(p<0.003)。生存优势的生物学原因可能是多因素的,可能包括更好的心肺和身体功能以及更少暴露于输血治疗的负面影响。ESA 初始反应患者的后续治疗失败通常与疾病进展无关,而与造血干细胞水平的克隆优势增加相关。
几项随机 II 期研究表明,在促红细胞生成素基础上加用低剂量粒细胞-CSF(G-CSF) 可改善或恢复对 ESA 的反应。这种协同作用在 MDS-RS 中尤为明显,并且与 G-CSF 对线粒体介导的红系细胞凋亡的抗凋亡作用有关。G-CSF 尚未在任何国家正式获批用于 MDS 贫血,因此传统上评估 EPO 难治患者联合治疗的可能性取决于当地报销系统。
总之,ESA是较低危MDS 贫血的一线治疗,最好在出现长期输血需求前开始。在 200-500 U/L 范围内的各种研究中,较高的 S-EPO 水平与反应率明显降低相关,可能需要其他治疗选择。尚未在 ESA 背景下评价IPSS-M,但表明疾病进展风险较高的分子特征可能不利于治疗。表2给出了如何使用 ESA 联合或不联合 G-CSF 治疗较低危 MDS 贫血的实际建议。

艾曲波帕获批用于治疗重度慢性免疫介导的血小板减少症,并已在入组 MDS 患者的临床试验中进行了评估;但在较高危 MDS 患者中开展的随机研究(单用或与阿扎胞苷联合)失败,接受阿扎胞苷+艾曲波帕治疗的患者对阿扎胞苷的缓解率较低。相比之下,小型 II 期研究表明,血小板减少性较低危MDS 患者可能对血小板计数增加有反应。艾曲波帕在任何临床试验中均未显示生存优势,也未被批准用于MDS,但临床经验表明,在较低危患者发生重度慢性血小板减少症的情况下,艾曲波帕可用于升高血小板计数并减轻出血症状。还在较低危MDS 中评估了血小板生成素 (罗米司亭),与艾曲波帕相似,这些研究未达到显著疗效,但扩展研究未发现安全性问题。考虑到罗米司亭是皮下给药,且 MDS 造血干细胞表达血小板生成素受体,因此在特许使用情况下,其替代治疗的吸引力可能低于艾曲波帕。粒细胞-CSF 未获批用于治疗 MDS 相关的低中性粒细胞计数,但在去甲基化药物治疗引起的中性粒细胞减少症中常用作支持治疗,尤其是在复发性感染事件后。
罗特西普
罗特西普通过减少 Smad2/3 信号从而增强晚期红细胞生成来纠正贫血,最初证明在无骨髓衰竭的患者中可引起红细胞增多。一项 II 期研究显示对较低危 MDS 的贫血有显著影响,尤其是环形铁粒幼细胞 (MDS-RS) 和 SFB1 突变患者。随后的一项双盲、安慰剂对照、3期研究证实其显著疗效,研究主要终点为摆脱输血依赖(TI)≥8周,仅入组 MDS-RS 患者,大多数携带 SF3B1 突变。研究前输血需求为每8周4至<6个单位的患者的反应率为37-38%,TI达到最长持续时间30周,而输血强度较高的患者的反应率较低。研究中S-促红细胞生成素与罗特西普的反应无关,表明作用机制可能与促红细胞生成素不同。但与 ESA 相似,罗特西普似乎并不抑制突变克隆。最近发表一项1:1随机化 III 期研究的中期报告,评价了罗特西普vs 促红细胞生成素治疗 Hb<9g/dL 且接受≥2个 RBC 单位治疗的较低危MDS 患者,结果显示罗特西普组的12-24周摆脱输血依赖率显著较高。有趣的是,在突变负荷较低的患者中促红细胞生成素的疗效较高,而在罗特西普组未观察到相似的相关性。而且,在环形铁粒幼红细胞患者和携带 SF3B1 突变的患者中,罗特西普的缓解率显著优于促红细胞生成素,但在其他亚组中并非如此。这些研究进一步强调了罗特西普为较低危 MDS 提供了一种新的作用机制,尤其是在 SF3B1 突变MDS-RS 中。
免疫抑制治疗(IST)
低增生性(Hypoplastic)MDS 定义为骨髓细胞构成<30%的亚组,通常为深度全血细胞减少,但无遗传高危因素或生殖系疾病。患有这种低增生性和偶有正常增生的较低危MDS年轻患者中,IST如抗胸腺细胞球蛋白 (ATG) 和环孢素 a 治疗可改善小部分患者的血细胞减少。大型前瞻性研究较少,且大多随访时间较短,各研究也采用了不同的入选标准和 IST 方案。在一项包含570例患者(中位年龄62岁)的大型META分析中,80%的患者 IPSS 评分为低危或中危-1,完全缓解率和红细胞输注非依赖性率分别为12.5%和33%,每患者/年 AML 进展率为8.6%。尚未对免疫抑制治疗与突变特征的关系进行可靠评价。欧洲和 NCCN 指南均确定了一组骨髓发育不良或正常且核型正常的年轻较低危 MDS 患者(8三体综合征除外),其可能对免疫抑制治疗有反应。
来那度胺治疗
基于一项大型 II 期和一项随机安慰剂对照 III 期研究,来那度胺获批用于治疗伴del(5q)的输血依赖较低危MDS;后者在超过50%的患者中显示摆脱 RBC 输血依赖,持续时间未达到,3年总生存率和 AML 风险分别为56%和25%。来那度胺诱导含 del(5q) 细胞中CK1α的泛素化和降解,导致对恶性祖细胞的强烈抑制作用,事实上是唯一具有该作用获批用于较低危MDS 的药物。来那度胺并非治愈性治疗,不影响造血干细胞,中位缓解持续时间约为2年,复发患者有明确的分子学和疾病进展风险。约20%的较低危 del(5q) MDS 患者携带 TP53 突变亚克隆(原始论文中VAF 1-54%),由于 TP53 突变细胞对来那度胺不敏感,治疗可导致突变克隆的克隆选择。最近研究表明,来那度胺在实验环境中也可促进 TP53 突变的发生。最近的一项真实世界登记研究分析证实,孤立性del(5q)较低危 MDS 的缓解率较高,如果在长期输血需求开始前开始则预后显著更好。一项基于西班牙 MDS 登记研究的早期研究未显示来那度胺暴露和非暴露患者的 OS 和 AML 转化存在显著差异;从治疗开始中位随访22个月后,来那度胺组 AML 转化率为31%。评价分子学缓解患者暂停治疗的研究正在进行中。NCCN 和 MDS欧洲 MDS 指南推荐来那度胺用于治疗对红细胞生成刺激剂难治或不适合且缺乏 TP53 突变的输血依赖del(5q) MDS 患者(通过常规 NGS 分析[敏感性最低VAF 2%]或 p53 免疫组化进行分析,然而后者可能更难解释)。此外,在许多非 (del5q) 较低危MDS 研究中评估了来那度胺,并与阿扎胞苷联合治疗较高危MDS,但未达到预期终点。
总之,来那度胺为del(5q) MDS提供了独特的抗克隆作用机制,可诱导持续数年的完全红系缓解。符合条件的患者应接受 NGS 分析,如果发生 TP53 突变则不建议治疗。根据经验,在 TP53 驱动的疾病进展的情况下转化为 AML 可能非常快,几乎没有机会进行有效干预。对于适合 HSCT 的年轻患者,如果给予来那度胺治疗,应伴随频繁的分子学随访;不适合 HSCT 的患者中,治疗也应伴随分子监测。对于不适合 HSCT 的重度输血依赖 TP53 突变 del(5q) 患者,是否给予来那度胺的决策应先于详细信息和共同决策。
Imetelstat和其他治疗较低危MDS的新型靶向药物
本综述的范围是描述临床可用的治疗选择,因此本节有限。过多的新型化合物通过截然不同的机制靶向造血,并已在 I-II 期临床试验中进行了评价。除了一个例外,很少有人在随后的随机 III 期试验中被证明是成功的。Imetelstat 是一种第一类端粒酶抑制剂,在 II 期研究和随后的2:1随机安慰剂对照 III 期研究中,在较低危MDS 的输血依赖患者中进行了评价。包含57例患者的 II 期研究报告8周和24周 RBC TI 率分别为37%和23%,中位 TI 持续时间为65周。III 期研究最近被接受发表,与安慰剂治疗患者相比,Imetelstat治疗患者的 TI 有意义的增加。有趣的是,这些研究报告应答患者的变异等位基因频率 (VAF%) 降低,如果可以证实,这将是具有潜在肿瘤抑制作用的较低危 MDS 的第二种药物。
去甲基化药物(HMA)
去甲基化药物已成为较高危 MDS 的一线标准治疗,包括阿扎胞苷、地西他滨和口服地西他滨/cedazuridine,但获批适应症不同。尽管地西他滨在随机研究中未显示生存获益,但第一项阿扎胞苷治疗较高危 MDS 的随机研究显示,其与最佳支持治疗 (BSC) 相比可显著改善白血病转化或死亡(21个月vs. 12个月)。随后的国际AZA-001 随机研究显示,与标准治疗方案(包括医生选择的 AML 样化疗、低剂量 ara-C 或最佳支持治疗)相比,阿扎胞苷可显著改善中位总生存期(24.5 vs. 15个月);且在所有亚组(包括老年患者)中均观察到生存获益;阿扎胞苷治疗的患者也表现出 AML 进展延迟、红细胞输注减少和感染并发症发生率降低。
HMA 的血液学缓解率约为40%,但治疗很少完全缓解 (8%),大多数患者最终复发。在 AZA-001 研究中,阿扎胞苷的总缓解率高于 BSC 和LD ara-C,但未优于强化化疗。阿扎胞苷组的血液学缓解持续时间更长(13.6个月,对照组为5.2个月);大多数患者在前6个周期内(疗效评估前的推荐周期数)缓解,除非计划行allo-HSCT。尽管阿扎胞苷具有生存获益,但真实世界数据尚未证实治疗的可靠生存获益。
CC-486 是一种口服阿扎胞苷,作为巩固治疗后可改善 AML 患者的生存期。一项在主要是较低危MDS 患者中评价 CC-486 的随机 III 期研究显示,与安慰剂相比,输血依赖率显著降低,缓解持续时间更好,但未导致生存期改善。其批准的是 aza-001 研究中使用的剂量;75 mg/m2 xVII。但也在较低危 MDS 患者中研究了 HMA 的替代剂量,数据支持地西他滨(3天而非5天)和阿扎胞苷(7天或10天方案中给药5天)的较低剂量。此外,一些中心使用5+2+2方案或在5天内给予整个剂量,以避免周末治疗。最近一项基于449例日本和瑞典 MDS 患者的大型分析显示,CR和 mCR 通常(但并不总是)与克隆减少 (VAF%) 相关,而这种减少可预测长期结局。携带 TP53 突变的患者数据尤其有力,事实上所有在后续 HSCT 后长期存活的 TP53 突变患者在阿扎胞苷后均显示明显的克隆减少。
HMA联合新药和分子靶向药物
已测试了多种新药联合阿扎胞苷以便进一步改善患者预后,但到目前为止收效甚微。在一项前瞻性随机研究中,阿扎胞苷联合来那度胺或阿扎胞苷联合伏立诺他治疗较高危 MDS 的总缓解率和生存期与阿扎胞苷单药治疗相似。同样,与阿扎胞苷单药相比,pevonedistat(NEDD-8活化酶的选择性抑制)联合阿扎胞苷也未改善较高危 MDS 的EFS。在一项早期 Ib 期研究中,阿扎胞苷联合抗 CD47 抗体 magrolimab取得令人鼓舞的结果后,正在进行的 III 期研究因缺乏疗效而中止。BCL-2 抑制剂维奈克拉联合阿扎胞苷治疗 AML 的批准促使人们对该联合治疗也在 MDS 中进行了研究。联合治疗在 HMA 初治患者中诱导75%的总缓解率 (ORR),在 HMA 失败患者中诱导44%的ORR。尽管在早期临床研究中报告了高应答率,但最近完成的阿扎胞苷+/-维奈克拉随机研究的有效结果仍有待确定。缓解率高的新型联合治疗可能成为异基因干细胞移植前化疗(减少原始细胞数量)的合适替代方案。因此,目前没有确凿的证据支持使用阿扎胞苷联合维奈克拉作为 MDS 的一线治疗,但联合治疗已发展为相对常见的二线替代治疗。然而,由于深血细胞减少和并发症比标危 AML 更常见,因此应谨慎使用。此外,关于不同分子 MDS 亚型的数据待定。
5-15%的 MDS 患者携带IDH1 或2突变,enasidenib在 IDH2 突变 MDS 患者中显示出缓解。阿扎胞苷联合 APR-246 治疗 p53 突变 MDS 患者可诱导50%的完全缓解,但随后的 III 期研究未显示结局差异。需要指出的是,新 ICC 分类(将既往 WHO 2016中原始细胞≥10%归类为 MDS/AML)可能允许在较高危MDS 中使用 AML 的批准药物。总之,HMA目前是较高危MDS 的一线治疗,但未来可能会被阿扎胞苷联合方案取代,至少对于年轻患者是如此。
化疗
AMl 样化疗方案(包括蒽环类药物-ARA-C 联合治疗)已用于高原始细胞计数的 MDS 患者,但与新发 AMl 患者相比,缓解率更低且 CR 持续时间更短。此外,在老年患者或不良核型和/或 TP53 突变患者中,AML样化疗缓解率更低,与阿扎胞苷治疗相比无明显获益。CPX-351(一种脂质体蒽环类药物)联合基于 Ara-C 的化疗可降低毒性,在较高危 MDS 患者中的 CR 率为52%。目前,AML样化疗主要用作异基因干细胞移植前的诱导治疗,仅推荐用于无不良核型或双等位基因 TP53 突变的年轻 MDS 患者。
干细胞移植
异基因干细胞移植是目前唯一的治愈性治疗方法,但其固有的治疗相关发病率和死亡率限制了 MDS 患者的使用。由于在前瞻性研究中尚未确定 MDS 异基因干细胞移植的最佳时间,因此使用复杂的统计多状态模型对移植和未移植 MDS 患者进行了比较。在这些模型中,立即异基因 HSCT 有利于 IPSS 中危-2或高危患者,而 IPSS 中危-1或低危患者从非移植治疗中获益更多。在两项前瞻性供者与非供者比较中,与无供者相比,具有可用供者的 IPSS 中危-2和高危以及具有高危细胞遗传学的 IPSS-R 中危患者的总生存期显著改善。在 BMT-CTN 研究中,校正供者组的 OS 为47.9%,而无供者组为26.6%。一项相似的前瞻性研究 (VidazaAllo) 根据供者可用性在55-70岁较高危 MDS 患者中比较了阿扎胞苷与阿扎胞苷诱导后allo-HSCT,并报告 HSCT 后3年无事件生存率为34%,阿扎胞苷后为0%,从而进一步支持使用异基因干细胞移植;即使在老年患者中也是如此(表3)。

在一项纳入低危、中危-1和-2 MDS 患者的中国前瞻性研究中,与常规治疗相比,allo-HSCT显著改善OS(79%vs. 56%)。一项针对低危和中危-1 MDS 患者的大型回顾性 EBMT 研究报告中,异基因 HSCT 后 OS 为58%,复发率为16%。即使较低危 MDS 患者接受 allo-HSCT 后的复发风险低于较高危MDS 患者,多状态比较也不支持较低危患者接受alloHSCT。但HMA治疗失败的患者预后通常较差,即使较低危患者也应考虑allo-HSCT。目前建议进行allo-HSCT的较低危MDS 患者包括重度血细胞减少或疾病进展的患者,以及常规治疗失败的患者;如果除 IPSS-R 外还存在其他不利因素,如骨髓纤维化或不良分子遗传学,也可能需要 HSCT。
HSCT 后的预后强烈依赖于细胞遗传学和分子遗传学特征,不良细胞遗传学如复杂核型或单体核型与较高的复发和死亡风险相关。最近推出的 IPSS-M 反映了分子遗传学越来越重要,ASXL1和 RUNX 和 p53 以及 RAS 通路突变是 HSCT 后较高复发和死亡率的独立风险因素,联合分子遗传学和细胞遗传学可更好地预测 HSCT 后的结局。IPSS-M 通常会将患者转变为高危,两项回顾性研究报告在 allo-HSCT 前使用 IPSS-M 预测 MDS 具有适度优势。根据 IPSS-R 归类为低危的 MDS 患者可根据 IPSS-M 归类为高危,因此成为异基因移植的候选者。然而IPSS-M在 HSCT 决策中的作用目前正在评估中。尽管干细胞移植后 p53 阳性患者的预后较差,但BMT-CTN 1102研究的事后分析显示,与非移植相比,干细胞移植后 TP53 单打击和 TP53 多打击以及无 TP53 突变的 IPSS-M 高危患者的生存率提高。建议在 HSCT 前进行分子检测,以排除遗传性骨髓衰竭症状和生殖系突变,如GATA2、SAMD9/SAMD9L、RUNX1、ETV6和DDX41,其可能影响预处理方案和供者选择。校正其他风险因素后,年龄本身与总生存期较差无关,但体能状态、共病指数和 Karnofsky 指数较差与较高的非复发死亡率 (NRM) 相关,即使并非所有共病均导致相似的 NRM 风险。虽然移植前原始细胞减少对预后有积极影响,且国际专家团队推荐原始细胞≥10%的 MDS 患者进行移植前治疗,但尚无比较移植前治疗与无治疗的前瞻性研究,大多数关于 HMA 或化疗的回顾性研究未显示对移植后 OS 的显著影响,可能是因为无应答患者的结局在 HSCT 后恶化。
所有体能状态良好且无严重合并症的“较高危”MDS患者均应考虑接受根治性异基因HSCT,而年龄本身不应视为禁忌。如果常规治疗失败且存在高危分子遗传学,较低危MDS 患者也可能从异基因 HSCT 中获益。在任何情况下,还需要平衡 HSCT 的风险与接受/不接受移植的预期寿命,以及考虑患者意见。
预处理方案强度的回顾性研究显示,清髓性预处理方案的 NRM 较高,但复发较少。一项前瞻性 EBMT 研究 (RICMAC) 显示 MAC 和减低强度预处理 (RIC) 之间的预后无差异。AML 和 MDS 的 BMT-CTN 研究显示 RIC 后复发风险较高,但MDS患者数量有限。与基于白消安/氟达拉滨的 RIC 方案相比,曲硫烷的结局更好;与基于白消安/氟达拉滨的 RIC 方案相比,基于美法仑/氟达拉滨的 RIC 方案的复发更少。在单倍体相合干细胞移植中,非亲缘供者的广泛可用性和移植后环磷酰胺 (PTCy) 作为 GVHD 预防的引入进一步增加了供者库和 MDS 异基因 HSCT 的数量,登记组研究表明,PTCy单倍体 HSCT 的预后与相合非亲缘供者HSCT 相似。由于复发是 MDS HSCT 后最常见的治疗失败,因此通过引入移植后维持策略降低复发风险是一个热点,目前正在进行强化临床研究。用嵌合体或分子标记与敏感测序方法进行移植后监测有助于指导移植后干预。然而,迄今为止最大的 AML 和 MDS 患者 阿扎胞苷维持治疗研究未显示 HSCT 后复发减少。
预防或延迟复发的新方法是在 p53 突变的 MDS 中使用 eprenetapopt 加阿扎胞苷,或在 IDH2 突变的 MDS 或 MRD 触发抢先使用阿扎胞苷的情况下使用enasidinib。供者淋巴细胞输注 (DLI) 单独或联合适用于复发患者,但作为预防性治疗的现有数据尚不确定。正在进行的抢先 DLI 前瞻性研究以及口服阿扎胞苷或阿扎胞苷/维奈克拉联合维持治疗的结果待定,因此目前无法给出有效的建议。图2总结了 MDS 患者移植过程中的不同步骤和干预措施。

总结
MDS 是一种高度异质性疾病,其特征为多种细胞和分子机制,疾病预后介于预期寿命正常、无症状至重度全血细胞减少、疾病进展迅速和生存期极差。事实上,MDS起源于造血干细胞限制了其治疗选择,与任何其他血液肿瘤相比,MDS获得许可的新药较少。另一方面,疾病往往在几年内发展,来自克隆造血领域的经验教训可能会提供新的工具来影响克隆竞争,且是以一种比突变的对应物更有利于健康干细胞的方式。目前正在探索几种新的途径来改善红细胞生成和唯一治愈方案(干细胞移植)的结果,且正在稳步改善。
参考文献
Hellstrom-Lindberg ES,Kröger N. Treatment of myelodysplastic syndromes.BLOOD.2023. Doi:10.1182/blood.2023020079


