Nature:临床试验将溶瘤免疫激活与胶质母细胞瘤的存活联系起来
时间:2023-10-31 14:41:17 热度:37.1℃ 作者:网络
高档神经胶质瘤(HGGs)是神经胶质来源的中枢神经系统肿瘤,具有高度恶性的形态学和遗传特征。其中,GBM的特点是生存率最差,神经外科切除和化疗后迅速复发。复发性HGG(rHGG),包括复发性GBM(rGBM),其特征是神经系统快速发病和存活不到10个月。尽管人们对HGG/GBM的遗传学、细胞组成和进化知之甚多,但这尚未转化为成功的疗法。

传统的免疫疗法在rHGG/rGBM中也无效。这被认为是由于高度免疫抑制的肿瘤微环境(TME)导致的浸润抗肿瘤淋巴细胞稀缺,将这些肿瘤定义为“淋巴细胞耗尽”。对于rGBM和其他几种高度免疫抑制的固体癌症,需要找到可以将TME转化为更适合免疫治疗和免疫激活的治疗模式。
溶瘤病毒是一种免疫疗法,其中溶瘤病毒诱导的溶瘤改变 TME,促进促炎途径,通过暴露病毒和可能的肿瘤抗原激活常驻和新招募的免疫细胞。几种溶瘤病毒已经并将继续在肿瘤学中进行测试,其中一种被批准为单剂注射到黑色素瘤,第二个被批准用于注射rGBM。值得注意的是,HGG的几个早期溶毒病毒临床试验已发表在最近的备受瞩目的文献中。然而,缺乏对使用溶瘤病毒治疗的rGBM的免疫学分析,其数量足以与治疗结果相关联。
2023年10月18日发表在Nature的文章,研究人员报告了41名rHGG/rGBM患者首次第一期临床试验的安全数据,这些患者接受了CAN-3110——一种源自单纯疱疹病毒1型的溶瘤病毒。研究人员发现,CAN-3110后生存反应最长的患者的特征是HSV1血清学阳性,CAN-3110从受感染肿瘤中清除,T细胞衣型指标的差异,以及与免疫激活计划相关的肿瘤转录特征。
这些发现提供了人类免疫学和生物学证据,支持膀胱内溶瘤治疗模式,将免疫抑制性TME改变为更有利于免疫治疗的方式,为许多否则不会受到免疫排斥的固体癌症的治疗提供了广泛的相关性。在CAN-3110的首次人体临床试验中,尽管CAN-3110持续/复制了几个月,并且维持了ICP34.5神经毒性基因,但没有看到HSV脑膜炎或脑炎。所有炎症反应仍然局限于注射的肿瘤,没有在周围的脑组织中检测到。HSV血清阳性和HSV血清阴性患者也是如此。
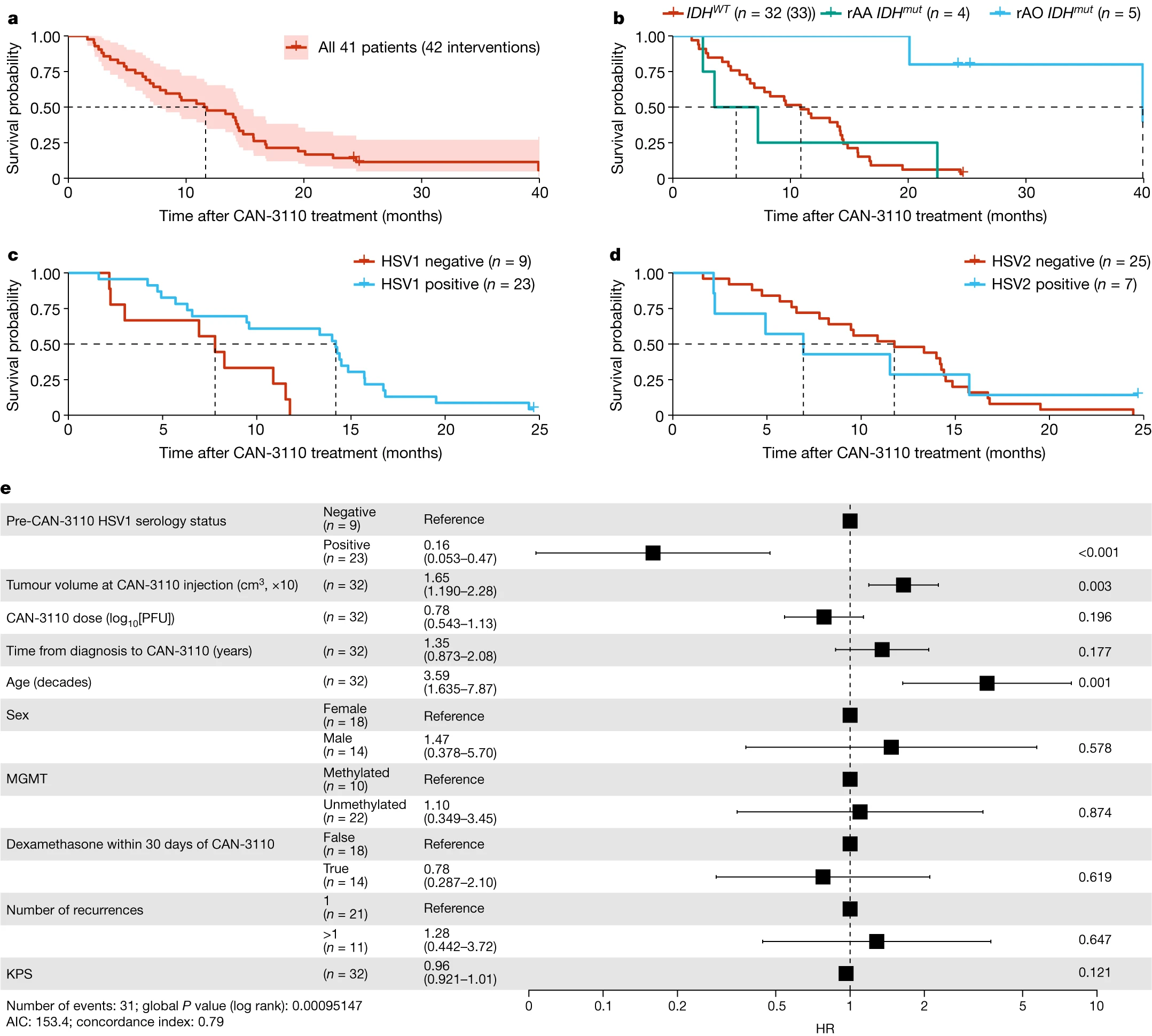
生存数据
综上所述,用CAN-3110单时间点在瘤内注射rHGG/rGBM用TILs丰富肿瘤微环境,诱导外周和肿瘤T细胞目录以及肿瘤转录组特征的明确变化。这些变化在HSV1血清阳性的患者中尤为明显,并且与这种治疗难治性癌症的生存率提高有关。因此,这些发现提供了人类免疫学和生物学证据,支持病际间溶瘤模式,将许多实体癌的免疫抑制TME特征转换为更有利于肿瘤免疫排斥的TME。
原文出处
Ling, A.L., Solomon, I.H., Landivar, A.M. et al. Clinical trial links oncolytic immunoactivation to survival in glioblastoma. Nature (2023). https://doi.org/10.1038/s41586-023-06623-2


