Nature:STING抑制肺腺癌休眠转移细胞的再激活
时间:2023-10-16 08:31:29 热度:37.1℃ 作者:网络
转移经历播散、休眠和定植三个不同的阶段。转移起始细胞(MIC)从原发肿瘤播散并播种至多个器官,进入亚临床休眠状态。在休眠期间,MIC在静止状态和增殖状态之间转换,增殖细胞在全身免疫监视下被清除。获得免疫逃避和器官特异性生长适应的MIC能够退出休眠并产生临床上明显的大转移灶。在播散和休眠期间,MIC与宿主免疫处于动态平衡状态,而免疫监视失败导致转移性暴发和器官定植。转移通常由在原发性肿瘤明显成功治疗后仍处于休眠状态的播散性癌细胞发展而来。目前对重新唤醒的转移细胞的清除以及如何在治疗上激活该过程以消除患者体内的残留疾病知之甚少。
本研究旨在探讨转移起始细胞被重新激活后的免疫监视机制,即机体免疫监视清除休眠增殖期细胞的潜在调控因子。研究使用惰性肺腺癌转移的模型来鉴定退出休眠期间免疫反应性癌细胞内在决定因素。肿瘤内在免疫调节因子的遗传筛选确定干扰素基因刺激因子(STING)是肿瘤转移性爆发的抑制因子。证据如下:1)STING活性在重新进入细胞周期的转移祖细胞即休眠增殖期细胞中增加。2)STING启动子和增强子的高甲基化在转移性爆发时下调STING的表达。TGFβ在休眠期间通过抑制增强子介导STING表达下调。3)用STING激动剂对小鼠进行全身治疗可消除休眠转移,并以T细胞和自然杀伤细胞依赖性方式防止自发爆发。因此,STING为预防休眠转移的进展提供了一个检查点,并为预防疾病复发提供了治疗上可行的策略(Nature.2023 Apr;616(7958):806-813. doi: 10.1038/s41586-023-05880-5) 。
1、免疫监视下惰性肿瘤转移模型的构建
为了确定休眠转移性爆发的免疫抑制因子,作者在使用的模型中,将来自早期肺腺癌(LUAD)的癌细胞接种到小鼠的动脉循环中以填充不同的器官,其中转移瘤保持休眠数月,很少自发爆发(图1a)。当注射到同基因免疫功能正常的C57BL/6小鼠或C57BL/6来源的B6白化小鼠中时,与来自侵袭性KP LUAD肿瘤(KP-482T1细胞)的细胞相比,KPad1细胞显示出惰性转移表型(图1b)。KPad1细胞在通过中和抗体处理耗尽NK细胞、CD4+T细胞或CD8+T细胞的B6白化小鼠中迅速形成多器官转移性疾病(图1e-f)。因此,免疫监视限制了KPad1模型中休眠肿瘤的转移进展。
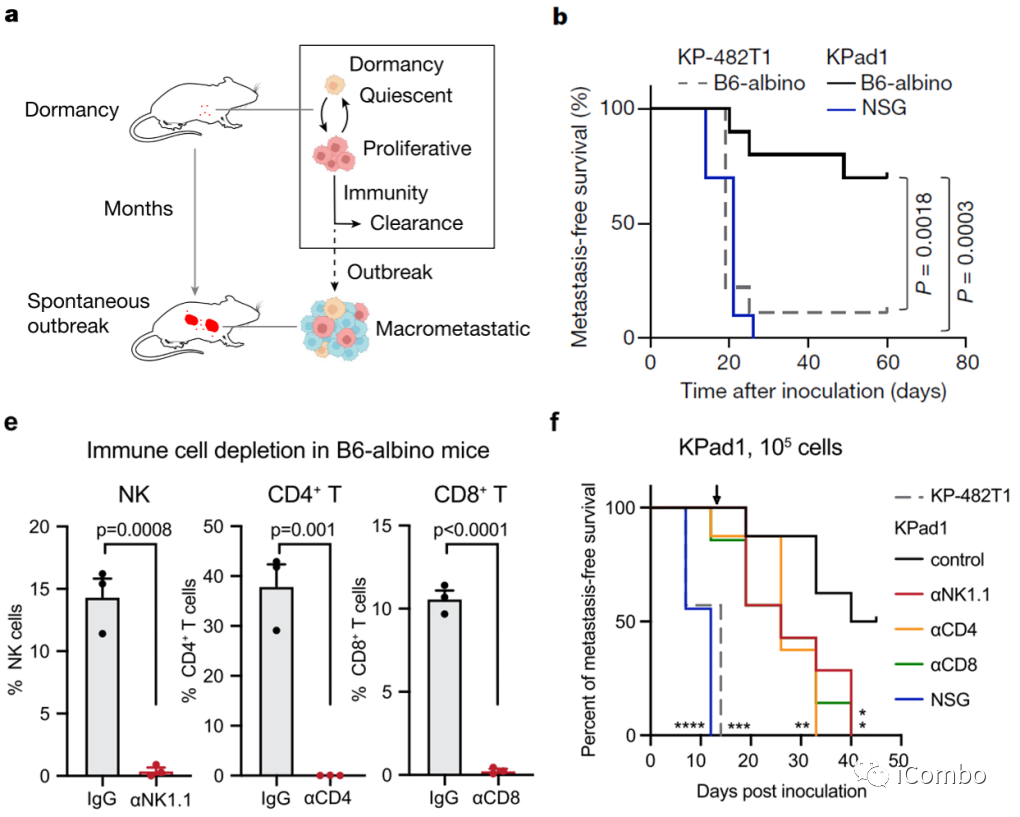
图1
将H2087-LCC(来源于I期LUAD患者)接种到Foxn1nu的无胸腺裸鼠中,H2087-LCC细胞填充在肺、肝脏、骨髓和肾上腺中,保留为静止的单细胞和很少形成大肿瘤的小增殖簇,这种表型与侵袭性晚期LUAD细胞系H2030-BrM产生的表型形成鲜明对比,后者引起侵袭性多器官转移(图2a)。虽然只有一小部分携带H2087-LCC的小鼠发生转移,但当用aGM1抗体处理以消耗NK细胞时,几乎所有小鼠都发生了多器官转移(图2b-c)。
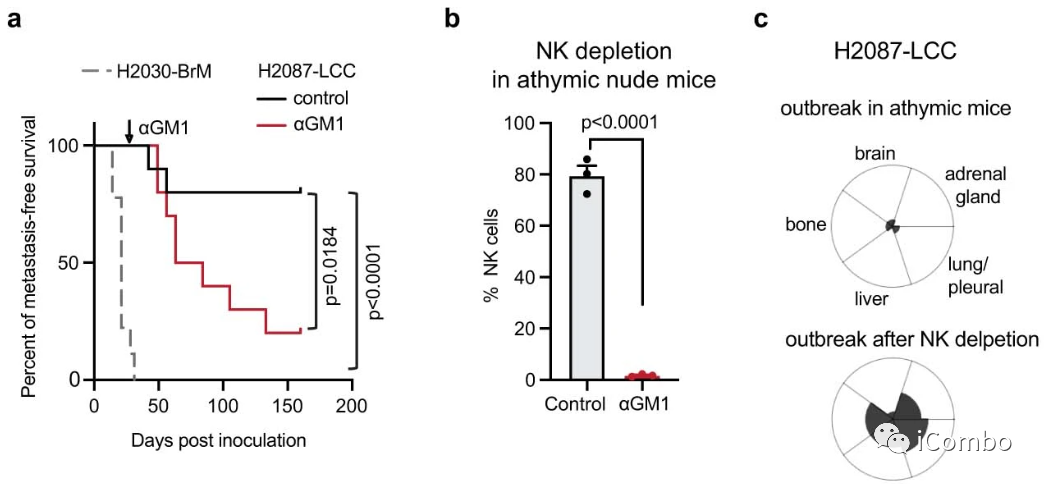
图2
2、肿瘤内在免疫调节基因文库筛选确定STING为转移性爆发的抑制因子
为了鉴定从休眠转移中退出细胞的自主抑制因子,我们使用靶向H2087-LCC和KPad1细胞中的各种免疫激活因子的sgRNA文库在体内进行了CRISPR筛选(图3d)。将文库转导的H2087-LCC和KPad1细胞心内注射到受体小鼠的动脉循环中,以扩散到多个器官。为了评估肺定植活性,将文库转导的KPad1细胞分别注射到受体小鼠的尾静脉中。为了最大限度地提高文库在体内的代表性,我们将文库分成子池,每个子池靶向20个基因(每个基因5个sgRNA),然后进行文库转导和选择表达sgRNA的癌细胞。使用荧光素酶生物发光成像纵向监测转移性疾病的发展,并从显示明显转移的小鼠中单独收集脑、肺、肝、骨和肾上腺组织(图3d)。为了鉴定助长这种转移性爆发的候选sgRNA,我们从单个器官中分离出基因组DNA,然后进行测序以量化sgRNA的富集。几个sgRNA池增强了H2087-LCC和KPad1细胞向多个器官的转移活性,这表明这些途径中一个或多个基因的功能丧失足以允许重新唤醒的休眠癌细胞的转移进展(图3e-f),与先前的研究表明NK细胞和T细胞抑制休眠转移的重新唤醒一致,靶向特定NK激活配体和MHC-I类分子的sgRNA是所有筛选中富集最高的分子之一,支持筛选模型和结果的稳健性。与STING途径相关的多个基因(STING、IFNB1和CCL5)和STING下游的干扰素响应基因(IFI27和IFITM3)是H2087-LCC和KPad1筛选中排名最前的sgRNA靶标(图3g)。
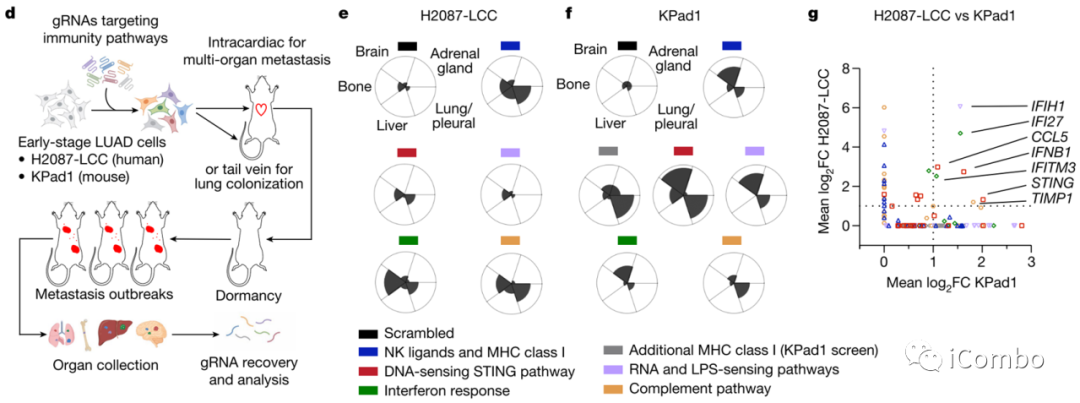
图3
3、休眠增殖期细胞的STING表达增加且通路活性增强
将1×105的H2087-LCC细胞接种在无胸腺小鼠中,接种后4周收集器官以捕获休眠状态,并在接种后10-13周收集器官以捕获自发爆发(图4a)。播散癌细胞在休眠期间以静止状态(Ki67低表达)和增殖状态(Ki67高表达)存在。相比于低增殖活性或转移形成的肿瘤细胞,高增殖活性的休眠肿瘤细胞STING表达增加,STING诱导的趋化因子CCL5表达水平升高(图4a-b)。相比于原发灶,LUAD患者转移灶中STING表达减少,CCL5表达水平降低(图4c-g)。
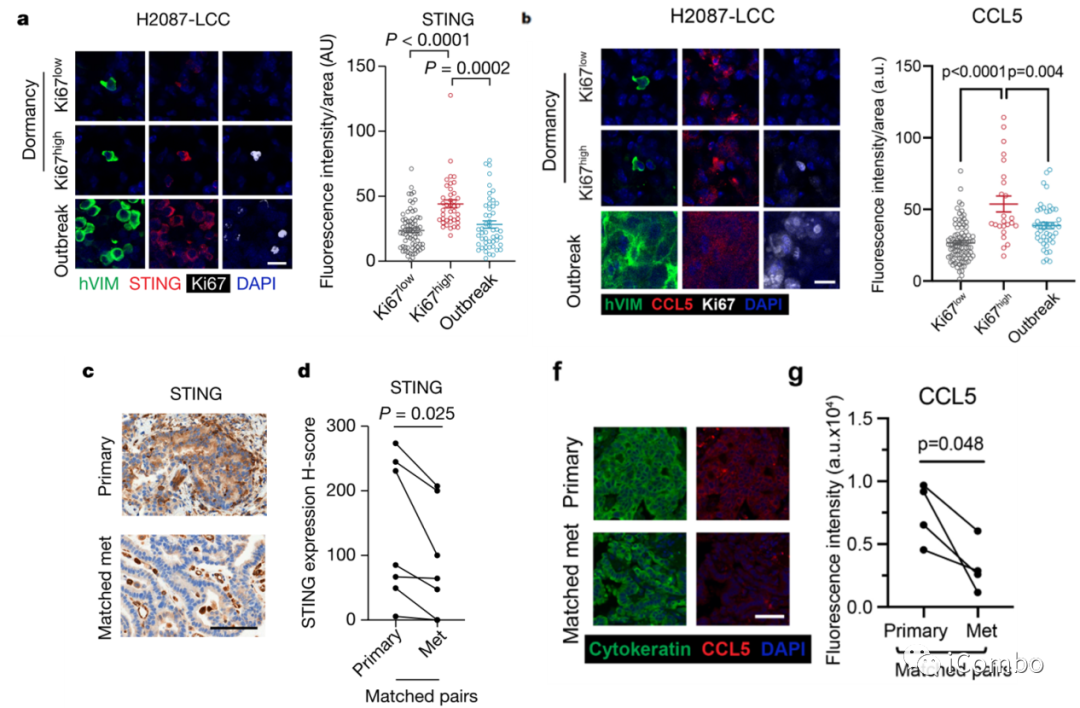
图4
4、肿瘤内在STING的激活可抑制转移,且此作用依赖于NK和CD8+T细胞
为了确定STING对转移进展的影响,作者发现敲除H2087-LCC细胞中的STING加速了肿瘤转移性爆发的发生率,并恶化了接种这些细胞的小鼠的无转移生存率(图5a)。相反,在具有多西环素诱导的STING过表达的H2087-LCC-SO细胞中,多西环素给药后7天将这些细胞接种到无胸腺小鼠中,增加了无转移存活时间(图5b)。KPad1细胞中的STING敲除增加了其在免疫功能小鼠中的转移活性(图5c),而STING过表达抑制了KP-482T1细胞的强转移活性(图5d),STING敲除促进多个器官的转移(图5e)。
STING对KP-482T1转移的抑制作用取决于NK细胞和CD8+T细胞,因为抗体介导的小鼠中这些细胞群的耗竭消除了STING抑制转移的作用(图5f)。NK细胞(抗NKp46染色)和T细胞(抗CD3染色)的免疫荧光分析显示,响应STING过表达的浸润NK细胞和T细胞的比例增加(图5g-h)。

图5
5、在转移性爆发时,启动子和增强子区的高甲基化下调STING的表达
甲基化DNA免疫共沉淀实验(MeDIP)分析,发现与H2087-LCC休眠肿瘤细胞相比,H2087-LCC自发转移性细胞群(SO1和SO2)以及侵袭性细胞(H2030 和 A549 )中STING启动子区和增强子区甲基化水平增加(图6a)。用100nM的DNMT抑制剂5-氮杂-2’-脱氧胞苷(地西他滨)处理H2087-LCC、H2087-LCC-SO1和H2087-LCC-SO2细胞,作者发现DNMT1抑制剂可提高转移性细胞中STING的表达(图6b)。为了在体内验证这些观察结果,我们从自发爆发中新鲜分离出的H2087-LCC肿瘤细胞,并对STING启动子和3’增强子进行了亚硫酸氢盐测序分析。与NSG小鼠或H2087-LCC细胞相比,大约一半的CpG位点在自发转移性细胞和侵袭性细胞中显示出更高水平的STING增强子和启动子区甲基化(图6c-d)。
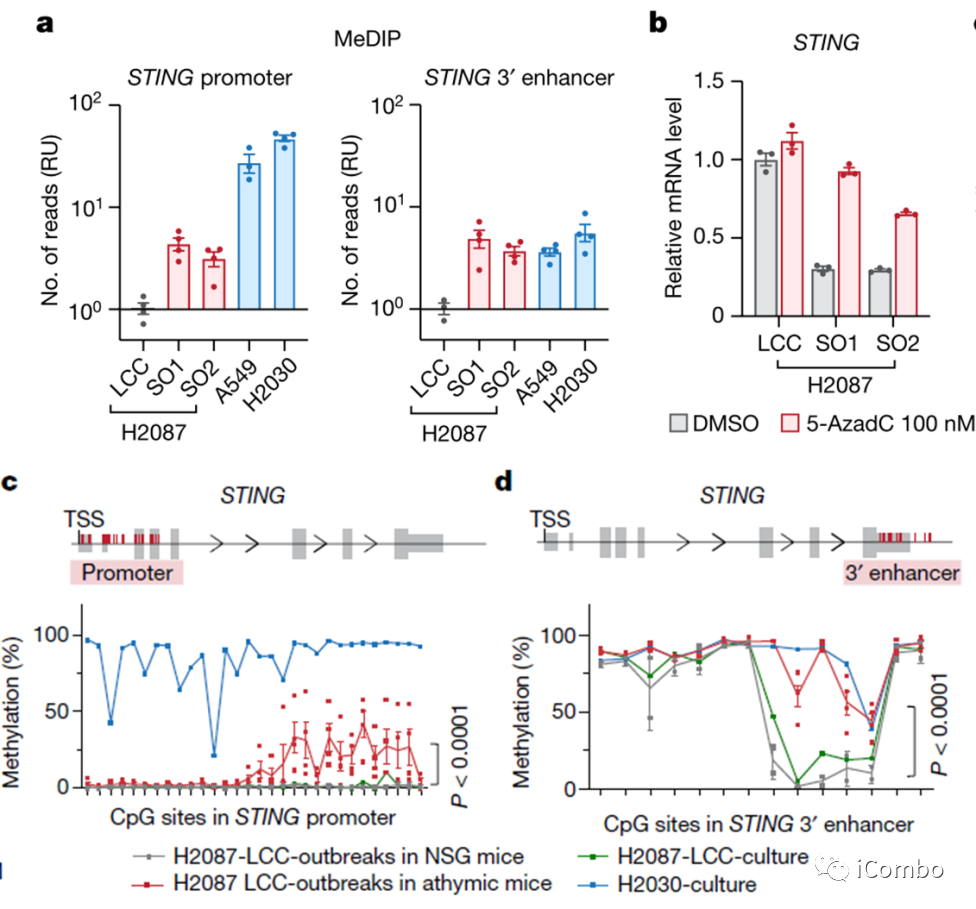
图6
6、TGFβ在休眠期间通过抑制增强子介导STING表达的下调
为了研究休眠细胞中STING下调的机制,我们观察了H2087-LCC细胞对TGFβ的反应。我们用TGFβ或palbociclib处理H2087-LCC细胞,palbociclib是一种CDK4 / 6抑制剂,可特异性诱导细胞周期停滞。TGFβ和palbociclib都能抑制细胞增殖(图7a-b),但只有TGFβ导致STING表达水平降低(图7c)。组蛋白修饰标记的ChIP-seq分析表明,TGFβ导致STING 3’增强子中H3K27ac活化标记的丢失,但不影响H3K4mel标记的增强子建立或增强子DNA甲基化(图7f-g)。总之,这些结果表明TGFβ在休眠期间通过抑制增强子乙酰化介导STING表达的下调;以及启动子和增强子的高甲基化在转移性疾病爆发中下调了STING表达(图7h)。

图7
7、STING激动剂的使用有助于清除残存的休眠肿瘤细胞并抑制转移
接下来,作者将野生型或Sting KO的KPad1细胞接种到同系免疫活性小鼠中,将H2087-LCC细胞接种到无胸腺裸鼠中,允许播散细胞在远处器官中定居一周(KPad1)或两周(H2087-LCC),然后在每个模型的休眠期内开始每周用MSA-2(一种具有抗肿瘤作用的非核苷酸STING激动剂)治疗两周(KPad1)或四周(H2087-LCC),最后收集大脑和肺部以量化播散性肿瘤实体(DTE)(图8a)。用MSA-2治疗导致播散性癌细胞的STING依赖性耗竭,与WT细胞相比,Sting KO的KPad1或H2087-LCC细胞接种后收集的DTEs数量更多(图8b,e)。此外,MSA-2延长了接种WT(而不是Sting KO)的KPad1细胞的小鼠的无转移生存期和总生存期(图8c-d)。由于H2087-LCC模型中自发暴发不常见,作者在最后一次MSA-2治疗后一周耗尽NK细胞,以允许MSA-2治疗后剩余的癌细胞形成转移。结果显示,MSA-2治疗降低了转移的发生率,这种效应也取决于癌细胞中的STING(图8f-g)。

图8
结论:
本研究阐明了STING抑制肺腺癌潜伏性转移重新激活的机制。证明了药理学上激活STING可作为消除休眠期肿瘤细胞和预防疾病复发转移的治疗策略,为探索以STING为靶点的抗癌治疗提供了可能。目前使用STING激动剂进行的临床试验是在晚期肿瘤的情况下进行的,然而,休眠转移微环境与晚期转移微环境非常不同。在辅助治疗中针对休眠转移的特定脆弱性可能为预防转移提供独特的机会。本研究的观察结果值得进一步研究,以在辅助治疗中合理利用免疫系统。
文献解读者:吴君万
中山大学肿瘤防治中心生物治疗中心张晓实教授课题组博士生
原始出处:
Hu J, Sánchez-Rivera FJ, Wang Z, Johnson GN, Ho YJ, Ganesh K, Umeda S, Gan S, Mujal AM, Delconte RB, Hampton JP, Zhao H, Kottapalli S, de Stanchina E, Iacobuzio-Donahue CA, Pe'er D, Lowe SW, Sun JC, Massagué J.STING inhibits the reactivation of dormant metastasis in lung adenocarcinoma.Nature. 2023 Apr;616(7958):806-813. doi: 10.1038/s41586-023-05880-5.

