【论著】| 多原发性早期肺癌立体定向放射治疗后疗效及患者预后分析
时间:2023-10-15 11:26:55 热度:37.1℃ 作者:网络
[摘要] 背景与目的:越来越多的多原发性早期肺癌患者选择接受立体定向放射治疗(stereotactic body radiation therapy,SBRT),本研究旨在回顾性分析SBRT的疗效及预后因素。方法:符合纳入标准的2014年8月—2020年12月于上海交通大学医学院附属胸科医院接受SBRT的241例患者进入本研究,对其中的多原发性早期肺癌患者进行疗效及预后因素分析,并采用倾向性评分匹配(propensity score matching,PSM)后,观察与单原发性早期肺癌SBRT效果的差异性。结果:241例接受SBRT的早期肺癌患者纳入本研究,其中多原发性早期肺癌94例,3和5年局部控制率(local control rate,LC)、无进展生存率(progression-free survival,PFS)和总生存率(overall survival,OS)分别为87.1%和71.3%、84.0%和66.9%、 93.3%和79.3%。多原发性早期肺癌患者无3级以上肺炎毒性率,合计毒性率为54.3%,24例(25.5%)患者出现2级毒性。18例(19.1%)出现复发,其中多原发性早期肺癌患者出现局部复发、区域复发、远处转移及不确定性死亡分别为3例(3.2%)、1例(1.1%)、12例(12.7%)及2例(2.1%)。PSM前,多原发性早期肺癌患者与单原发性早期肺癌患者的临床特征存在显著差异。PSM后,多原发性早期肺癌患者和单原发性早期肺癌患者各有56例,在LC(P=0.291)、PFS (P=0.954)和OS(P=0.880)方面差异无统计学意义。94例多原发性早期肺癌患者的SBRT预后因素分析显示,年龄≥70岁是多原发性早期肺癌OS的独立危险因素。同时性和异时性多原发性早期肺癌两组间差异无统计学意义(P=0.440)。对于59例首-末次治疗间隔5年内的同时性多原发性早期肺癌患者,肿瘤病灶治疗总个数差异无统计学意义(P=0.232),多次治疗中不同治疗方法差异无统计学意义(P=0.225)。结论:多原发性早期肺癌SBRT效果较好,与单原发性早期肺癌的疗效相当,SBRT可能是多原发性早期肺癌一种良好的治疗选择。今后需要探讨多原发性早期肺癌基于年龄和肿瘤生物学行为的病灶局部干预策略和技术。
[关键词] 多原发性早期肺癌;立体定向放射治疗;倾向性评分匹配;预后
肺癌是第二常见癌症,癌症死亡占比最高[1],需要给予更多的关注。尽管中国癌症数据[2]显示,43.7%的患者在确诊时已经达到Ⅳ期,但其中Ⅰ及Ⅱ期肺癌依旧占比不低,分别为17.3%和15.2%,并且随着低剂量计算机体层成像(cpmputed tomography,CT)的逐步广泛运用,这个比例正在逐步提高。在国外已经实施肺癌筛查计划的地区,每年有1%~3%的参与者被诊断为肺癌,其中50%~70%为Ⅰ期肺癌[3]。
原发性肺癌根据病灶的数量可分为单原发性肺癌(single primary lung cancer,SPLC)和多原发性肺癌(multiple primary lung cancer,MPLC)。据报道,MPLC作为肺癌的一种特殊类型,在所有肺癌病例中占0.2%~20.0%[4]。并且随着寿命的延长,多达15%的肺癌患者患有第二种原发性肺癌[5-10]。此外,据估计,非小细胞肺癌(non-small cell lung cancer,NSCLC)经初始治疗后,3、5和8年的第二原发性肺癌的发病率分别为5%、8%和16%[11]。
对于早期非小细胞肺癌,手术仍然是金标准[12],并且也被认为是MPLC患者的主要治疗方法[13-14]。然而,由于相当多的患者在临床上无法手术,并且随着人口老龄化,无法手术或高危患者的比例正在扩大[15]。对于这一群体,立体定向放射治疗(stereotactic body radiation therapy,SBRT)在过去10年中已成为首选治疗方法,SBRT也已成为可手术早期肺癌患者的另一治疗选择。
多原发性早期肺癌由于其独特的复杂性,包括病灶数量及类型、病灶出现的时间、不同病灶的治疗方式等,目前关于多原发性早期肺癌的最佳治疗策略和治疗技术尚不明确,SBRT用于多原发性早期肺癌治疗报道也不多。本研究对既往在上海交通大学医学院附属胸科医院接受SBRT的多原发性早期肺癌患者的疗效和预后因素进行回顾性分析。
1 资料和方法
1.1 病例资料收集
本研究回顾性收集上海交通大学医学院附属胸科医院2014年8月—2020年12月进行SBRT的早期肺癌患者的数据。纳入标准:① 既往未进行治疗或只接受过早期肺癌手术及其辅助治疗(术后有明确分期分级,且未出现淋巴结转移或远处转移)或SBRT及其辅助治疗;② 经病理学检查、正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)或CT诊断为原发性早期肺癌;③ 临床分期为cTis、T1-3N0M0;④ 年龄≥18岁;⑤ SBRT总剂量为48~70 Gy。排除标准:① 任意病灶出现淋巴结转移或其他转移;② SBRT后无随访;③ 有其他恶性肿瘤治疗史;④ 接受过其他早期肺癌手术或有其他治疗复发灶。
从病史采集系统收集患者的临床资料,收录内容主要包括人口信息(性别、年龄及基础疾病史等)、肿瘤相关信息(临床T分期、肿瘤位置及肿瘤密度)和治疗相关信息(放疗总剂量、放疗分割次数及治疗时间)等。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)肺癌第8版TNM分期标准[16]对入组病例进行临床分期。其中家族史根据患者有无肿瘤家族史及是否为肺癌家族史分为无家族史、肺癌家族史和其他肿瘤家族史。职业暴露根据职业暴露因素(氡、硅、镉、砷、铍、铬、镍、石棉、柴油烟雾、煤烟及放射性元素)分为有和无。手术指征根据接受SBRT前外科医师诊断结论分为有、无和不确定。
根据病变发生的时间不同,多原发性早期肺癌可以分为同时性和异时性多原发性早期肺癌(异时性定义为肺部肿瘤间隔>180 d,而同时性定义为肺部肿瘤间隔≤180 d)。
1.2 治疗方案
所有患者的大体肿瘤靶区(gross tumor volume,GTV)是由放射科医师在肺窗条件下划定的,临床肿瘤靶区(clinical tumor volume,CTV)是通过3个维度上对GTV扩展0.6 cm并对相应的结构进行修回形成的,内靶区(internal target volume,ITV)是依据常规模拟机下或四维CT图像上划定的,而计划靶区(planning target volume,PTV)是通过在3个维度上对ITV扩展0.5 cm获得的。放疗危及器官(organ at risk,OAR)同样是由放射科医师在CT模拟图像上划定的。所有的结构在用于计划设计之前,都由独立的放射科医师审查和批准。在SBRT患者的治疗计划设计中,遵循了美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)0915[17]中推荐的治疗计划限制,即处方剂量是处在GTV加呼吸移动、摆位和机器执行误差所形成的大体PTV(PTV-gross,PTV-G)上。要求95%的PTV-G体积被至少100%的处方剂量所覆盖,99%的PTV-G体积被至少95%的处方剂量所覆盖。PTV的最大剂量为处方剂量的111%~167%。严格遵守RTOG 0915[17]推荐的OAR剂量限制,以确保每次SBRT的放疗计划中,接受20 Gy或以上的肺部总体积占全肺体积的百分比小于10%。
治疗计划是使用Pinnacle 9.10(美国Philips Radiation Oncology Systems公司)系统中的AutoPlanning(AP)模块生成的,有10个或更多共面的6 MV光子束和调强适形放射治疗(intensity-modulated radiation therapy,IMRT)技术。直接机器参数优化(direct machine parameter optimization,DMPO)算法和筒串卷积(collapsed cone convolution,CCC)算法分别用于计划优化和剂量计算。考虑到SBRT的目标通常较小,剂量计算网格被设定为2 mm×2 mm×2 mm。治疗都是在美国Varian公司的EDGE直线加速器上进行的,该加速器配备了一个高清120多叶准直器系统。
患者按照机构的SBRT方案进行治疗。大多数患者接受的剂量为50 Gy分4或5次,60 Gy分8次,以及70 Gy分10次。分次是4或5次的治疗是隔天实施的。治疗前使用千伏锥束CT扫描,以减少摆位误差。使用6 MV X射线,通常安排10~15个照射野进行治疗。生物学有效剂量(biologically effective dose,BED)的中位数为100 Gy(75~119 Gy)。为了计算BED,将α/β的值定义为10[18]。
1.3 观察及随访
SBRT后连续2年每3个月进行1次检查,之后每6个月进行1次检查。当高度怀疑肿瘤复发或转移时,使用影像学或活体组织检查进行评估,对于那些在当地医院接受常规随访的患者通过治疗医师进行评估。并且所有患者均进行电话随访,电话随访内容主要包括复发情况、生活质量及一般情况。治疗毒性根据常见不良事件评价标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0版[19]进行评估。局部控制率(local control rate,LC)、无进展生存率(progression-free survival,PFS)和总生存率(overall survival,OS)分别与局部失败、疾病进展和死亡相关。随访时间定义根据不同情况会发生变化。其中在研究多原发性早期肺癌与单原发性早期肺癌疗效、多原发性早期肺癌的不良反应及复发模式时,随访时间定义为从第1次SBRT时间开始。之后为更好地研究多原发性早期肺癌的预后影响因素及不同治疗情况,随访时间定义为从第1次接受局部治疗的时间开始。本研究的截止日期为2022年9月1日。
1.4 统计学处理
选择可能影响多原发性早期肺癌SBRT预后的临床特征,采用Kaplan-Meier法进行预后因素的单因素分析,然后再采用COX比例风险回归模型对预后因素进行多因素分析。
为减少患者的选择偏差,在早期肺癌中利用倾向性评分匹配(propensity score matching,PSM)来匹配单原发性早期肺癌和多原发性早期肺癌的基线特征。根据以下这些因素对患者进行匹配:性别、年龄、肿瘤位置、放疗剂量、放疗次数、BED、肿瘤T分期、肿瘤密度、有无病理、有无PET/CT、吸烟情况、家族史、职业暴露史及有无手术指征[20-22]。
采用SPSS 22.0软件对数据进行统计分析。不同组别的特征用Mann-Whitney U检验、χ2检验和成组t检验进行比较。通过随访时间最大值减去最小值计算随访时间范围。通过Kaplan-Meier法绘制生存曲线,用对数秩检验进行统计学检验,并使用生命表来计算1、3和5年的LC、PFS和OS。采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 入组患者的临床特征
2014年8月—2020年12月共246例符合纳入和排除标准的原发性肺癌患者在上海交通大学医学院附属胸科医院接受SBRT,其中241例患者有随访资料,失访率为2.1%(图1)。其中有147例单原发性早期肺癌患者,94例多原发性早期肺癌患者。
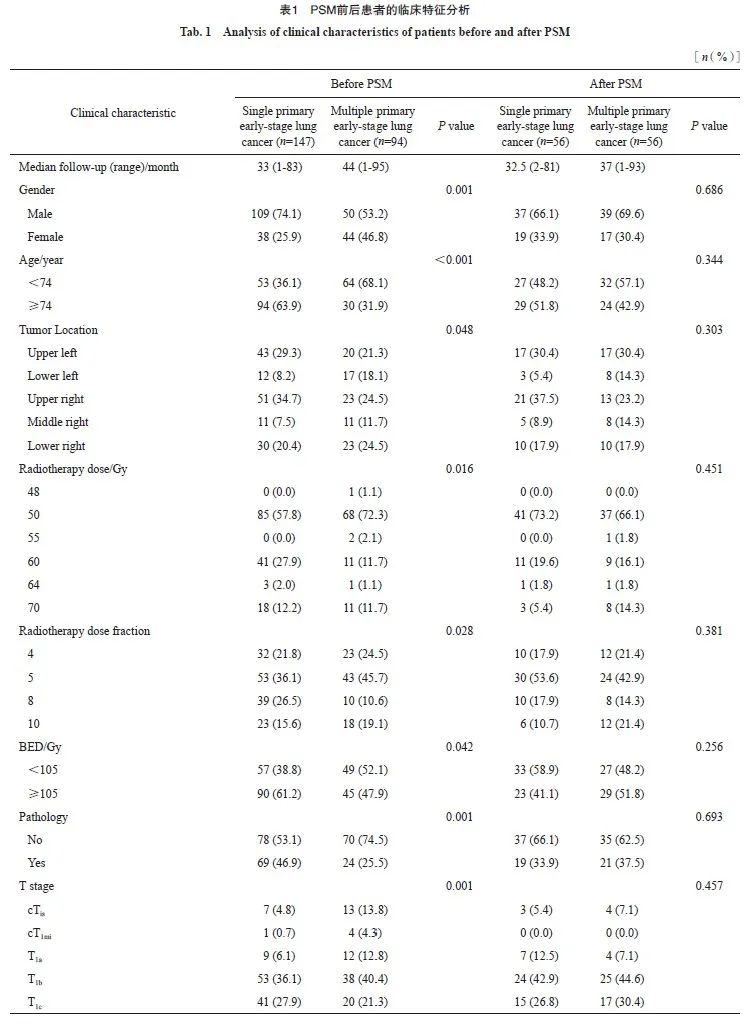
为更好地研究SBRT对单原发性早期肺癌和多原发性早期肺癌的疗效,本研究先按照第1次SBRT至末次随访计算中位随访时间等,单原发性早期肺癌和多原发性早期肺癌的中位随访时间分别为33(1~83)和44(1~95)个月。对于两组进行基线分析,发现组间差异较大,进行PSM后,每组确定了56例患者。关于性别、年龄、肿瘤位置、放疗剂量、放疗次数、BED、肿瘤T分期、肿瘤密度、有无病理学检查结果、有无PET/CT、吸烟状况、家族史、职业暴露史及有无手术指征等,两组都很均衡。两组患者PSM前后的临床特征见表1。
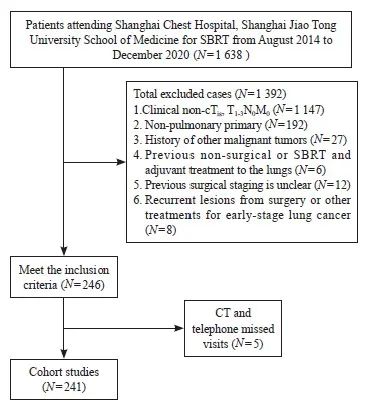
图1 患者筛选流程图
Fig. 1 Patient screening flow chart
2.2 PSM前多原发性早期肺癌疗效分析
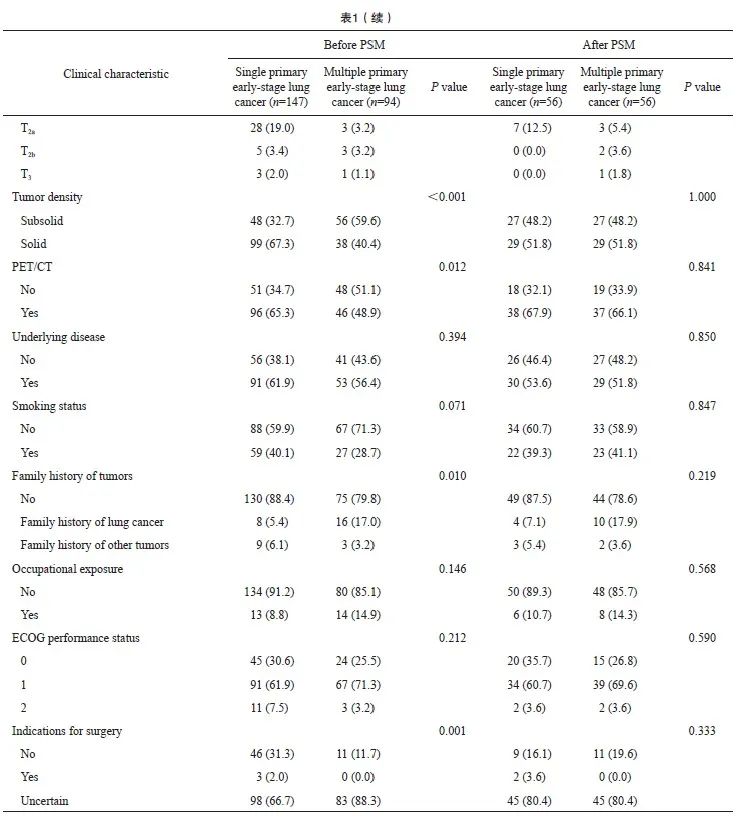
PSM前,多原发性早期肺癌患者3和5年LC、PFS、OS分别为87.1%和71.3%、84.0%和66.9%、93.3%和79.3%(表2)。通过Kaplan-Meier法生存分析显示,多原发性早期肺癌患者的PFS(P=0.035)、OS(P=0.009)比单原发性早期肺癌患者更好,但LC(P=0.490)差异无统计学意义(图2)。
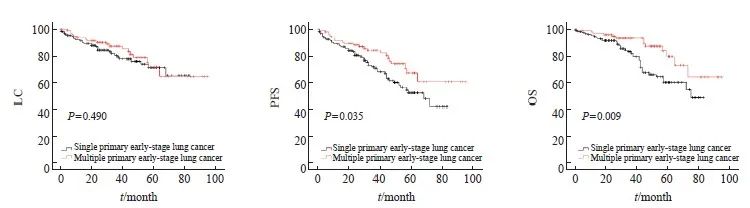
图2 PSM前LC、PFS和OS的Kaplan-Meier法生存曲线
Fig.2 Kaplan-Meier method survival curve of LC, PFS and OS before PSM
2.3 PSM前多原发性早期肺癌的不良反应及复发模式
对PSM前多原发性早期肺癌的不良反应及复发模式进行归纳,接受SBRT的多原发性早期肺癌患者无3级以上肺炎毒性率,合计毒性率为54.3%。其中27例(28.7%)患者出现1级放射性肺炎,24例(25.5%)患者出现2级放射性肺炎。
此外,在本研究可以长期随访到的、至今存活的81例多原发性早期肺癌患者中共6例患者之前或至今依旧存在不良反应,1例患者出现胸部疼痛,1例患者容易疲劳乏力,2例患者胸闷伴少量咳嗽,2例患者放疗后出现炎症发热。
PSM前94例患者中共出现18例(19.1%)复发,多原发性早期肺癌患者出现局部复发、区域复发、远处转移及不确定性死亡分别为3例(3.2%)、1例(1.1%)、12例(12.7%)及2例(2.1%)。
2.4 PSM后多原发性早期肺癌和单原发性早期肺癌的疗效分析
进行PSM后,Kaplan-Meier法生存分析表明,多原发性早期肺癌患者与单原发性早期肺癌患者在LC(P=0.291)、PFS(P=0.954)和OS(P=0.880)方面差异无统计学意义(图3)。多原发早期肺癌患者和单原发早期肺癌患者的3年LC、PFS、OS分别为83.6%和87.8%、78.5%和77.4%、88.7%和83.8%,5年LC、PFS和OS分别为70.1%和87.8%、62.5%和63.5%、72.7%和65.2%(表2)。
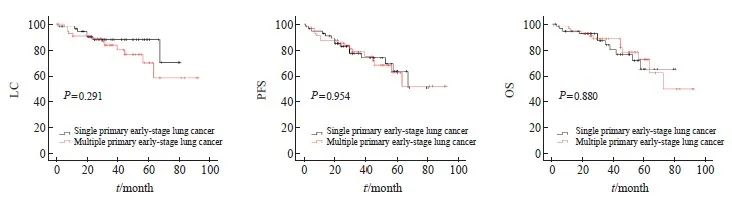
图3 PSM后LC、PFS和OS的Kaplan-Meier法生存曲线
Fig. 3 Kaplan-Meier method survival curve of LC, PFS and OS after PSM
2.5 影响多原发性早期肺癌预后的因素分析
多原发性早期肺癌的中位随访时间为63.5(19~170)个月。Kaplan-Meier法单因素分析显示,性别、年龄、肿瘤最高T分期、吸烟情况及多原发治疗总个数与预后有关。对单因素分析中提示对预后有影响的因素进行COX多因素分析,在接受SBRT的多原发性早期肺癌患者中,年龄 ≥70岁是OS的独立危险因素(表3),Kaplan-Meier法生存曲线见图4。
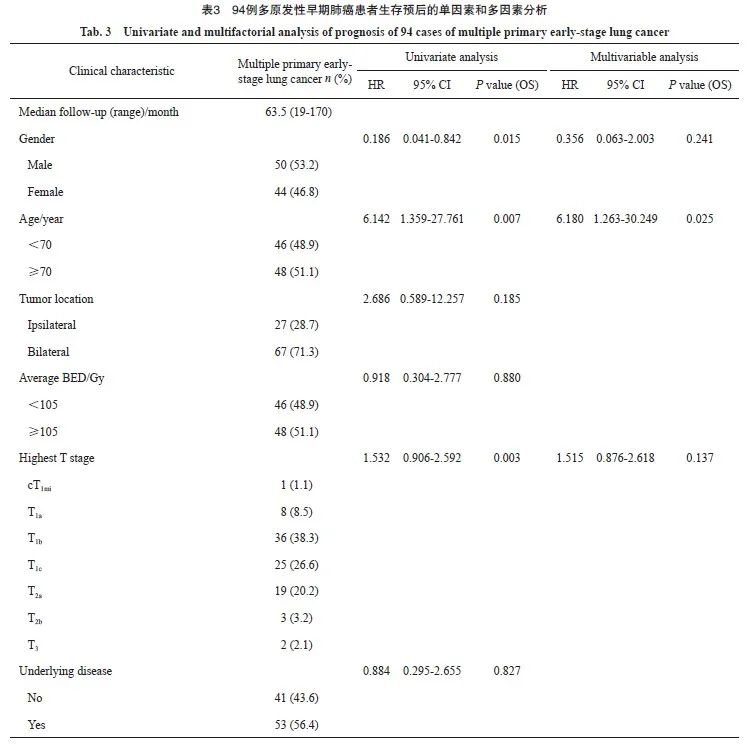

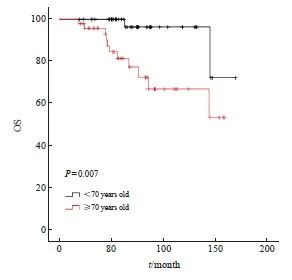
图4 年龄组间OS比较的Kaplan-Meier法生存曲线
Fig. 4 Kaplan-Meier method survival curve for OS comparison between age groups
2.6 多原发性早期肺癌中临床特征及治疗方式对预后的影响
同时性和异时性多原发性早期肺癌两组间OS差异无统计学意义(P=0.440,图5)。考虑到94例患者中有29例(31.9%)为异时性多原发性早期肺癌,且其中14例(48.2%)首-末次治疗(第1次手术至最后1次局部治疗)间隔时间大于5年,因此为更好地研究不同治疗方式对多原发性早期肺癌患者预后的影响,本研究选择对首-末次间隔5年内的59例同时性多原发性早期肺癌患者进一步分析,治疗方式见表4。
其中对于同时性多原发性早期肺癌患者,肿瘤病灶接受局部治疗的总个数与患者生存预后的差异无统计学意义(P>0.232)。考虑到同时性多原发性早期肺癌二次局部治疗间隔时间差异性很大,本研究把从初次接受局部治疗开始60个月作为随访终点,结果显示,多原发性早期肺癌中2个及以上病灶接受局部治疗的生存预后要好于单个病灶接受局部治疗,但差异无统计学意义(P=0.115,图6)。
通过对生存曲线的观察及数据回顾发现,治疗总个数为1个的21例患者,中位随访时间为45 (19~92)个月。但治疗总个数为2个及以上的38例患者中,有27例(71%)在SBRT前接受过手术治疗,且第1次手术至第1次SBRT的中位间隔时间为28(1~53)个月,导致治疗总个数为2个及以上的患者随访时间较长,差异有统计学意义(P=0.004)。通过生存曲线分析发现60个月左右差异最大(图6),为更好地给临床实践提供建议,本研究将最长随访时间设定为60个月,比较两组患者不同治疗总个数对5年生存的影响,结果差异仍无统计学意义(P=0.115)。
在多原发性早期肺癌患者治疗总个数2个及以上中,多个病灶接受过多次局部治疗,仅有SBRT与手术联合SBRT两种治疗方法在LC(P=0.514)、PFS(P=0.094)和OS (P=0.225)上差异均无统计学意义(图7)。
对于未进行后续其他病灶治疗的21例只有1个病灶只接受过1次局部治疗(局部治疗为SBRT)的患者,回顾数据发现,其中7例出现了复发或转移(2例局部复发,1例区域复发,4例远处转移)并接受了对应治疗。其余14例患者根据时间推算目前中位年龄为77(51~91)岁,其中4例超过了整体94例多原发性早期肺癌患者的中位随访时间,根据时间推算目前年龄由小到大分别为71、72、83、91岁。
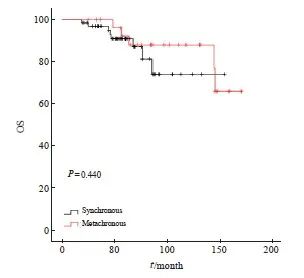
图5 同时性和异时性组间OS比较的Kaplan-Meier法生存曲线
Fig. 5 Kaplan-Meier method survival curve for OS comparison between simultaneous and metachronous groups
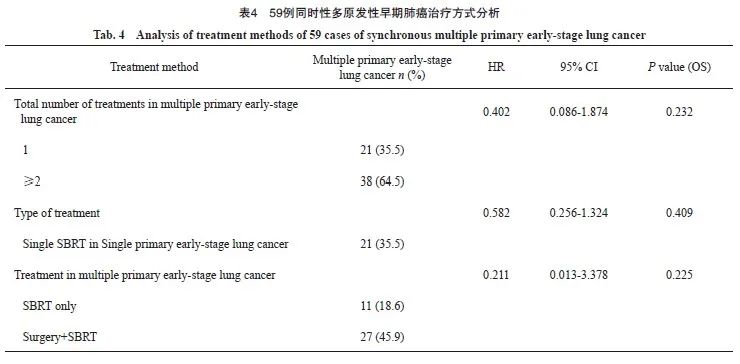
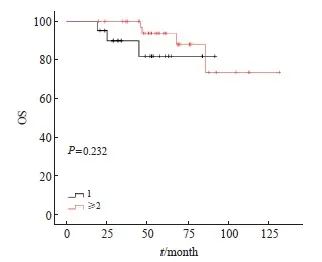
图6 接受过治疗的不同病灶数量组间OS比较的Kaplan-Meier法生存曲线
Fig. 6 Kaplan-Meier method survival curve for OS comparison between groups with different numbers of treated lesions
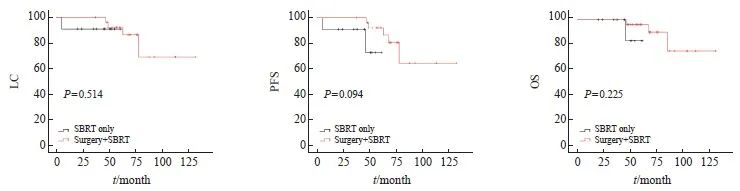
图7 38例治疗总数2个及以上的患者中不同治疗方法间LC、PFS和OS比较的Kaplan-Meier法生存曲线
Fig.7 Kaplan-Meier method survival curve for comparison of LC, PFS, and OS among different treatment methods in 38 patients with a total of 2 or more treatments
3 讨 论
目前对多原发性早期肺癌的SBRT研究较少,为此本研究详细探究了各种情况。本研究结果显示,多原发性早期肺癌SBRT的总体效果良好,3和5年的LC、PFS、OS分别为87.1%和71.3%、84.0%和66.9%、93.3%和79.3%。既往Chang等[23]的研究也提示多原发性早期肺癌在接受SBRT后效果良好。
本研究中,多原发性早期肺癌SBRT后未出现3级以上的毒性反应,24例(25.5%)患者出现2级毒性,与Raju等[24]的研究结果相似,14例(23%)患者出现≥2级毒性,2例(3%)患者出现≥3级毒性。
此外,在本研究可以长期随访到的、至今存活的81例多原发性患者中共6例患者之前或至今依旧存在不良反应,但均不影响正常生活,这也间接表明SBRT后生存质量良好。
一些研究表明,多原发性早期肺癌SBRT后复发模式如下:Raju等[24]的研究中有25例(42%)患者出现疾病进展,9例(15%)患者出现局部复发,4例(7%)患者出现区域复发, 11例(18%)患者出现远处转移;Steber等[25]的研究中36例患者中共有13例(36.1%)出现疾病复发,3例(8.3%)患者出现局部失败,5例(13.9%)患者出现区域复发,12例(33.3%)患者出现远处转移。而本研究中共19例(17.6%)患者出现复发,而且其中不确定性死亡的患者均是电话随访为肿瘤相关性死亡,但拒绝后续随访,基本归类为局部复发以上,故总计15例(15.9%)经历了区域复发。对此,考虑可能为不规律随访所致。
本研究通过对多原发性早期肺癌与单原发性早期肺癌进行PSM,发现多原发性早期肺癌与单原发性早期肺癌经SBRT后生存差异无统计学意义(P>0.05),与既往研究[24- 26]疗效相似,即多原发性与单原发性早期肺癌经SBRT后疗效 相当。
本研究在生存方面的分析显示,多原发性早期肺癌与单原发性早期肺癌患者SBRT后的LC、OS和PFS差异无统计学意义,且所有患者均取得了满意疗效,3年LC均超过了80%,与Verstegen等[27]的研究结果相近,LC为92.4%。3年OS均超过了80%,与Chang等[23]的研究结果相近。且3年PFS均超过了75%。
本研究显示,在多原发性早期肺癌患者接受治疗时,年龄≥70岁是OS的独立危险因素。回顾数据显示,多原发性早期肺癌中总计13例患者出现死亡,4例患者死亡原因与肿瘤不相关,且均大于70岁,只有1例明确是脑梗死亡,其余3例不清楚死亡原因(1例有高血压史,其他2例均无基础疾病史)。考虑年龄大、预后差可能与患者的自然非肿瘤性死亡相关。
本研究通过生存曲线分析显示,同时性和异时性多原发性早期肺癌疗效无显著差异。Raju等[24]研究显示,同时性多原发性早期肺癌患者2和5年OS分别为70%和48%。Miyazaki等[28]研究显示,异时性多原发性早期肺癌患者5年OS为65.8%,这与本研究结果相近。
为研究同时性多原发性早期肺癌患者中治疗总个数之间有无差异,将最长随访时间设定为60个月,尽管不同治疗总个数Kaplan-Meier法生存分析显示,差异均无统计学意义(P=0.115),但仍然可以看出治疗多个病灶具有更好的预后趋势。可能有3种原因:① 本研究样本量少;② 有类似年龄等混杂因素的干扰;③ 多原发性早期肺癌患者较多的病灶依旧考虑为惰性病灶,如纯磨玻璃结节等,且经过临床医师考虑,已经对其中风险较大的病灶进行过处理,提示需要治疗的病灶应进一步筛选。
对于多原发性早期肺癌中21例只接受过1次局部治疗(局部治疗为SBRT)的患者,未进行后续其他病灶治疗的原因,考虑可能年龄较大,且定期随访中未出现肿瘤复发、进展等情况,因此未进行后续其他病灶的局部治疗。
在治疗总个数2个及2个以上的同时性多原发性早期肺癌患者中,多个病灶接受过多次局部治疗,仅有SBRT与手术联合SBRT两种治疗方法在LC、PFS及OS上的差异均无统计学意义。对于多原发性早期肺癌患者,多个病灶接受过多次局部治疗,无论是多次SBRT还是手术联合SBRT,其疗效相似,5年OS分别为83.3%和96.2%。与Nikitas等[26]的研究结果相似,多次SBRT中异时性SBRT、多次SBRT中同时性SBRT和手术联合SBRT的3年OS分别为79.7%、46.4%和95.4%。
本研究有望为多原发性早期肺癌患者进行SBRT提供一些参考数据,但有一定的局限性:① 作为回顾性研究,虽然利用PSM来减少患者的选择偏倚,但不可避免地仍有偏倚;② SBRT后部分患者随访不定期,数据可能不全面;③ 放射诊断科医师对CT图像中显示的肺结节的数量及性质、种类的描述部分不全,可能会因为统计者的经验有所偏差。
多原发性早期肺癌SBRT后疗效较好,与单原发性早期肺癌无显著差异,不良反应小,耐受性好。同时性和异时性多原发性早期肺癌疗效无显著差异。多次SBRT和手术联合SBRT疗效无显著差异。今后需要探讨多原发性早期肺癌基于年龄和肿瘤生物学行为的病灶局部干预策略和 技术。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]SIEGEL R, MA J M, ZOU Z H, et al. Cancer statistics, 2014[J]. CA A Cancer J Clin, 2014, 64(1): 9-29.
[2]ZENG H M, RAN X H, AN L, et al. Disparities in stage at diagnosis for five common cancers in China: a multicentre, hospital-based, observational study[J]. Lancet Public Health, 2021, 6(12): e877-e887.
[3]OUDKERK M, LIU S Y, HEUVELMANS M A, et al. Lung cancer LDCT screening and mortality reduction-evidence, pitfalls and future perspectives[J]. Nat Rev Clin Oncol, 2021, 18(3): 135-151.
[4]MURPHY S J, AUBRY M C, HARRIS F R, et al. Identification of independent primary tumors and intrapulmonary metastases using DNA rearrangements in non-small cell lung cancer[J]. J Clin Oncol, 2014, 32(36): 4050-4058.
[5]CHANG Y L, WU C T, LIN S C, et al. Clonality and prognostic implications of p53 and epidermal growth factor receptor somatic aberrations in multiple primary lung cancers[J]. Clin Cancer Res, 2007, 13(1): 52-58.
[6]BATTAFARANO R J, MEYERS B F, GUTHRIE T J, et al. Surgical rep of multifocal non-small cell lung cancer is associated with prolonged survival[J]. Ann Thorac Surg, 2002, 74(4): 988-993;discussion 993-994.
[7]ZUIN A, ANDRIOLO L G, MARULLI G, et al. Is lobectomy really more effective than sublobar rep in the surgical treatment of second primary lung cancer?[J]. Eur J Cardiothorac Surg, 2013, 44(2): e120-e125;discussione125.
[8]STELLA F, LUCIANO G, DELL’AMORE A, et al. Pulmonary metastases from NSCLC and MPLC (multiple primary lung cancers): management and outcome in a single centre experience[J]. Heart Lung Circ, 2016, 25(2): 191-195.
[9]MASCALCHI M, COMIN C E, BERTELLI E, et al. Screen-detected multiple primary lung cancers in the ITALUNG trial[J]. J Thorac Dis, 2018, 10(2): 1058-1066.
[10]ZHAO L S, LIU C Y, XIE G Y, et al. Multiple primary lung cancers: a new challenge in the era of precision medicine[J]. Cancer Manag Res, 2020, 12: 10361-10374.
[11]BOYLE J M, TANDBERG D J, CHINO J P, et al. Smoking history predicts for increased risk of second primary lung cancer: a comprehensive analysis[J]. Cancer, 2015, 121(4): 598-604.
[12]HOWINGTON J A, BLUM M G, CHANG A C, et al. Treatment of stage Ⅰ and Ⅱ non-small cell lung cancer: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5 Suppl): e278S-e313S.
[13]WALLER D A. Surgical management of lung cancer with multiple lesions: implication of the new recommendations of the 8th edition of the TNM classification for lung cancer[J]. J Thorac Dis, 2018, 10(Suppl 22): S2686-S2691.
[14]HAMAJI M, ALI S O, BURT B M. A meta-analysis of resected metachronous second non-small cell lung cancer[J]. Ann Thorac Surg, 2015, 99(4): 1470-1478.
[15]DALWADI S M, SZEJA S S, BERNICKER E H, et al. Practice patterns and outcomes in elderly stage Ⅰ non-small-cell lung cancer: a 2004 to 2012 SEER analysis[J]. Clin Lung Cancer, 2018, 19(2): e269-e276.
[16]DETTERBECK F C, BOFFA D J, KIM A W, et al. The Eighth Edition Lung Cancer Stage Classification[J]. Chest, 2017, 151(1): 193-203.
[17]VIDETIC G M, PAULUS R, SINGH A K, et al. Long-term follow-up on NRG oncology RTOG 0915 (NCCTG N0927): a randomized phase 2 study comparing 2 stereotactic body radiation therapy schedules for medically inoperable patients with stage Ⅰ peripheral non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 103(5): 1077-1084.
[18]CHI A, WEN S J, LIAO Z X, et al. What would be the most appropriate α/β ratio in the setting of stereotactic body radiation therapy for early stage non-small cell lung cancer[J]. Biomed Res Int, 2013, 2013: 391021.
[19]Department of Health and Human Services. Common Terminology Criteria for Adverse Events (CTCAE) version 5.0[R]. Bethesda: NIH, 2017.
[20]SHIN J Y, YOON J K, MARWAHA G. Progress in the treatment and outcomes for early-stage non-small cell lung cancer[J]. Lung, 2018, 196(3): 351-358.
[21]TURNER K, BROWNSTEIN N C, THOMPSON Z, et al. Longitudinal patient-reported outcomes and survival among early-stage non-small cell lung cancer patients receiving stereotactic body radiotherapy[J]. Radiother Oncol, 2022, 167: 116-121.
[22]GULSTENE S, RUWANPURA T, PALMA D, et al. Stereotactic ablative radiotherapy in the treatment of early-stage lung cancer-A done deal?[J]. Clin Oncol (R Coll Radiol), 2022, 34(11): 733-740.
[23]CHANG J Y, SENAN S, PAUL M A, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage Ⅰ non-small-cell lung cancer: a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637.
[24]RAJU S C, PETERS G W, DECKER R H, et al. Clinical outcomes and safety profile in the treatment of synchronous nonmetastatic lung tumors with stereotactic body radiation therapy[J]. Pract Radiat Oncol, 2022, 12(2): e110-e116.
[25]STEBER C R, HUGHES R T, SOIKE M H, et al. Stereotactic body radiotherapy for synchronous early stage non-small cell lung cancer[J]. Acta Oncol, 2021, 60(5): 605-612.
[26]NIKITAS J, DEWEES T, REHMAN S, et al. Stereotactic body radiotherapy for early-stage multiple primary lung cancers[J]. Clin Lung Cancer, 2019, 20(2): 107-116.
[27]VERSTEGEN N E, LAGERWAARD F J, HASHEMI S M, et al. Patterns of disease recurrence after SABR for early stage non-small-cell lung cancer: optimizing follow-up schedules for salvage therapy[J]. J Thorac Oncol, 2015, 10(8): 1195-1200.
[28]MIYAZAKI T, YAMAZAKI T, SATO S, et al. Surgery or stereotactic body radiotherapy for metachronous primary lung cancer? a propensity score matching analysis[J]. Gen Thorac Cardiovasc Surg, 2020, 68(11): 1305-1311.


